La reconstrucción del aneurisma de la aorta abdominal (AAA) requiere del pinzamiento transversal de la aorta (cross-clamping) provocando alteraciones hemodinámicas que en cierto grupo de pacientes (enfermedad pulmonar obstructiva crónica, diabéticos, insuficientes renales, enfermedad vascular cerebral), no son bien toleradas en especial por los pacientes con cardiopatía isquémica y valvular. El interrogatorio y la exploración física aportan datos que identifican a los individuos que tienen mayor riesgo cardiovascular en especial la isquemia coronaria y necesitan evalua-ción más detenida. Entre la población probable se encuentran, pacientes con enfermedad vascular periférica, mayores de 60 años; aunque la edad por sí sola no es una contraindicación para la cirugía, ésta puede estar contraindicada en pacientes mayores de 80 años; se debe evaluar en todo el contexto el estado general del paciente (hipertensos, fumadores, con colesterol elevado (en especial VLDL) y diabéticos). Otros factores de riesgo incluyen, antecedentes familiares de enfermedad coronaria, sedentarismo y obesidad. Dentro de los pacientes que claramente poseen riesgo cardiovascular elevado están, los que han tenido infarto previo (IAM), ángor péctoris, e historia de isquemia regional.
La meta inicial consiste en definir cuáles pacientes tolerarán la cirugía sin presentar isquemia miocárdica, ya que como es bien sabido, una cirugía es el equivalente a una prueba de esfuerzo máximo.
Los estudios corrientes en todos los pacientes incluyen:
Hematimetría, perfil de coagulación, química sanguínea, Rx del tórax, electrocardiograma (ECG) y ecografía o tomografía axial computarizada (TAC) abdominal; éste último es importante si se sospecha extensión suprarrenal, y resonancia magnética (RM) en casos especiales; los estudios más utilizados como métodos diagnósticos definitivos en nues-tros pacientes fueron, la ecografía abdominal, en 55.3%, y la TAC abdominal en 44.7%. No estamos realizando aortograma en ninguno de los pacientes, por las implicaciones de costos y método invasor.
Los pacientes en los que se detecta una anomalía electrocardiográfica, constituyen el grupo de mayor riesgo y se debe prestar especial atención a él; se debe practicar un ECG con prueba de esfuerzo; la ecocardiografía para valoración de función ventricular y fracción de eyección; también puede ser necesario una angiografía coronaria con radionucleótidos o gamagrafía con talio. No hay que olvidar que algunos pacientes sin signos en el ECG presentan una alteración coronaria de moderada a grave pero corregible. En los que se detecta una alteración en las pruebas ergonométricas se debe realizar angiografía coronaria antes de la corrección del aneurisma, estos pacientes deben ser remitidos a centros de cirugía cardíaca; en nuestra serie los 6 pacientes que no se operaron por alto riesgo quirúrgico, presentaron alteración en el ECG y en la ecocardiografía por los cuales fueron remitidos.
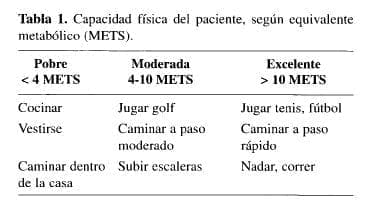
Goldman (21), resumió en 1977 una serie de factores de riesgo preoperatorio, que podían predecir a los pacientes con mayor probabilidad de morbimortalidad coronaria en cirugía no cardíaca. La capacidad física del paciente (22), puede medirse en pobre, moderada y excelente de acuerdo con los METS invertidos en cada una de las actividades, siendo un MET = equivalente metabólico (Tabla 1).
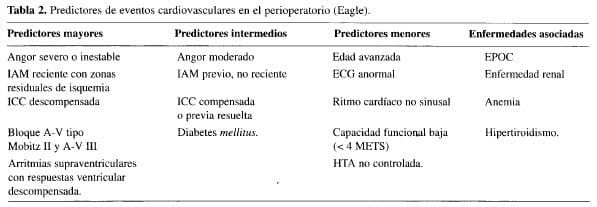
También deben revisarse los factores clínicos que pueden predecir el riesgo de eventos cardiovasculares en el perio-peratorio. Eagle (23), los divide en predictores mayores, intermedios y menores (Tabla 2). Basándonos en estos criterios, entonces se solicitan en forma más racional los exá-menes de apoyo diagnóstico, de la siguiente manera (24):
Ningún criterio: ningún test adicional
1 criterio: Ecocardiograma convencional
2 ó 3 criterios: Test talio-dipiridamol, prueba de esfuerzo
4 ó 5 criterios son: Definitivos de revascularización mio-cárdica.
Los pacientes con enfermedad oclusiva aorto-abdominal se pueden también clasificar en tres grupos, a saber (24):
Tipo I: Tienen afección aislada aorto-ilíaca limitada a la aorta distal e ilíacas primitivas, con antecedentes de tabaquismo positivo y baja incidencia de cardiopatía isquémica, con sobrevida a 5 años de 90%.
Tipo II: Tienen un proceso más difuso que incluye vasos coronarios y cerebrales, antecedentes de tabaquismo, hipertensión arterial y diabetes mellitus, con sobrevida a 5 años cercana al 80%.
Tipo III: Además de las patologías anteriores, tienen una enfermedad difusa periférica con afección a nivel femoral, poplíteo, tibial, con una sobrevida a 5 años menor del 60-65% (26).
Los pacientes con enfermedad aneurismática de la aorta abdominal al ser comparados con los anteriores, tienen una sobrevida menor (5.8 vs. 10.7 años) y es debido a la incidencia de otras patologías, especialmente cardiopatía isquémica (26, 27); en el grupo de pacientes de la serie presentada, las patologías asociadas más frecuentes fueron la hipertensión arterial en 51.1%, seguida por las cardiopatías en 25.6% y la diabetes mellitus en 12.8%.
En estos pacientes también coexiste alteración carotídea, que puede llegar de 6 a 16%, y hasta en 8% estos pacientes tienen antecedentes de insuficiencia cerebrovascular; por lo tanto, si los enfermos están sintomáticos y se detecta un so-plo carotídeo, se debería realizar un Doppler color de los cuatro vasos; las lesiones que disminuyen en 80% el diámetro de la corótida interna tienen una alta posibilidad de accidente cerebrovascular (20, 28) y se sugiere en ellos la endarterectomía carotídea antes de la cirugía aórtica.
Como se comentó anteriormente, es necesario descartar la patología coronaria; Hertzer y cols (29), realizaron angiografías coronarias en 1.000 pacientes e identificaron 25% con algún tipo de cardiopatía isquémica reversible. La incidencia de enfermedad coronaria significativa (estenosis mayor del 70%) detectada por este método fue de 37% en pacientes asintomáticos y hasta 78% en los pacientes que tenían indicación clínica. Aunque una angiografía es una prueba de alta especificidad y sensibilidad para corona-riopatía isquémica oclusiva, no está exenta de riesgos, es invasora y costosa. Entonces se recomienda utilizar otras armas del arsenal diagnóstico cardiovascular como la prueba de esfuerzo, cuya mayor limitante es la poca sensibilidad al detectar enfermedad coronaria ya avanzada y la limitación propia en los pacientes con AAA, ya que esta prueba produce una respuesta presora generalizada, riesgosa para estos pacientes (30, 31).
La angiografía con radionucleótidos proporciona una eva-luación de la fracción de eyección del ventrículo izquierdo (FEVI) en forma no invasora y se correlaciona con la pre-sencia de complicaciones posquirúrgicas en los pacientes con cardiopatía isquémica (30, 31). La prueba de esfuerzo con talio-dipiridamol (Ta-Dpd), y el ecoestrés con dobutamina/atropina, permiten reproducir el estado de vasodila-tación inducida por el ejercicio, “marcando” el miocardio lo que permite captar o no, la presencia de isquemia según el patrón gamagráfico o ecográfico al detectar cambios regionales y globales (32) permitiendo, además, revertir el efecto del Dpd. en presencia de ángor con aminofilina IV hasta en 30%, lo cual tiene alta especificidad y sensibilidad en pacientes coronarios (31). La monitoría con ECG Holter durante 1 ó 2 días, es un equivalente a una prueba de esfuerzo sub-máxima, con la ventaja de haber demostrado buena sensibilidad en la detección de episodios de isquemia asintomática que indicarían una angiografía o una gamagrafía Ta-Dpd con buena correlación entre estas pruebas (31, 33).
Una vez se identifican los pacientes con alto riesgo perio-peratorio, se decidirá si son elegibles para revascularización (by-pass coronario, angioplastia transluminal percutánea, láser transmiocárdico, angioplastia con láser, etc.) (34).
La ecocardiografía transtorácica M y B y el reciente eco transesofágico (ECO TEE), son de gran ayuda para predecir el comportamiento del miocardio y del ventrículo izquierdo durante y después del pinzamiento aórtico.
Función Pulmonar
Aproximadamente el 20 a 25% de los pacientes presenta antecedentes de enfermedad pulmonar oclusiva crónica (EPOC); se debe evaluar con una espirometría y se considera una neumopatía de consideración si el paciente presenta disnea de reposo o con ejercicio mínimo; volumen espirado en el primer segundo (FEV1) menor de 1 L, capacidad ventilatoria forzada (CVF) menor del 50% de la ideal, relación FEV1/CVF menor de 0.65, que nos alertan sobre complicaciones posquirúrgicas tipo insuficiencia respiratoria, atelectasias, síndrome de distrés respiratorio del adulto (SDRA), neumonías y ventilación mecánica prolongada (30, 34, 35). La gasometría arterial respirando oxígeno ambiental también nos proporciona una guía útil para determinar factor de riesgo pulmonar; puede encontrarse elevación de la PCO2; de ser así, estos pacientes deben ser preparados pulmonarmente antes de la cirugía, con percusión torácica, drenaje postural, tos, incentivos respiratorios, suspensión del tabaquismo, broncodilatadores e hidratación adecuada (35).
La insuficiencia renal prequirúrgica indica la morbilidad posquirúrgica (21, 37, 38). La más frecuente es la IRA posquirúrgica secundaria a necrosis tubular aguda (NTA) que se presenta en aproximadamente 5% de AAA infra-rrenal, 17% de suprarrenal y hasta 50% de torácico (26, 37). Los pacientes con niveles de creatinina por encima de 3 mg/dL, están expuestos a esta complicación. Si el paciente está siendo dializado, es preferible que la diálisis se realice el día previo a la cirugía para corregir los cambios en hemoglobina, potasio sérico y volemia. En nuestra serie no se presentaron complicaciones de este tipo y no se intervinieron pacientes renales.
Tratamiento Transoperatorio
Para mayor control hemodinámico, se aconseja la instalación del catéter de Swan-Ganz (SG), que debe colocarse un día antes de la cirugía; nos va a permitir monitorizar y realizar una adecuada reposición de volumen, cuantificar el gasto cardíaco y medir la presión capilar pulmonar (39-41). El gasto cardíaco depende de la reposición adecuada de vo-lumen y de la resistencia vascular periférica. La reposición de volumen se ajusta para que el índice cardíaco sea mayor de 2L/min/m2.
La monitoría nos permite establecer el estado ideal, planear un tratamiento específico y optimizar al máximo el estado del paciente antes de la cirugía.
El catéter de SG nos permite establecer un perfil hemo-dinámico, respiratorio y de transporte de oxígeno completo, detectando y corrigiendo precozmente aquellos parámetros que se encuentren alterados, utilizando los criterios fisio-lógicos como objetivos terapéuticos para llevar al paciente, no a los llamados valores normales, sino a los valores óptimos, entendiendo como función cardiovascular óptima la que es capaz de suplir los requerimientos metabólicos y energéticos del individuo en términos de un adecuado aporte de oxígeno acorde con la demanda, a la vez que permite la eliminación de los productos de desecho (39). El catéter de SG fue utilizado en 84.2% de nuestros pacientes y no se observaron complicaciones asociadas con su utilización.
Las mediciones que se pueden realizar con el catéter de SG se comentan a continuación
Parámetros Relacionados con Volumen
a. Volumen asistólico/índice sistólico. Este indica el volumen eyectado durante la sístole ventricular; depende de la precarga, poscarga y contractilidad. Puede ser alte-rado por disminución del retorno venoso, taquicardia y depresión miocárdica.
b. Presión en cuña pulmonar (PCP). Refleja la presión en la aurícula izquierda, nos permite calcular indirectamente la presión de fin de diástole del ventrículo izquierdo y el volumen del mismo, o sea, la precarga ventricular izquierda. Es una medida de la capacidad ventricular izquierda para recibir el volumen telediastólico como reflejo de la distensibilidad ventricular. Su valor normal oscila entre 5 y 12 mmHg.
c. Presión venosa central (PVC). Es la equivalente de la PCP para el corazón derecho. Refleja indirectamente el vo-lumen de fin de diástole del ventrículo derecho y la distensibilidad ventricular derecha; es una medida de la capacidad del corazón derecho para manejar el retorno venoso sistémico, y su valor es de 0-10 cm / H20.
Parámetros Relacionados con Flujo
a. Débito cardíaco e índice cardíaco. El débito es el vo-lumen que es bombeado por el corazón en un minuto y normalmente equivale al retorno venoso. Su valor oscila entre 5 a 5 L/min.
b. Trabajos ventriculares. Incluye el trabajo cardíaco/mi-nuto, trabajo ventricular/latido, índice de función ventricular, índice de rendimiento ventricular.
Parámetros Relacionados con el Estrés
Estos son la resistencia al flujo, la resistencia vascular sistémica (RVS) y la resistencia vascular pulmonar.
El principal fundamento para la utilización del catéter de SG, es que con él podemos realizar como se comentó anteriormente una evaluación y un mayor control del paciente; no podemos olvidar que generalmente en estos enfermos la edad cronológica no corresponde a la edad fisiológica y se pueden pasar por alto trastornos graves, subvalorarlos y someterlos a riesgos elevados e innecesarios con mortalidad alta (39).
La cirugía del aneurisma es la que requiere la mayor cola-boración entre el equipo quirúrgico y el de soporte (anestesiólogo), en todas las etapas del procedimiento; el paciente generalmente es de edad avanzada con funciones y reservas limitadas de muchos órganos y la técnica quirúrgica impone enormes sobrecargas fisiológicas y hemodinámicas con grandes flujos de líquidos, pinzamiento transversal y retiro de la pinza, hemorragia y deterioro renal.
Las técnicas de inducción anestésica varían según los protocolos de las diferentes instituciones y de acuerdo con las enfermedades intercurrentes; pero la meta principal es garantizar una adecuada estabilidad hemodinámica. Se recomienda una óptima hidratación la noche anterior, y una buena premedicación; acerca de la sedación existen controversias sobre todo en pacientes mayores en los cuales es mejor no administrar benzodiacepinas ni morfina intra-muscular, aunque sería correcto utilizar una dosis intravenosa de 0.5 a 1mg de midazolan cuando el paciente ha llegado a la sala de cirugía, sobre todo si va a ser sometido a los diferentes procedimientos de monitoría (sonda vesical, canulación arterial, etc.). Para la inducción generalmente se utilzan opiodes (sufentanil 10 a 15 mg/kg) y benzodiacepinas (midazolam 0.1 a 0.5 mg/kg), relajantes no despola-rizantes (vecuronio, 0.1 a 0.2 mg/kg), clonidina oral (0.2 a 0.6 mg) y/o atenolol (50 a 100 mg) para atenuar la respuesta a la laringoscopia, todo esto en conjunto con técnicas regionales (epidural con catéter) para aprovechar las ventajas de ambas técnicas. Deben hacerse mediciones basales hemodinámicas antes de la inducción y después de la intubación. Debe evitarse la hipotermia desde el principio mediante el calentamiento de los líquidos, colocar un sistema de humidificación de gases y calefacción de aire. El acceso quirúrgico influye sobre lo anterior: los dos conocidos son el transperitoneal con el paciente en posición supino y el retroperitoneal con el paciente en decúbito lateral (acceso de piano). En todos los pacientes que se operaron se utilizó el acceso transperitoneal sin complicaciones dependien-tes de ello, aunque está reportado que el transperitoneal provoca cambios en la presión arterial de oxígeno (PaO2) disminuyéndola, y en la relación de volumen de espacio muerto y volumen respiratorio total (Vd/Vt) aumentándolo debido a la tracción mesénterica (42). Los hipertensos son más propensos a mostrar intensificación de reacciones hemodinámicas, aumento o disminución de la tensión arterial. La manipulación y tracción del mesenterio provoca aumento y disminución de la presión arterial acompañados de hiperemia en la cara y el cuello; esta reacción se asocia de 33-54% de incremento del gasto cardíaco y de 41-53% de disminución de la resistencia vascular sistémica, efectos atribuidos a la liberación de prostaciclina, que no aparecen en el acceso retroperitoneal (43, 44). En todos nuestros pacientes se utilizó el acceso transperitoneal, con el cual estamos familiarizados en nuestro centro; los cambios descritos no fueron significativos y de ellos no se derivaron complicaciones .
El control de la volemia en el pre-pinzado se dirige a mantener el hematocrito por encima de 28%, y por encima de 30% en pacientes con más de tres criterios de Eagle; presiones de llenado de 2 a 3 mmHg por encima de la presión en cuña inicial y gasto urinario adecuados (1 mL/kg./hr). Una vez obtenidos, se puede colocar manitol, 0.5 gr./kg, 1 a 2 minutos antes del pinzado. Existe controversia con el uso del manitol: mientras algunos opinan que es innecesario si se conservan los volúmenes intravascular y extracelular, el gasto cardíaco y las presiones de riego renal (45), otros opinan que este último es apenas suficiente durante el pinzado y aun con una hemodinámica sistémica adecuada, se justifica su administración (46). Si la oliguria se presenta y persiste después de excluir causas mecánicas y de optimizar las presiones de llenado y gasto cardíaco, se recomienda agregar dopamina a dosis de 3-5 mcg/kg/min y como último recurso se deben utilizar los diuréticos, sobre todo si existía trata-miento previo con ellos. En nuestra experiencia se ha utilizado muy poco el manitol, generalmente se emplea la dopamina a las dosis ya anotadas.
La magnitud de las alteraciones hemodinámicas dependerá del nivel al que se realice el pinzamiento transversal, la duración del mismo, la rapidez del cirujano y la reserva cardiovascular del paciente para tolerar los cambios producidos.
Inicialmente, o sea antes del pinzamiento, la estabilidad cardiovascular está dirigida a conservar temperatura, diuresis y equilibrio hemodinámico y ventilatorio. La oclusión aórtica provoca un rápido aumento de la poscarga con activación de sistemas neuroendocrinos proximales y distales al pinzamiento: así mismo, el retiro del clamp reanuda el metabolismo anaeróbico y “recoge” los productos de la anaerobiosis con todos sus efectos hemodinámicos.
Pinzamiento Transversal (cross-clamping)
Clark y Stanley(47), describieron los cambios hemodinámicos que ocurren al pinzar la aorta (Tabla 3) así como los eventos neuro-humorales que incluyen: descarga simpática, estimulación del eje renina angiotensina aldosterona, los cuales pueden inhibirse con bloqueadores de canales de calcio, inhibirse con bloqueadores de canales de calcio, inhibidores de la enzima convertidora de angiotensina (IECA), ASA, aminofilina, anestesia epidural, anestésicos volátiles, nitroprusiato (NPS), nitroglicerina (NTG), etc.
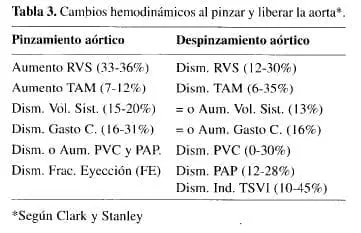
Deben prepararse soluciones de vasodilatadores entre los que se prefiere la nitroglicerina (NTG) por sus efectos satisfactorios sobre el aporte y demanda de oxígeno; se recomienda administrar a razón de 0.25 mcg/kg/min, unos minutos antes del pinzamiento transversal y aumentar las concentraciones de halogenados a fin de prepararse para los eventos hemodinámicos que son: aumento de la tensión arterial media (TAM) en 7-12%; resistencia vascular sistémica (RVS) en 33-36%, la frecuencia cardíaca no cambia y las presiones de llenado que son la presión en la arteria pulmonar (PAP) y la presión venosa central (PVC), pueden disminuir o aumentar, como también el índice de trabajo sistólico del ventrículo izquierdo (ITSVI); el gasto cardíaco (GC) disminuye de 16-31%, y disminuye también la fracción de eyección (FE), comprobada por disminución del volumen sistólico en 15-20% (27,30,31,44,47) (Tabla 3). Todos estos cambios obedecen a menor precarga y menor retorno venoso que se origina con la exclusión de una porción importante del lecho vacsular periférico y de cambios en la función cardíaca. Los factores que modifican tales cambios incluyen, estado previo del árbol cardiovascular, patología aórtica, nivel del pinzamiento y tipo de anestesia.
Diferentes autores (48, 49) han revisado los efectos sobre la función cardíaca, y han observado aumentos en la PCP, dismunución del gasto cardíaco y, en ocasiones, isquemia con cambios en el segmento ST y disminución del gasto cardíaco con disritmias en pacientes con arteriopatía coronaria. Estos cambios pueden ser detectados con el catéter SG y ECG; para llevar al mínimo tales cambios se han utilizado drogas ocmo aminofilina, aspirina, anestésicos volátiles y nitroprusiato sódico, pero s eprefiere la nitroglicerina por sus efectos satisfactorios en el aporte y la demanda de oxígeno del miocardio en la isquemia.
El pinzamiento también produce cambios en el riego y función renal y en otras funcionaes metabólicas. El flujo sanguíneo renal y la rata de filtración glomerular disminuyen en aproximadamente 30% aun con pinzamiento infrarrenal debido al aumento de la resistencia vascular renal; si el pinzamiento es suprarrenal o supracelíaco puede disminuirse hasta en un 50%. También es posible que se presente isquemia medular por compromiso de la arteria radicularis magna (arteria de Adamkiewicz), la cual se origina más frecuentemente a la izquierda de una arteria intercostal inferior o de una arteria lumbar superior (T6 a L1), habitualmente proporciona la principal irrigación de los dos tercios inferiores de la médula espinal (50); por lo tanto la isquemia depende de la altura del pinzamiento (superior a T10), duración y colateralidad del riego medular, protección del gasto cardíaco y de la volemia; la incidencia de esta complicaicón no es alta, se encuentra alrededor de 0.4 a 1%, pero debe sospecharse si el paciente refiere paraparesia o paraplejía en el postoperatorio; ninguno de nuestros pacientes presentó esta complicación.
Supresión del Pinzamiento
Al retirar la pinza aórtica, también se producen cambios (Tabla 3)(47), entre los cuales el más dramático es la hipotensión, con colapso cardiovascular e incluso la muerte. Estos eventos se ven potenciados por el reingreso a la circulación de los rpoductos del metabolismo anaeróbico (lactato y piruvato) que pueden causar depresión miocárdica.
La RVS disminuye 12-30%, el gasto cardíaco (GC) no cambia o aumenta hasta 16%, la presión arterial media (TAM) disminuye 6-35%, la frecuencia cardíaca suele aumentar, el volumen sistólico llega sólo a 13% de aumento, la PVC disminuye de 0-30%, la PCP se reduce de 12-28% y el índice de trabajo sistólico del ventrículo izquierdo disminuye entre 10-45%(47); tales cambios (Tabla 3), se deben a la vasodilatación del lecho que había estado isquémico con robo interno, pero se pueden agravar si durante el pinzamiento se deteriora la función del corazón. Para evitar al máximo estos cambios bruscos, es de suma importancia la comunicación entre el equipo que opera y el equipo de anestesiología. Si la hipotensión es importante puede ocasionar isquemia del miocardio, riñones y cerebro; esta hipotensión se puede reducir al mínimo con una saturación volumétrica durante toda la técnica y sobre todo antes de dicho retiro, dar una carga de líquidos endovenosos (cristaloides y coloides) para mantener la PCP entre 16 y 20 mmHg; así las presiones de llenado aumentan 3 a 4 Torr, se disminuyen los halogenados, los vasodilatadores, se puede colocar una segunda dosis de manitol de 12.5g, y se preparan vasopresores de tipo periférico (fenilefrina o norepinefrina); si con todo esto la hipotensión es brusca, se le pide al cirujano que vuelva a pinzar nuevamente la aorta mientras el paciente se recupera, para posteriormente realizar liberación progresiva del clamp. Se administra bicarbonato si se espera o presenta una acidosis profunda; en algunas ocasiones hay un incremento transitorio de la PCP al retirar la pinza. Si el paciente tiene una vulvopatía dependiente de la precarga (estenosis aórtica o mitral), la hipotensión brusca con caída súbita de la poscarga originaría un caos hemodinámico con disfunción del ventrículo izquierdo, isquemia, hipotensión severa, que es muy difícil de controlar(51).
En cuanto al tratamiento con líquidos, los aspectos decisivos son el volumen y el tipo de solución (cristaloide o coloide) y el valor del hematocrito óptimo. Utilizando la hemodilución normovolémica se pueden reducir las necesidades de transfusión entre 15 y 40%, lo que representa un ahorro de sangre, reduciendo la cantidad de hematíes perdidos en la hemorragia quirúrgica. Está demostrado que al pérdida de 1 litro de sangre con hematocrito (Hcto) de 45, reprseenta una pérdida de 450 mL de glóbulos rojos; también se sabe que el transporte de oxígeno llega a su máximo, cuando el hematocrito de 25% a los pacientes sanos, y de 30-35% en pacientes mayores con arteriopatía coronaria. La reposición sanguínea sólo debe iniciarse cuando se tiene un total control del sangrado, o sea, al terminar de colocar la prótesis y verificar que no haya fugas en la sutura.
La pérdida hemática se reemplaza con soluciones de cristaloides o coloides(55). La fluidoterapia la dividimos en cuatro componentes: reposición del déficit preanestésico, mantenimiento basal (15 mL/kg/h), reposición de sangre perdida y reposición de als pérdidas del tercer espacio.
La técnica anestésica mejor tolerada es la combianción de la general inhalatoria con la anestesia regional conductiva; esta última de reciente introducción, ha disminuido la morbilidad por trombosis venosa o del injerto, mejorando la función pulmonar, permitiendo una extubación temprana sin riesgo de depresión causada por altas dosis de narcóticos i.v. La combianción d ela sdos técnicas es la preferida en nuestro Hospital; la regional conductiva con catéter ha demostrado ventajas imporatntes, las cuales fueron descritas por Lunn(56); menos requerimiento de líquidos endovenosos transoperatorios y disminución de la scifras tensionales posteriores al pinzmaineto. Alguynos opositores del bloqueo regional aducen simpatectomía farmacológica e inestabilidad hemodinámica, para lo cual puede permitirse un nivel de bloqueo más bajo, usar concentraciones menores de anestésicos locales y colocar narcóticos epidurales. La segunda preocupación en cuanto a los catéteres epidurales, es la posibilidad de hemorragia debido a la anticoagulación, siendo ésta supremamente baja. Rao y Odoom(57,58), estudiaron un total de 4.000 pacientes sometidos a anticoagualción en cirugía de AAA; en ningún caso hubo hematoma y sólo en 4 pacientes se suspendió la cirugía, al aspirar sangre por el catéter durante su colocación; en ninguno de nuestros pacientes se presentó esta complicaicón. En nuestro centro utilizamos entre 2.500 a 5.000 unidades de heparina, inmediatamente antes del pinzamiento, y nunca se han tenido que revertir sus efectos con protamina.
Al término de la cirugía, el equipo de anestesia se compara al piloto que va a aterrizar su nave, disminuyendo los gases y vigilando el equilibrio hemodinámico, para lo cual es muy útil la monitoría con presiones de llenado. Entre los factores para tener ne cuenta están, hematocrito, equilibrio ácido-básico, diuresis, electrolitos, temperatura, oxigenación y analgesia, la cual puede mantenerse efectivamente con la misma infusión de Fentanyl de transoperatorio a una velocidad de 0.5 a 1.5 mcg/kg/hr, lo que permite sedación y analgesia sin riesgo de depresión respiratoria hasta en 76%(59). Al ir suprimiendo la anestesia general, el paciente queda con la peridural (catéter); esto permite una extubación temprana (ésta debe realizarse en el quirófano), temperatura central de 35°C, presiones de llenado adecuadas, snagrado controlado, sin evidencia de relajación muscular residual, CO2 teleespirado menor de 50 Torr con ventilación espontánea, control adecuado de tensión arterial, frecuencia cardíaca y dolor controlado, se traslada y vigila extubado en la unidad de cuidado intensivo si no es así, entonces pasa a asistencia ventilatoria mecánica según se requiera. En nuestra experiencia, a nivel del mar, el paciente que no se logra extubar en recuperación y necesita soporte ventilatorio posquirúrgico, hay que descartarle una complicación del tipo falla cardiorrespiratoria, embolia, etc., y tiene un mal pronóstico.
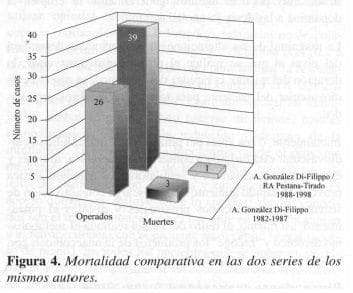
Al comparar esta serie con una realizada en 1982-1987(9) (Figura 4), se comprueba disminución de la mortalidad de manera notable de 11.5 (3 casos) a 2.1% (1 caso), y esta última se debió a causas ajuenas a la cirugía, tal como se comentó anteriormente, epro se incluye por estar dentro de los primeros 30 días de la cirugía.
Se ha discutido mucho la utilización del catéter de SG; algunos han llegado a decir que no sólo no mejora el rponóstico, sino que aumenta la mortalidad y morbilidad(60,61) e incrementa considerablemente los costos; también existen trabajos en los cuales no se han utilizaod el catéter y los resultados han sido favorables(62, 63); igualmente existen publicaciones en las que se describen los claros beneficios de su utilización(64). Los autores estamos convencidos de las bondades del catéter de SG, el cual nos permite tener un estricto control de la hemodinámica del paciente de alto riesgo sobre todo en etse tipo de cirugía, y consideramos que las ventajas de su utilización dividieron la cirugía de alto riesgo, en antes y después de él; comparamos lo anterior con el lecho de volar en avión antes y después del radar. En nuestro centro, forzados por la falta de recursos técnicos y económicos, se ha aprendido a reutilizar algunas partes del catéter, con lo cual se ha disminuido en algo sus costos.
Los resultados actuales osn tal vez debidos a una mayor experiencia en este tipo de cirugía, tanto por parte del equipo quirúrgico, como del soporte hemodinámico (anestesiologos, intensivistas, etc) en el trans y posquirúrgico, lo que nos permite asegurar que el éxito depende del equipo multidisciplinario que esté en constante comunicación y realizando revisiones periódicas en constante comunicación y realizando revisiones periódicas de la experiencia adquirida para así llegar a recomendar pautas de conducta y manejo.
Agradecimientos
Los autores agradecen especialmente a los doctores Juan C. Hoyos Valdelamar y José Salcedo, Residnetes de Cirugía General, por su invaluable colaboración en la revisión de expedientes clínicos; al doctor David Scott Jervis Jalabe, por su invaluable ayuda en la búsqueda y revisión bibliográfica, así como por su acertado manejo de la estadística.
Abstract
The Appropiate treatment of adominal aortic aneurysm, it is guide to teh resection and protesis placement, surgery that at the moment is rulet and standarized, being simple and direct, reaching minimum rates of morbimortality in most of the centers.
The part that it has more pressed in this surgery, it is the diagnosis, physiopathology and hemodynamic handling during the pre, trans and postoperative. In this work the experience is presented with this surgery type, in the Hospital University of Cartagena, during the period understood between March of 1988 and February of 1998. 39 patients were operated, 31 (76.6%) men and 8 (23.4%) women, the ages oscillated between 52 and 79 years with a 65.3 year-old average and a standard derivation of 7.8. the reason of more frequent consultation was the abdominal pain, followed by sensation of abdominal mass. The diagnoses method definitive more frequent is was the abdominal ultrasound in 55.3%, followed by the abdominal computed tomography in 44.7%. it was used Swan-Ganz catheter in 32 (84%) and the pathologies asspcoated with their use were the cardiac pathology in 15 (38.5%) and arterial hypertension in 11 (28.2). in 31 (66%) implant was usedin pant and in 8 to a patient (2.1). she is carried out an extensive revision of the pathology, making emphasis in the aspects etiologic, diagnoses, phisiopathology, hemodynamic handling, and control during the pre, trans and posoperative based on the experience accumulated with this surgery type in our hospital.
Referencias
1. Ruiz Grande F: Aspectos históricos de la cirugía de los aneurismas. El legado de Antyllus. Patol Vasc 1997; 3 (2): 77-87
2. Lain- Entralgo P: Historia de la medicina. Salvat, Barcelona 1976
3. Slaney G: A history of aneurysm. In: The cause and management of aneurysm. Philadelphia: Saunder; 1990.
4. Oviedo L I, Ariza G J, Pestana-Tirado R A: La ayudantía quirúrgica. Un arte olvidado en las escuelas de medicina. Rev Colomb Cir 1997; 12 (1): 47-50
5. Candaluce M: Astley Paston Cooper. Pionero en cirugía aórtica. Patol Vasc 1997; 2 (1): 79-84
6. Abaúnza H: Evolución de la cirugía de algunos órganos desde sus pioneros hasta los cirujanos actuales. Rev Colomb Cir 1996; 11(1): 66-74
7. Ruiz Grande F: Aspectos históricos de la cirugía del aneurisma de la aorta abdominal. Matas y las nuevas técnicas. Patol Vasc 1997; 3 (3): 75-87
8. Abaúnza H: Aneurisma de la aorta abdominal. Rev Colomb Cir 1986; 1(3): 133
9. González Di-Filippo A: Aneurisma de la aorta abdominal. Rev Colomb Cir 1989; 4 (1): 9-16
10. Dobrin P B: Fisiopatología y patogenia de los aneurismas aórticos. Clín Quir Norte Am 1989; 4: 747-65
11. Tilson M D: Histochemistry of aortic elastin in patients with nonspecific abdominal aortic aneurysmal disease. Arch Surg 1988; 123: 503-5
12. Silverber E, Lubera J: Cancer statistics 1983. New York, American Cancer Society, 1983
13. Reilly J M, Tilson M D: Incidencia y origen de los aneurismas de aorta abdominal. Clín Quir Norte Am 1989; 4: 767-74
14. Norrgard O, Rais O, Angquist K-A: Familial ocurrence of abdominal aortic aneurysms. Surgery 1984; 95: 650-6
15. Tilson M D, Seashore M R: Fifty families with abdominal aortic aneurysms in two or more first-order relatives. Am J Surg 1984; 147: 551-3
16. Tilson MD: Decreased hepatic copper levels: A posible chemical marker aneurysms in man. Arch Surg 1982: 1212-3
17. Tilson M, Seoshore M: Human genetics of the abdominal aortic aneurysms. Surg Gynecol Obstet 1984; 159: 129-32
18. Cole C, Barber G, Bouchard A, et al: Abdominal aortic aneurysms: the consequences of a positive family history. Can J Surg 1989; 32: 117-20
19. Powell J, Greenhalgh R: Multifactorial inheritance of abdominal aortic aneurysms. Eur J Vas Surg 1987; 1: 29-31
20. Graor R A: Voloración preoperatoria y tratamiento de la arteriopatía oclusiva de coronarias y carótida en sujetos con aneurisma de la aorta abdominal. Clín Quir Norte Am 1989; 4: 803-810
21. Goldman L, Caldera D L, Nussbaum S R: Multifactorial index of cardiac risk in non-cardiac surgical procedures. N Engl J Med 1997; 297: 845-50
22. Michelsen L G: Evaluación del paciente con enfermedad coronaria. Rev Colomb Anest 1997; 25: 199
23. Eagle K, Brundage B, Chaitman B, et al: Guidelines for perioperative cardiovascular avaluation of non-cardiac surgery: A report of the American Heart Association/ American College of Cardiology Task Force on assessment of diagnostic and
therapeutic cardiovascular procedures. Circulation 1996; 93: 1278
24. Foss J F, Ellis J E: Preoperative considerations in the vascular surgery patient. Internet.
25. Roizen M, Ellis J E: Anesthesia for vascular surgery. In: Barash P G, Cullen B F, Stoelting R K; Philadelphia: J B Lippincott Company; 1992. p. 1060-1
26. Hartman G S, Bruefach M: Anestesia para reconstrucción de la aorta abdominal. Clin Anest North Am 1997; 1: 145-8
27. Clark N J, Stanley T H: Anesthesia for vascular surgery. In: Miller R D, editor. Anesthesia. New York: Churchill Livings-tone; 1990. p. 1693-736
28. Roeder G O, Langlois Y E, Luisani L, et al: Natural history of carotid artery disease of the side contralateral to endarterectomy. J Vasc Surg 1984; 1: 62-72
29. Hertzer N R, Beven E G, Young J R, et al: Coronary artery disease in peripheral vascular patients: A classification of 1.000 coronary angiograms and results of surgical management. Am Surg 1984; 199: 223
30. Stoelting R K, Dierdorf S F: Aneurysms of thoracic and abdominal aorta. In: Anes-thesia and Co-exisiting disease. New York: Churchill Livingstone; 1991. p. 117-8
31. Fernández B J: Anestesia en cirugía cardiovascular. En: Luna P: Anestesia Cardio-
vascular. México D.F: Mc Graww-Hill; 1997. p. 219-22
32. Villalba J, Lopeire E, Espinosa, et al: Aneurisma de la aorta abdominal. Rev Colomb Anest 1997; 25: 229
33. Pasternak P F, Grosi E A, Baumann F G, et al: The value of silent myocardial isquemia monitoring in the prediction of perioperative myocardial infarction in patients undergoing peripheral vascular surgery. J Vasc Surg 1989; 10: 617
34. Ellis J E, Roizen M F, et al: Anesthesia for vascular surgery. In: Barash P G, Cullen B F, Stoelting R K: Clinical Anesthesia. Philadelphia: Lippincott-Raven Publi-shers; 1996. p . 876-8
35. Pairolero P L: Reparación de aneurismas de la aorta abdominal en pacientes de alto riesgo. Clín Quir Norte Am 1984; 4: 821-30
36. Boysen P G: Evaluation of pulmonary risk. In: Barash P G: ASA Refresher courses in Anesthesiology. Philadelphia Lippincott-Raven Publishers; 1989 (Vol 17.) p. 17-25
37. Diehl J T, Cali R F, Hertzer N R, et al: Complications of abdominal aortic reconstruction. Ann Surg 1983; 197: 49-56
38. Moskovitz D M, Reich D L: Vigilancia hemodinámica. Clín Anest Norte Am 1997; 1: 30-31
39. Villavicencio R, García E, Cuervo H, Jaramillo J: El catéter de Swan-Ganz. Trib Méd 1993; 87(4): 148-62
40. Brown O W, Hollier L H, Pairolero P C, Kazmier F J, McCready R A: Abdominal aortic aneurysm and coronary artery disease. Arch Surg 1981; 116: 1484
41. Karmony A M, Leather R P, Goldman M, et al: The current position of nonresective treatment for abdominal aortic aneurysm. Surgery 1983; 94: 591
42. Abe E, Shibutani K: Respiratory effects of upper abdominal retraction in major abdominal aortic surgery. Anesth Analg 1997; 84: 80
43. Hudson J C, Wurn W H, O’Donnell T F, et al: Hemodynamics and prostacyclin release in the early phases of aortic surgery: Comparison of transabdominal and retro-peritoneal approach a abdominal. Clín Quir Norte Am 1989; 4: 843-64
45. Alpert R A, Roizen M F, Hamilton W K, et al: Intraoperative urinary output does not predict postoperative renal function in patients undergoing abdominal aortic revascularization. Surgery 1984; 95: 707-11.
46. Kron I L, Joob A W, Van Meter C: Acute renal failure in the cardiovascular surgical patient. Ann Thorac Surg 1985; 39: 570-98
47. Clark N J, Stanley T H: Anesthesia for vascular surgery. In: Miller R D. Anesthesia 2 ed. New York: Churchill Livingstone; 1986. p. 1519-62
48. Bunt T, Manczuk M, Varley K: Nitrogly-cerine-induced volume loading. Surgery 1988; 103: 513-9
49. Gooding J M, Archie J P, McDowell H: Hemodynamic response to infrarenal aortic cross-clamping in patients with and without coronary artery disease. Crit Care Med 1980; 8: 382-5
50. Moore K L: Anatomía Orientación Clínica. Edit Méd Panam S.A., 1982, Buenos Aires.
51. Hartmann G S: Management of patients with valvular heart disease. International. Anesthesia Research Society Refresher Course Lectures 1994. P .141
52. Sunder-Plasma L, et al: The physiological significance of acutely induced hemodilution. Proc 5th Eur Conf. Microcirculation, Aalborg 1970. Baser Karger 1971; 23-8
53. Messmer K: Hemodilution. Surg Clin North Am 1975; 55(3): 659-78
54. Messmer K, Kreimer V, Intaglietta M: Present state of intentional hemodilution. Europ Surg Res 1986; 18: 254-63
55. Cronin K D: Expansores del volumen plasmático. Develop Biol Standard, St. Vincent’s Hospital, Victoria Parade, Fitzroy, Vol 67. p. 113-8
56. Lunn J K, Dannemiller F J, Stanley T H: Cardiovascular responses to clamping of the aorta during epidural and general anesthesia. Anest Analg 1979; 58: 372-6
57. Rao T L, et al: Anticoagulation following placement of epidural and subarachnoid catheters. Anestesiology 1981; 55: 618-20
58. Odoom J A, Sih I L: Epidural analgesia and anticoagulation therapy. Anesthesia 1983; 38: 254-259
59. Shibatami K, Abe E, Frost A M: The optimal plasma Fentanyl levels for extubation and postoperative analgesia following abdominal aortic aneurysmectomy. Anest Analg 1997; 84: 81
60. Robin E D: Death of the pulmonary artery flow-directed catherization, time for o moratorium?. Chest 1987; 92: 721
61. Hudson-Civetta J M, Martínez O V, Hoffman T A: Risk and detection of pulmonary artery catheter related infection to septic surgical patients. Crit Care Med 1987; 15: 29
62. Tuman K J, McCarthy R J, Ivankovich A D: Does pulmonary artery catheterization improve outcome in high risk cardiac surgical patients?. Anesth Analg 1988; 67: 237
63. Dawkins K D, Jamieson S W, Hunt S A, et al: Long-term results, hemodynamics and complications after combined heart and lung transplantation. Circulation 1985; 71: 919
Shoemaker W C, Appel P L, Kram H B: Tissue oxigen debit as a determinant of lethal and nonlethal postoperative organ failure. Crit Care Med 1988; 16: 11-7.
Correspondencia:
Doctor Aquiles González di Filippo. Sección de Cirugía General, E.S.E., Hospital Universitario de Cartagena, Cartagena de Indias.
Requisito para los Autores de Trabajos Enviados con Destino a la Publicación en CIRUGÍA
Se exige a los médicos que deseen colaborar en esta Revista con trabajos originales, se sirvan leer detenidamente la sección “Indicaciones a los Autores” que aparece publicada en cada una de las entregas de la misma, a fin de que aquellos se ajusten en un todo a lo que en ellas se establece.
Se hace especial hincapié sobre el último párrafo del numeral 5 que a la letra dice: “Dentro de las referencias bibliográficas anotadas, deberán incluirse algunas de la literatura médica de autores colombianos”.
Señor autor: La Revista CIRUGIA en sus 13 años de vida, como tantas otras revistas colombianas, ha publicado trabajos nacionales sobre casi todos los temas médico-quirúrgicos, cuyos autores colombianos merecen la consideración, el acatamiento, la referencia y el estímulo que usted también desea y merece para sus publicaciones.
Para su conocimiento, la Oficina de Recursos Educacionales de FEPAFEMIPAFAMS, está prestando un eficiente servicio de información bibliográfica nacional y latinoamericana a quienes la soliciten.
