Informe de 1 Caso y Revisión de la Literatura
A. GONZALEZ, MD, scc; A. PALMIERI, MD.
Palabras claves: Fístula arteriovenosa pulmonar, Malfonnación arteriovenosa pulmonar, Hemangioma pulmonar, Derivación (shunt) arteriovenosa, Gamagrafía de perfusión, CT-Scan pulmonar.
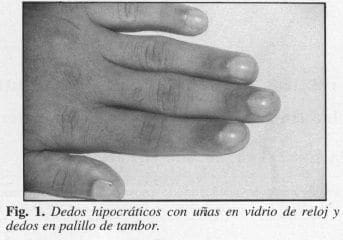
Se diagnosticó y se trató el caso de un paciente proveniente del área rural, de sexo masculino con 19 años de edad, que consultó por cianosis y disnea de 14 años de evolución, y quien en los primeros años de vida había sido asintomático; 3 meses antes de su ingreso se hizo sintomático con disnea de moderados esfuerzos, que lo imposibilitó para las labores escolares y agrícolas; presentó acrocianosis permanente, dedos en “palillo de tambor” de manos y pies y poliglobulia.
Se descartó cardiopatía congénita, neumopatía, hemoglobinopatía y policitemia vera mediante los respectivos estudios. En la radiografía del tórax al ingreso mostró una imagen que hizo sospechar la presencia de una fístula arteriovenosa pulmonar congénita. Se confirmó el diagnóstico por gamagrafía de perfusión pulmonar y por tomografía axial computadorizada, que demostraron su alta sensibilidad y espec(ficidad en esta patología. La hematimetría mostró: Hb, 19 gr% y Hto, 66%. La derivación (shunt) arteriovenosa calculada fue del 51.2%; además, hipoxemia marcada sin retención de C02 (P02: 43.9 mmHg; C02: 25 mmHg; pH: 7.26), sin repercusión hemodinámica pulmonar.
Se realizó una lobectomía pulmonar inferior izquierda la cual mostró grandes sacos fistulosos subpleurales. El paciente se restableció completamente y los controles gamagráficos mostraron erradicación completa de la fístula; Hb de 13 gr%, Hto de 42% y derivación arteriovenosa de 6%.
Introducción
La malformación arteriovenosa pulmonar se define como una comunicación anormal entre las arterias y venas pulmonares ya sea en el nivel proximal o distal eludiendo el territorio alveolocapilar, la cual trae como consecuencia una desviación del flujo sanguíneo de derecha a izquierda con hipoxemia y policitemia secundaria. Se ha identificado bajo los nombres de aneurisma arteriovenoso pulmonar, hemangioma cavernoso, telangiectasia pulmonar y fístula arteriovenosa (AV) pulmonar, ténnino con el que más a menudo es reportada. Es una entidad poco común pero con 457 casos descritos en la literatura mundial y 14 en Latinoamérica (1-3).
La gran mayoría de las fístulas AV pulmonares son congénitas y en ocasiones adquiridas por traumas, infecciones (actinomicosis o esquistosomiasis), metástasis pulmonares o cirrosis hepática avanzada. Se asocian en el 60% de los casos a la telangiectasia hemorrágica hereditaria (enfermedad de Rendu-Osler-Weber) y casi siempre a múltiples fístulas AV pulmonares microscópicas (1, 3, 4).
La intención de esta publicación es dar a conocer el primer caso de fístula arteriovenosa pulmonar congénita informado en Colombia, diagnosticado e intervenido en el Hospital Universitario de Cartagena. Se realiza una revisión de los aspectos clínicos, diagnósticos y terapéuticos.
Material y Métodos
Caso Clínico
Paciente de 19 años, sexo masculino, procedente del área rural, quien consultó por cianosis y disnea.
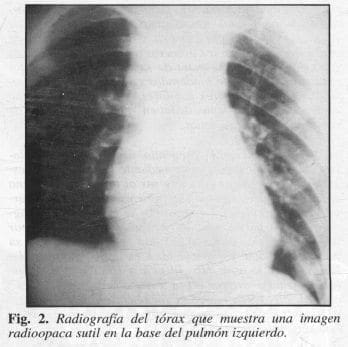
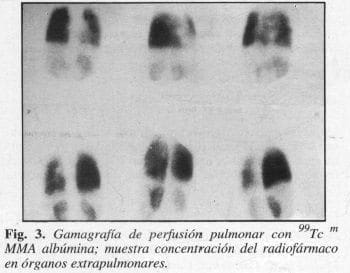
Informó que su enfennedad se inició en la infancia (5 años de edad), con cianosis ungueal leve, por lo que fue revisado por médicos en varias oportunidades, quienes no encontraron alteración cardíaca a la auscultación, motivo por el cual la madre del enfenno se despreocupó; 10 años más tarde notó cambios en la forma de los dedos y uñas de las manos y pies, con aumento de la cianosis ungueal sin ninguna otra manifestación; nuevamente recurrió a médicos que lo remitieron con impresión diagnóstica clínica de cardiopatía congénita, la cual no pudo demostrarse. Hace 3 meses se asoció a disnea de grandes a medianos esfuerzos, que lo incapacitaron para sus labores cotidianas; presentó, además, acrocianosis pennanente que se intensificaba con el ejercicio, astenia y adinamia. No había antecedentes personales ni familiares de enfennedades he reditarias ni hemoglobinopatías, cardiopatías o policitemia vera. Consultaron entonces a este centro donde, como datos positivos, se observó: paciente con TA: 110170 mmHg, FC: 100/min, FR: 20/min en reposo, peso: 46 kg (bajo de peso), talla: 167 cm, longilíneo, facies rubicunda, mucosas hidratadas sin lesiones, acrocianosis, dedos de manos y pies en palillo de tambor, uñas en vidrio”de reloj (Fig. 1); a la auscultación del tórax no se percibieron soplos cardíacos, corazón con ruidos rítmicos bien timbrados; pulmones con buena expansibilidad, murmullo vesicular presente en todos los campos pulmonares; no se auscultaron ruidos sobreagregados. Abdomen plano depresible sin masas ni visceromegalias a la palpación. Se hospitalizó y se realizaron los siguientes estudios: Hb: 19 gr%. Hto: 66%; en los Rx de tórax inicialmente se informó que la silueta cardíaca era normal; la sutileza de una imagen radiopaca en la base pulmonar del lóbulo inferior izquierdo sugirió la realización de otros estudios con la sospecha diagnóstica de fístula arteriovenosa pulmonar (Fig. 2). El ecocardioma no sugirió cardiopatía, la gamagrafía de perfusión pulmonar demostró la presencia del radiofármaco en órganos como el riñón, cerebro y tiroides, que identificaron la presencia de una fístula arteriovenosa pulmonar, como explicaremos más adelante (Fig. 3); la electroforesis de Hb fue normal; E.S.P. con eritrocitos normales; los gases arteriales (paciente con Oz del medio ambiente) informaron pH: 7.26, pOz : 43.9, pCOz : 25 mmHg, HC03 : 16.1, BE : -5.6; erspirometría con alteración ventilatoria mixta de grado severo en ambos patrones, reversibilidad leve con broncodilatadores inhalados.
 |
 |
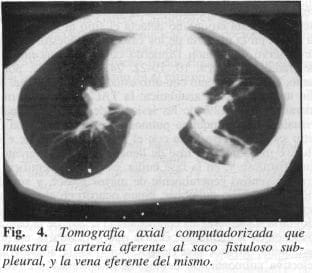
Se instaló catéter de Swanz Ganz vía subclavia percutánea hasta el tronco de la arteria pulmonar izquierda con la finalidad de determinar los gases venosos mixtos y hemodinamia pulmonar. Los gases arteriales centrales mostraron pH: 7.4, pCOz: 25 mmHg, pOz: 48.6 mmHg, HC03: 16.1, BE: -5.6, gases venosos mixtos: pH : 7.38, pCOz : 33.7 mrnHg,: pOz: 46.1 mrnHg, RC03: 19.9 mrnHg, BE: -3.6; mediciones hemodinárnicas: GC: 7.22, LC : 4.63, resistencia vascular sistémica: 1085, resistencia vascular pulmonar: 44; derivación AV (Qs/Qt): 51.2%, saturación de Oz: 80%. Se practicó una tomo grafía axial computadorizada (TAC) pulmonar con contraste que demostró la presencia de dos lagos hiperdensos en el lóbulo inferior izquierdo, subpleurales con llenado de la arteria aferente y de la vena eferente, sin encontrar defecto en el resto del parénquima (Fig. 4).
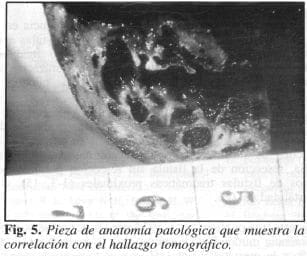
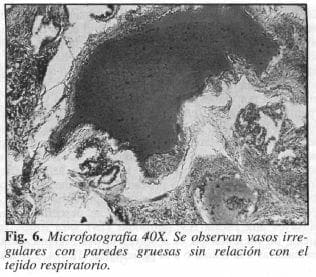
Con estos métodos no invasores se llegó al diagnóstico de FISTULA ARTERlOVENOSA PULMONAR, sin practicar angiografía pulmonar, con base en experiencias en otros países (8, 9). Fue llevado a cirugía donde se realizó toracotomía posterolateral izquierda a través del VI espacio intercostal; se encontraron dos sacos subpleurales que ocupaban casi todo el lóbulo inferior izquierdo; se procedió a practicar lobectomía pulmonar inferior izquierda (Fig. 5); al pinzar la arteria pulmonar inferior izquierda se notó el incremento progresivo en la curva oximétrica en la determinación del pO2. El paciente se mantuvo estable durante el acto operatorio. La evolución postoperatoria fue satisfactoria, se dio de alta al séptimo día con gases arteriales informados así: pH: 7.39, pCOz : 21.4 mrnHg, pO2 : 140 mrnHg, gases venosos mixtos: pH: 7.34, pCOz: 35.5 mmHg, p02: 27 rnrnHg. Derivación (shunt) del 6% y saturación de 02 del 96%. Patología informada: anomalía vascular con paredes engrosadas, recubierta por endotelio sin relación con el tejido respiratorio, compatible con hemangioma cavernoso pulmonar (Fig. 6).
 |
 |
Resultados
En los controles por la consulta externa 2 meses después de la cirugía, el paciente manifestó la desaparición de la disnea, la cianosis y la cefalea y estar reincorporado a sus labores cotidianas. La hemoglobina fue de 13.3% gr, Hto: 42%, Rx de tórax normal, espirometría de- control con mejoría ostensible del patrón respiratorio y la gamagrafía pulmonar no demostró concentración del radiofármaco en los órganos extrapulmonares (riñón, tiroides ni cerebro), lo que confIrmó la erradicación total de la fístula arteriovenosa pulmonar mediante el procedimiento quirúrgico.
Discusión
La primera descripción de una fístula arteriovenosa pulmonar se debe a T. Churton en el año de 1897 al examen posmorten de un niño de 12 años de edad (1-3). Rodes en 1938 y Goldman en 1948 analizan la correlación entre la telangiectasia hemorrágica hereditaria (enfermedad de Rendu-Osler Weber) y la fístula arteriovenosa pulmonar, señalan los aspectos hereditarios, alto grado de penetración y el carácter dominante de la entidad. Es Reading, en 1932, a quien se le atribuye la asociación de la tríada clásica: cianosis, policitemia y dedos en “palillo de tambor” (clubbing) con la fístula arteriovenosa pulmonar, y en 1939 Horton hace el primer diagnóstico in vivo. Shenstone en 1942 realiza la primera resección quirúrgica pulmonar. Gomes y Dines en 1974 proponen las pautas para el tratamiento quirúrgico temprano para evitar de esta manera las complicaciones con el tratamiento conservador; por último, Taylor en 1978 y Terry en 1980, describen las técnicas para el tratamiento con embolización de los casos de fístulas arteriovenosas pulmonares múltiples, residuales, o en hemoptisis masivas por fístulas AV adquiridas (1-3, 16, 17).
Se desconoce su etilogía; según la teoría de Anabtawi y col, en el segundo mes de vida fetal hay una degeneración incompleta del septo del plexo primitivo vascular entre la vena y la arteria pulmonares, con persistencia del lecho capilar esplácnico; forma posteriormente un saco vascular cavernoso o capilar que une el sistema arterial con el venoso sin realizar el intercambio alvéolo-capilar de la sangre venosa. Adquieren diversas formas con uno o varios canales vasculares tapizados por endotelio (1, 3, 4). La derivación o shunt arteriovenoso fisiológico es del 5% debido al drenaje de las venas bronquiales, de Tebesio o mediastinales, a la circulación sistémica sin paso por el lecho.
Se presentan como fístulas arteriovenosas pulmonares únicas en el 64% de los pacientes, múltiples unilaterales en el 14% y bilaterales ‘en el 25 al 42% (1-3).
Es más frecuente encontrarla en los adultos cuando el flujo sanguíneo pulmonar es mayor, con una relación de 1.5: 1 ó 2:1 según la serie, a favor del sexo masculino (1, 3).
La presentación clínica depende del tamaño de la fístula (mayores de 2 cm) y de que la magnitud de la derivación arteriovenosa sea mayor del 25% (1, 4); la gran mayoría son asintomáticas en la infancia; en la edad adulta se hacen sintomáticas cuando el desvío del flujo de la sangre no oxigenada a la circulación sistémica es mayor; se manifiesta por cianosis, policitemia secundaria y dedos en “palillo de tambor” (clubbing), signos que se encuentran con más frecuencia, seguidos por disnea, cefalea y mareos debidos a la hipoxemia crónica en la que viven éstos pacientes, como es nuestro caso clínico (1, 2, 4); sin embargo, hay informes de pacientes totalmente asintomáticos quienes al ser sometidos a procedimientos anestésicos por entidades de otra índole, presentan hipoxemia rebelde al recibir 02 al 100%; posteriormente se descubre que la causa es una fístula AV pulmonar (14); otra forma frecuente de presentación es a través de las complicaciones secundarias a la fístula o a la policitemia (12, 14, 15, 18).
Es muy importante pensar en la patología, sospecharla ya que casi siempre al revisar un paciente con cianosis, cuyo examen físico revela muy pocos datos positivos, se convierte en un gran reto para el diagnóstico, a menos que el paciente tenga cienos rasgos que sugieran una enfermedad hereditaria como la telangiactasia hemorrágica, antecedentes de traumatismos, infecciones pulmonares o enfermedades hepáticas avanzadas como la cirrosis (1-5, 19); algunas veces es posible auscultar un murmullo en el sitio de la lesión, extracardíaco, pero se requiere que sea de gran tamaño (1- 4); en nuestro paciente lo que más llamó la atención fue la cianosis ungueal, fascies rubicunda y los dedos en “palillo de tambor” lo cual nos motivó a su estudiocuidadoso. Se descartó la patología cardíaca y las hemoglobinopatías como causa de la cianosis mediante la ecocardiografía y la electroforesis de Hb, respectivamente, lo mismo que la policiternia vera, ya que en ésta no hay hipoxemia ni cianosis; además, el paciente no tenía leucocitosis ni esplenomegalia. Los gases arteriales mostraron una marcada hipoxemia sin retención de C02; la hemodinamia pulmonar era normal tal como se ha informado con frecuencia (1-5, 14).
La radiografía del tórax muestra una imagen sospechosa en el 98% de los pacientes; generalmente circunscrita, periférica no calcificada, que cambia de forma y tamaño bajo f1uoroscopia con las maniobras de Valsalva, difícil de demostrar en nuestro paciente por la sutileza de la imagen.
Es bien sabido que el estudio estándar para el diagnóstico de la fístula arteriovenosa pulmonar es la arteriografía selectiva, método invasor que se realiza a través de la vena femoral y, como tal, tiene sus riesgos (reacción alérgica al medio de contraste, hematoma en el sitio de la punción, embolia aérea, trombosis arterial) y sus falsos negativos en lesiones menores de I cm (5, 7, 26); a partir de los estudios de Secker-Walker en 1973 se intensifica la búsqueda de métodos no invasores con alta sensibilidad y especificidad como es la gamagrafía de perfusión pulmonar con macroagregados de albúmina (MAA), que muestra concentración del radiofármaco en sitios extrapulmonares (cerebro, riñón y tiroides) permitidos por la fístula al evadir el sitio de filtración; hoy en día es el método de elección no sólo como tamización diagnóstica sino también para cuantificar la derivación AV; pero su desventaja está en que no detecta el sitio ni el tamaño de la lesión en la mayoría de los casos, y en nuestro paciente se observó el pulmón izquierdo con poca concentración del radiofármaco (9, 10, 19-22, 24, 25, 27, 28); por lo tanto, se complementó con otro estudio no invasor que nos dio una orientación anatómica: la TAC (6-8) que permite identificar el 98.2% de las lesiones de cualquier tamaño, visualizar el parénquima pulmonar con identificación del sitio sacular que se llena con el medio de contraste e inclusive muestra en la fase de llenado la arteria aferente al saco fistuloso y, en la fase tardía, es posible identificar el drenaje venoso generalmente de mayor grosor, y su relación con el hilio pulmonar, como ocurrió en el caso presentado. Otro estudio posible de realizar es la ecocardiografía transesofágica contrastada (11, 26), de la cual no disponemos actualmente, con la que se sustituye un procedimiento invasor con riesgos, como es la arteriografía selectiva pulmonar. Se demuestra la correlación entre la CT-scan y la pieza anatomopatológica cuyos hallazgos coinciden en un 100% (Figs. 5 y 6).
Se debe recordar que el incremento de la violencia en el mundo estimula a investigar la presencia de fístulas arteriovenosas pulmonares de origen traumático mediante gamagrafías de perfusión pulmonar, como tamización en pacientes con cianosis, dedos en “palillo de tambor” y policitemia (15).
El tratamiento definitivo es qUlrurgico; dependiendo del tamaño de la lesión y de su localización, se programará la práctica de lobectomías, segmentectomías, resección en cuña, resección de la fístula sin resección pulmonar en casos de fístulas traumáticas proximales (1-3, 15), con mortalidad del 0%.
Los estudios publicados en 1974 por Dines tomados como referencia mundial, demostraron que la morbilidad es del 26% y la mortalidad del 11% con el tratamiento conservador y con un seguimiento por 6 años en promedio, debidas a las complicaciones de la poliglobulia, que causa trombosis del saco fistuloso con embolia sistémica de predominio cerebral, hemotórax o hemoptisis masiva por ruptura espontánea o por el paso de microorganismos desde sitios alejados (dentarios) a órganos distantes, sin pasar por el filtro pulmolnar, con formación de abscesos cerebrales o renales (1-5, 18). Otra forma de tratamiento que ha adquirido auge desde 1978 en centros sofisticados es la embolización de los sacos fistulosos residuales, múltiples o bilaterales, con prótesis de Gianturco- Wallace o con lvalon (polivinil alcohol) por vía percutánea femoral, con obtención de muy buenos resultados (1, 13, 16, 17, 23,25).
La recurrencia de las fístulas es mínima con el tratamiento quirúrgico, a menos que se hallen asociadas con la telangiectasia hemorrágica hereditaria.
Agradecimientos
Agradecemos muy especialmente a los doctores Gustavo Burgos F. y Juan Montes F., neumólogos de nuestro hospital, quienes con su pericia y experiencia nos llevaron al diagnóstico; a los doctores Carmelo Dueñas Castell, neumólogo, Carlos García, Cardiólogo y Jefe de la U.c.I., Aiken Betancourt, médico nuclear, a las doctoras Patricia Vélez y Martha Val del amar, Rll y RIII de Anestesia, respectivamente, y al doctor Pastor Herazo, RlII de Radiología, por su colaboración en el estudio del paciente.
Abstract
The case of a year old lilale patient, coming from a rural area who ‘s chief complaint was of shortness of breath and cyanosis for the past 14 years is presented; during his first years o{ life he had remained asymptoptomatic; 3 months before admission his symptoms got worse making it impossible to continue attending school or carrying out any agricultural chores; he exhibited permanent acrocvanosis, drumstick flngers in hands andjéet and polyglohlia. Other types of congenital heart disease, pneumopathy, hemog!ohinopathy of polycytemia vera were ruled out by the respective studies. In the chest X-Ray on admission, a suspicious image oriented the diagnosis towards a congenital pulmonary AV shunt. The diagnosis was conflrmed by pulm.onary perfusion detecting this type of pathology. Blood studies showed a hemoglobin of 19% and a hematocrit of 66%. The calculated arterio-venous shunt was 51,2%; fur themore, a pronounced hypoxemia was observed without C02 retention (p02 of 43.9 mmHg; C02: 25 mmHg: pH of 7.26); pulmonary hemodynamic compromise was ruled out.
An inferior left pulmonary lobectomy was performed showinfg a great number of sub-pleural fistulous sacs and shunts which were removed. After surgery the patient was fully recovered; posterior scintigraphies evidenced total eradication (Jf the fistulae; posterior blood studies showed a hemoglobin of /3% hematocrit of 42% and an arteriovenous derivation of only 6%.
Referencias
1. Burke C M. Safai C. Nelson D P, Raffin Th: Pulmonary arteriovenous mal formations:
A critical updale. Am Rev Respir Dis 1986; 1.,4; 334-9.
2. Dines D E. Arms R A. Gómez M R: Pulmonary arteriovenous fístulas. Mayo Clin Proc 1974; 49: 460-4.
3. Burford Th. Ferguson Th; Trastornos vasculares congénitos del pulmón. En; Gihbon
Cirugía Torácica. 2 Ed. Barcelona, Edit Salvat. 1980; (1): 667-72.
4. Prager R L, Laws K H, Bender H W: Arteriovenous fistula of the lung. Ann Thorac Surg 1983; 36; 231-7 .
5. De Carli W. Sandoval J, Molina M et al; Fístulas arteriovenosas pulmonares microscópicas. Arch Inst Cardiol Mex 1981; 51 (5); 463-9.
6. Webb R W; Advances in computed tomography of lhe lorax. Radiol Clin North Am 1983; 21 (4); 732-6.
7. White R Jr; Pulmonary Arteriovenous malformations: How do we diagnose lhem and why is il important to do so” Radiology 1992; 182; 633-35.
8. Remy J, Remy-Jardin M et al: Pulmonary Arlerioveous Malformations: Evaluation with CT of the chest before and after lreatment. Radiology 1992; 182: 809-16.
9. Trent C. Tupler R el al: Macrovascular pulmonary arteriovenous malformations demostrated by Radionuclide method. Clin Nucl Med 1993; 18 (3): 231-3.
10. Suga K. Kuramitsu T et al; Scintigraphic analysis of hemodynamics in a patient wilh a single large pulmonary arteriovenous fistula. Clin Nucl Med 1992; 17 (2): 110-3.
11. Belder M A. Tourkis L, Griffith M: Transesophageal contrasl echocardiography and color tlow mapping: Methods of choice for the detection of shunts at the alrial level’) Am Heart J 1992; 124 (6): 1545-50
12. Brigi M, Harbi A, Khalfallah A et al; A rare and little known cause of cyanose: Pulmonary arteriovenous aneurism. Ann Pediatr Paris 1991; 38 (8): 572-5.
13. Pennington D W, Gold W M et al: Treatment of pulmonary arteriovenous malformations by therapeutic embolization. Am Rev Respir Dis 1992; 145 (5): 1047-51.
14. Friedman B, Mc Grath B. Williams J: Pulmonary arteriovenous fistula; Mechanical
ventilation and hypoxemia. Can J Anaesth 1992; 39 (9): 963-5.
15. Stelter W J. Walter P, Wendau K; Successful c10sure of a traumatic pulmonary A.V. fislula of the main pulmonary artery. World J Surg 1982; 6 (4); 484-9.
16. Gómez A. Malli W, Oppenheim W: Embolization therapy in the management of congenital arteriovenous malformations. Radiology 1982; 144 (1); 41-9.
17. Marin J, Lock J E; Catheter embolization of pulmonary arteriovenous fistulas in an
infant. Pediatr Cardiol 1992; 13 (1): 41-3.
18. Moma F, Ohara S et al; Brian abscess associated with congenital pulmonary arteriovenous fistula. Surg Neurol 1990; 34 (6): 439-41
19. Jeffry G P, Prince R L, Vander A; Fatal intrapulmonary arteriovenous shunting in
cirrhosis. Diagnosis by radionuclide lung perfusion scan. Med J Aust 1990; 152 ( 10); 549- 52.
20. Secker-Walker R, Siegel B A; The use of nuclear medicine in the diagnosis of lung
disease. Radiol Clin North Am 1973; II (1); 215-37.
21. Suzuki Y: Quantitation of rigt to left shunt ratio in patients with pulmonary telangieclasia by lechnetium-99m MAA lung perfusion imaging. Clin Nucl Med 1986; II (2); 84-7.
22. Villanueva-Meyer J, Marcus C, Thompson K et al; Diagnosis and quantitation 01′ pulmonary arteriovenous malformations by factor analisis. Clin Nucl Med 1986; 1I (2): 88-91.
23. Chilvers E R, Whyte M, Jackson J et al: Efect of percutaneous trascatheter embolization
on pulmonary function right lo left shunt, and arterial oxigenation in patient with pulmonary AV malformations. Am Rev Respir Dis 1990; 142; 420-3.
24. Sty J R, Wells R: Technetium 99m particle imaging Adquired pulmonary microarteriovenous fistulae. Clin Nucl Med 1989; 14 (3): 212-3.
25. Shijo H, Hisano S et al; Detection of pulmonary telangiectasia using dinamic pulmonary perfusion imaging in patienl with liver cirrhosis. Clin Nucl Med 1989; 14 (3); 179-82.
26. Murakami T, Nakanishi M, Konishi T et al; Diffuse pu1monary arteriovenous fistula shown by contrast echocardiography and pulmonary angiography. Pediatr Radiol 1991; 21: 128
27. Chilvers E R, Peters A M, Huges J M: Quantification of right to left shunt through pulmonary arteriovenous malformations using 99Tc Albumin. Clin Radiol 1988; 39: 611-4.
28. Spies W G, Spies S W, Mintzner R A; Radionuclide imaging in diseases of the ches!. Chest 1983; 83 (2); 250-5.
Doctores: Aquiles González di Filippo, Prol Asoc; Alfonso
Palmieri Luna, R-1l1, Servo de Cirug. Gral., Fac. de
Medic., U. de Cartagena, Cartagena D. c., Colombia.
