DNA Microshades in the Study of the Immune System
Julio César Orrego A. M.D.
Estudiante de Maestría en Inmunología
Pablo Javier Patiño G. M.D. PhD.
José Luis Franco M.D. MSc.
Grupo de Inmunodeficiencias Primarias
Facultad de Medicina
Universidad de Antioquia
Cra 51D# 62-29.
Laboratorio de Inmunología Aula 206.
Medellín-Colombia.
Correspondencia
Julio César Orrego Arango.
jcoaaa@hotmail.com
Facultad de Medicina – Universidad de Antioquia.
Cra. 51D # 62 – 29 Laboratorio de Inmunología Aula 206
(054)-5106078.
Las micromatrices de ADN
Las micromatrices de ADN son una de las tecnologías más recientes para el estudio de la expresión global de genes. Esta muestra, en un solo experimento los genes que están siendo activados y expresados en forma de ARNm. En un grupo celular determinado y bajo diferentes estímulos.
Son múltiples las aplicaciones que se le han encontrado a esta metodología en el estudio celular permitiendo avanzar en campos tales como: el reconocimiento de los perfiles de respuesta celular ante estímulos determinados.
La expresión de los factores reguladores de diferenciación y crecimiento celular. La determinación de los componentes y la cinética de activación de las diferentes vías de transducción, entre otros.
En el campo clínico, las micromatrices han facilitado la comprensión de los mecanismos moleculares de carcinogénesis. Conocer nuevos marcadores tumorales, clasificar neoplasias de difícil diferenciación, identificar patrones de expresión diferencial de genes involucrados en la génesis de metástasis. Así como determinar los genes involucrados en las respuestas inmunes en diferentes enfermedades o en la respuesta a diferentes microorganismos.
En el FUTURO se espera que el conocimiento del genoma de cada individuo permita dilucidar la predisposición a sufrir determinadas enfermedades y de esta manera desarrollar terapias específicas para cada persona. Las micromatrices son uno de los instrumentos que harán posible este anhelo médico.
Abstract
The DNA microarrays is a new methodology that pretends analyze the global gene expression. This allows to evaluate in a single experiment, the genes that are being expressed in form of RNAm, in a certain cellular group and under different stimuli.
The multiple applications of the DNA microarrays have allowed to advance in fields such as: the recognition of profiles of cellular response to specific stimuli, the expression of factors that regulate differentiation and cellular growth, the determination of the components and the activation kinetic of different signal transduction pathways.
In the clinic field, the microarrays have facilitated the understanding of the molecular mechanisms of carcinogenesis, to establish new tumor like markers, to classify neoplasias with unclear differentiation, the identification of expression patterns differential of genes involved in metastasis and the determination of the genes involved in the immune responses in different diseases, among others.
In the near future one hopes that the knowledge of the genome and the gene expresion profile of each person allows to explain the predisposition to suffer certain diseases and therefore to develop specific therapies for each patient. The microarrays are one of the instruments that will make possible to achieve this medical hope.
Introducción
La estructura de la célula y los procesos que ocurren en ella dependen de la información almacenada en el ADN. La cual es inicialmente transcrita a ARNm y luego es traducida en proteínas. Estas proteínas interactúan entre sí y con otras moléculas para dar origen a las diversas estructuras celulares. Así como para constituir diferentes vías metabólicas y de activación celular.
En estos últimos años, la posibilidad de descifrar la secuencia de nucleótidos en el ADN que codifica para cada una de estas moléculas ha acelerado el conocimiento acerca de la estructura. Función y regulación de los múltiples eventos moleculares que gobiernan la actividad de las células (1).
En el siglo XIX, las observaciones del monje austriaco Gregor Mendel sugirieron que existía una relación entre un rasgo o carácter en un individuo y cierta información (almacenada en las células) que lo determinaba, y esta hipótesis llevó a proponer la existencia de lo que luego se denominó como genes.
A mediados del siglo XX se postuló un modelo estructural del ADN que permitió comprender las bases moleculares de los eventos que determinan la herencia. La transcripción génica y la replicación conservativa del ADN entre otros. Estableciendo las conceptos para el desarrollo de la tecnología que permitiría la manipulación del material genético y la relación de caracteres o enfermedades con un patrón de herencia definido.
Posteriormente, en los años 80 se vislumbró la posibilidad de determinar las secuencias completas de los genomás de varios organismos. Incluyendo el humano, dando así origen a la “genómica estructural” (1).
Más tarde, surgió el término “genómica funcional” como un concepto futurista, para definir la utilización de acercamientos globales para el entendimiento de las funciones de genes y/o proteínas. Que permiten establecer vías genéticas integradas que gobiernan la fisiología de un organismo (2).
Genómica Funcional
Hoy por hoy la genómica funcional está impulsando múltiples campos de la biología y la medicina, incorporando nuevas metodologías para el estudio del ADN y las proteínas, con herramientas computacionales para el análisis, archivo y manejo de la información.
Ejemplo de una de estas metodologías son las denominadas micromatrices de ADN, que permiten por ejemplo cuantificar la expresión genética del trascriptoma de una célula (3).
Debido que las micromatrices permiten obtener una visión global y cuantitativa de la expresión génica en el ARN mensajero (ARNm) producido por las células, esta tecnología ofrece grandes ventajas sobre métodos tradicionales que sólo permiten un análisis cualitativo o semicuantitativo de un número muy limitado de genes (4).
Es creciente el número de ESTUDIOS que están aplicando estas metodologías para llegar a un entendimiento de la estructura, función, diferenciación, interrelación y regulación de las diferentes células del sistema inmune (5). Que además permiten una nueva aproximación a enfermedades de diversa índole y de difícil clasificación y acerca de las cuales desconocemos sus bases moleculares y genéticas (3).
Las micromatrices hacen parte de las nuevas metodologías aplicadas en la genómica funcional que están cambiando el modelo reduccionista científico hacia un enfoque más amplio y directo de la interrelación de los componentes que constituyen las células de diferentes organismos. Hacia hipótesis dirigidas al entendimiento del funcionamiento global de un sistema celular (6).
De esta forma, ORGANIZACIONES tan complejas como el sistema inmune tienen ahora una nueva herramienta de análisis con múltiples aplicaciones de gran utilidad clínica.
Micromatrices de ADN
Las micromatrices son placas de cristal, plástico o nylon con un tamaño de pocos centímetros cuadrados de superficie. En las que se distribuyen ordenadamente de cientos a miles de secuencias de ADN (7).
Al igual que las técnicas de Southern y de Northern, el principio de las micromatrices es la hibridación (apareamiento complementario) entre ácidos nucleicos conocidos que son fijados químicamente a una superficie sólida (matriz). Y fragmentos de ácidos nucleicos complementarios presentes en las muestras en estudio (8).
Micromatrices de ADN complementario
Las micromatrices pueden contener ácidos nucleicos fundamentalmente de dos tipos: ADN complementario (ADNc) y oligonucleótidos sintéticos. Las micromatrices de ADN complementario. Se elaboran en una fase sólida mediante la aplicación automatizada de secuencias cortas correspondientes a los ADNc de un número variable de genes (teóricamente todos los genes humanos).
Los ADN complementarios empleados en la construcción de estas micromatrices se obtienen a partir de librerías de ADNc que contienen fragmentos representativos de genes en el transcriptoma. Los cuales se conocen como “secuencias de expresión cortas” (Expresed Séquense Tags – ETSs) y que son identificadas con un número de referencia o acceso de fácil identificación en una base de datos.
Para lograr la precisión requerida en la ubicación de las secuencias en la matriz. Se emplean técnicas de litofotografía y de semiductores haciendo posible que cada ADNc sea fijado en una posición conocida para su posterior identificación.
Las micromatrices de oligonucleótidos sintéticos se elaboran en una fase sólida similar y contienen fragmentos de oligonucleótidos representativos (generalmente entre 15 y 20 bases) de todos los genes de interés. Una variación de este tipo de matrices son las matrices de polimorfismos que contienen varios oligonucleótidos correspondientes a un sólo gen. Con las variaciones en su secuencia que son representativas de polimorfimos de interés (3) (8).
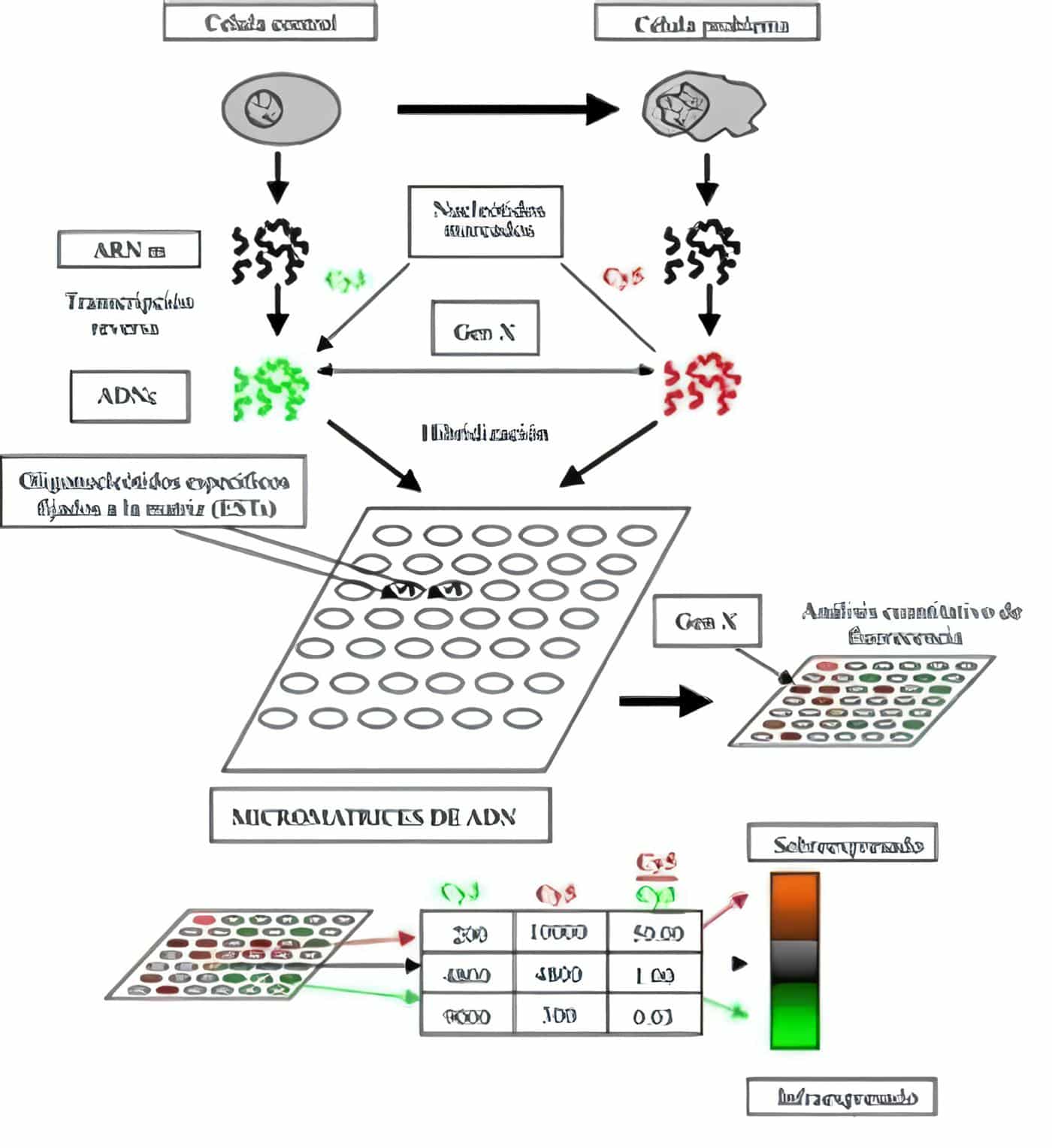
FIGURA 1. (Modificada de Staudt LM, Brown PO. Genomic views of the immune system*. Annu Rev Immunol 2000;18:829-59).
El ARNm obtenido de las células control (derecha) y de las células problema (izquierda) es convertido por medio de transcripción reversa en ADN complementario (ADNc) y marcado con oligonucleótidos fluorescentes (gris claro y gris oscuro). Ambas muestras se colocan a hibridizar sobre la placa de vidrio que contiene los oligonucleótidos en puntos exactos conocidos.
Luego de la hibridización se mide la intensidad de fluorescencia y se determina la relación entre la intensidad de la señal de luz de los fluorocromos aplicados (Cy3 – gris claro y Cy5 – gris oscuro).
Para determinar la expresión global de genes por medio de las micromatrices. Se requiere la obtención de ARN mensajero (ARNm) de las células a estudiar (células con una característica especial o que han sido estimuladas) y de células control (células normales o que no han sido estimuladas).
Seguidamente, este ARNm se convierte en ADN complementario (ADNc) por medio de una reacción de trascripción reversa en la que simultáneamente se agregan nucleótidos marcados con fluorocromos tales como la Cyanina-3 (Cy-3) y la Cyanina-5 (Cy-5). Alternativamente el marcaje del ADNc se puede realizar con un isótopo radioactivo.
En el proceso tradicional, para la muestra control se utiliza la Cy-3 y para la muestra problema se usa la Cy-5. La Cy-3 emite una fluorescencia verde. Mientras que la Cy-5 emite una fluorescencia roja (3).
Este marcaje diferencial permite no sólo localizar las señales fluorescentes en la micromatriz facilitando la identificación de los genes. Sino que también permite la cuantificación de las señales correspondientes a cada uno de ellos como una medida directa del grado de expresión del ARNm correspondiente.
Luego de adicionar el ADNc marcado a la matriz se debe esperar un tiempo prudencial (toda la noche) para propociar la hibridización.
Matrices de vidrio o de plástico
En el caso de las matrices de vidrio o de plástico, los resultados son analizados en un fluorómetro el cual cuantifica la intensidad de la fluorescencia en cada punto de la matriz, correspondiente a un gen (7).
La intensidad para cada fluorocromo reportada por el equipo en cada punto de la matriz es la resultante de la relación Cy5/Cy3 (verde/rojo). La cual se expresa como intensidad de fluorescencia en escala logarítmica y en números absolutos: si ésta es 1 (color amarillo) significa que el gen se expresa de manera similar en ambas muestras (control y problema). Si es menor que 1 (color verde) significa que el gen se expresó más en las células control y si la relación es mayor de 1 (color rojo) significa que el gen se sobre expresó en la muestra problema (Figura 1).
Convencionalmente se emplea como punto de corte de significancia el valor de dos en la escala logarítmica. Finalmente empleando algoritmos de asociación computacionales y con base en la regulación positiva y/o negativa de los genes bajo estudio. Es posible establecer relaciones entre los patrones de expresión de los genes y diversas funciones celulares (3).
Comúnmente en los estudios de este tipo. Estos datos se corroboran realizando análisis de Northern (ARNm) o de Western (proteínas) blots para aquellos genes que muestran una expresión diferencial (7). Permitiendo al investigador identificar características del sistema por medio de datos que pueden ser entendidos como una “escena” molecular en un estudio biológico.
Varias son las metodologías de la genómica funcional que permiten establecer el papel que desempeña un gen y su producto (la proteína) en los diferentes tipos de células.
Estudios de comparación filogenética y el análisis de homologías
Entre estas metodologías están los estudios de comparación filogenética y el análisis de homologías con secuencias ya conocidas (9) y las micromatrices de ADN que permiten estudiar indirectamente en que momento y bajo que estímulos se expresan determinadas proteínas y las consecuencias derivadas de las expresión.
Los modelos experimentales que se pueden establecer para conocer las circunstancias específicas en las cuales un gen muestra su máxima o su mínima expresión son múltiples. Y de esta forma se puede inferir los efectos que la expresión de múltiples genes tiene en una función específica gobernada por un sin número de proteínas.
Las micromatrices aunque muy convenientes para el estudio global de la expresión de genes. Tienen algunas desventajas con respecto a otras metodologías. A continuación se listan las principales ventajas y desventajas de esta metodología.
Las ventajas son:
- Facilitan el estudio de la expresión de miles de genes en forma simultánea en un sistema celular determinado.
- Permiten establecer una conexión biológica racional entre la función de un producto génico y su patrón de expresión. Así como su relación con los patrones de expresión de muchos otros genes simultáneamente. Es decir, facilitan identificar el grupo de genes expresados en una célula en un momento determinado. Esto permite analizar a fondo los sistemás bioquímicos y regulatorios que están operando y que funciones puede o no realizar la célula en un momento dado.
- La viabilidad técnica: es una tecnología de fácil transferencia (de hecho ya existe en nuestro medio tecnología adecuada para construirlas). La medición depende de una hibridación sencilla y hay suficiente información de libreras de secuencias para construirlas (3).
Sus desventajas son:
- El costo elevado de su elaboración.
- La necesidad de fluorómetros y de software especializados en el análisis de la información que dependen en forma importante de la casa comercial que los suministra.
- La reproducibilidad de los datos no siempre es consistente. Este problema se ha resulto parcialmente haciendo mediciones por duplicado (dos puntos en la matriz que corresponden al mismos gen).
- La repetición de un experimento a otro puede mostrar variaciones importantes en el patrón de expresión lo cual hace necesario en algunos casos obtener múltiples réplicas.
(Lea También: Micromatrices en Enfermedad: ADN en el Estudio del Sistema Inmune)
Utilidad de las Micromatrices en Inmunología (Tabla 1)
Tabla 1. Usos actuales de las micromatrices de ADN en inmunología
|
|
|
o Relación hospedero microorganismo o Características genéticas de los microroganismos |
|
Estudio del ARNm total de una célula (trascriptoma)
El estudio del ARNm total de una célula (trascriptoma) cobra gran valor gracias a la relación existente entre la expresión génica y la función de un gen:
Genes que participan en una misma respuesta tendrán una expresión aumentada mientras que aquellos que son inhibidos tendrán una expresión disminuida al compararlos con el control.
Es así como el estudio de la expresión global hace posible estudiar al mismo tiempo el comportamiento de múltiples genes en un momento celular específico. Que puede ser modificado y analizado de acuerdo a los conocimientos funcionales de la célula o grupo celular de interés.
Las micromatrices están siendo empleadas en la investigación biomédica cubriendo áreas tales como la fisiología, la genética, la embriología, etc. Sin embargo, los avances más importantes se han realizado empleando esta tecnología en el campo de la inmunología básica y aplicada.
El desarrollo de modelos experimentales de diferentes enfermedades inmunológicas basados en las micromatrices. Busca entender fisiopatogénesis y poder en un FUTURO cercano aplicar estos conocimientos para el manejo individualizado del paciente con afecciones del sistema inmune.
Perfiles de Expresión y Función Celular
Las micromatrices se han utilizado para entender globalmente fenómenos tales como la ontogenia. La diferenciación y la activación de las diversas células que componen el sistema inmune.
Así se han podido identificar un número importante de genes y su relación con otros genes conocidos que están involucrados en las diferentes fases de estos fenómenos inmunológicos (4). Este conocimiento detallado. En el caso particular de la respuesta inmune específica de los linfocitos. Cobra importancia al permitir establecer patrones de expresión de estas células en personas sanas que al ser comparadas con los patrones de expresión de las células de pacientes. Pueden llegar a identificar las bases moleculares de múltiples enfermedades.
El uso de las micromatrices para el estudio de la expresión génica en los diferentes estadios del ciclo celular y en diferentes células. Está ampliando el conocimiento de los factores reguladores del crecimiento tisular. Los resultados de estos análisis demuestran que los procesos moleculares están gobernados por múltiples genes que actúan relacionados directa o indirectamente con las múltiples funciones que cumple una célula dentro de su ciclo vital.
Este conocimiento está acelerando dramáticamente nuestro conocimiento acerca de los factores que regulan el desarrollo de los organismos y su respuesta frente al medio ambiente que lo rodea.
Transducción de señales intracelulares
Las células responden a estímulos gracias a la capacidad de relacionarse con el medio externo por medio de receptores ubicados en la membrana celular. Los cuales trasmiten la información recibida al interior de la célula por medio de segundos mensajeros intracelulares.
El avance reciente del conocimiento inmunológico en las diferentes vías de señalización que llevan a la respuesta frente a un estímulo determinado ha sido significativo. No obstante. La creciente complejidad de estos fenómenos dificulta cada vez más la comprensión de todas las interrelaciones. Que hacen posible las respuestas desencadenadas por diferentes estímulos externos.
Una de las vías de señalización más estudiadas, es la activación del linfocito T luego de la presentación antigénica con o sin coestimulación. En este campo las micromatrices han permitido profundizar ampliamente los diferentes componentes génicos. Que intervienen en la cinética de activación del linfocito T en respuesta al reto antigénico (10).
El resultado de este análisis es el de un panorama integrado de señales que convergen para promover una respuesta inmune y los genes que participan en ella. Esta información está siendo empleada por los científicos y las casas farmacéuticas para desarrollar nuevas modalidades de tratamiento. Las aplicaciones derivadas de estos ESTUDIOS génicos y su aplicación en el campo de la farmacología se conoce ahora como “farmacogenómica”.





