Se estudiaron 31 pacientes diagnosticadas de cáncer de mama invasor. La clasificación de las pacientes se basó en el sistema TNM. El periodo de estudio fue de mayo del 2005 a mayo del 2010. Estas pacientes recibieron cirugía radical con buena migración del marcador durante la determinación del ganglio centinela.
Este estudio fue validado por el comité de ética e investigación clínica del Hospital Clínico San Carlos de Madrid, España (HCSC) y aprobado por el Departamento de Anatomía Patológica y Patología Clínica de la Universidad del Valle, en Cali, Colombia (UV).
Anatomía Patológica: Una vez los ganglios centinelas eran recibidos en el laboratorio de Anatomía Patológica se prepararon según los procedimientos estándares. Cada ganglio linfático se cortaba en dos o más partes entre 1.5 y 3mm.
Los fragmentos del ganglio centinela elegidos para RTPCR no podían haber sido usados en la biopsia por congelación.
Este ganglio era distribuido según el tamaño: un 50% a 75% para Anatomía Patológica y entre un 25% a 50% para la técnica molecular, transportado en solución de guanidina (RNA STAT- 60) al laboratorio de biología molecular.
El fragmento o fragmentos del ganglio centinela fueron fijados con formalina y posteriormente incluidos en bloques de parafina. Una vez en estos bloque, se realizaron un mínimo de 6 niveles por bloque para coloración de H&E y otros seis niveles para realizar el estudio de IHC para citoqueratina AE1-AE3 según los protocolos. (Figura 1)
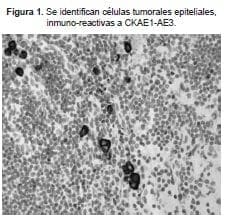
Las mamas estudiadas fueron revisadas por dos patólogos independientes (HCSC y UV) e incluían variables como: tamaño del tumor, tipo histológico, presencia o ausencia del componente intraductal, porcentaje sobre el total del tumor, grado histológico y nuclear, estado de los márgenes, estado de la piel y músculos profundos, invasión vascular y neural, número de ganglios linfáticos de la linfadenectomía, técnica de IHC, receptores hormonales, Ki67 y HER-2neu.
Molecular: La extracción del RNA de cada una de las muestras se realizó siguiendo las indicaciones del Rneasy Mini Kit (Qiagen).
Un volumen de etanol al 70% era añadido al tejido y posteriormente homogeneizado por medios mecánicos.
La mezcla es añadida a una columna para centrifugar a 8.000 g durante 30 segundos. El RNA queda adherido a la membrana de la columna y es eluido en 50 μl de agua libre de RNasas.
La integridad del RNA se comprobó en gel de agarosa en condiciones desnaturalizantes al 1%. (Lea también: Comparación entre Diferentes Técnicas de Estudio del Ganglio Centinela Después de Neoadyuvancia en Cáncer de Mama)
Solo las muestras que presentaban las bandas 28S y 18S del RNA ribosómico eran usadas en las técnicas de RT-PCR. Para la determinación de mamaglobina y CK-19 se emplearon 5 μl de RNA.
Los primeros empleados en la RT-PCR fueron: Sense 5’CAA ACG GAT GAA ACT CTG AGC AAT GTT GA y AntiSense 5’TCT GTG AGC CAA AGG TCT TGC AGA en el caso de la mamoglobina A y Sense: 5’AGA TGA GCA GGT CCG AGG TTA y AntiSense 5’ CCT GAT TCT GCC GCT CAC TAT CA en la determinación de la CK-19 (10).
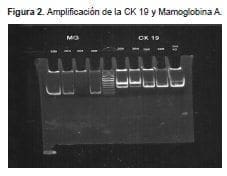
En la amplificación se empleó una concentración final de 400 μM de dNTP y 0.6μM de cada uno de los primers. Se realizó la retrotranscripción y la amplificación en una sola reacción.
El análisis de los productos amplificados se realizó en un gel de poliacrilamida al 12 %.(Figura 2)

