El ejercicio anaeróbico es aquel de alta intensidad y baja duración (menos de dos minutos). En esta situación, las demandas de energía se suplen mediante el sistema de provisión de fósforo y ácido láctico, los cuales dependen en gran medida del glucógeno que se encuentra en el sistema musculoesquelético. Durante el ejercicio anaeróbico, las fuerzas de contracción dentro del músculo son fuertes y las fibras musculares se lesionan. En el periodo de recuperación, además de reponer los carbohidratos, es necesario suplir los aminoácidos esenciales para apoyar la síntesis de proteínas necesarias para reparar y reconstruir el músculo.
En general, las dietas cetogénicas contienen cantidades suficientes de proteínas (alrededor del 15% del valor calórico total); sin embargo, la baja ingestión de carbohidratos puede afectar de forma adversa el rendimiento anaeróbico, debido a que incrementa la dependencia de aminoácidos gluconeogénicos y disminuye la reposición de glucógeno (83).
Combinación con los ejercicios anaeróbicos
Varios estudios demuestran que, en combinación con los ejercicios anaeróbicos, las dietas cetogénicas y bajas en carbohidratos no se pueden considerar una estrategia efectiva para incrementar el rendimiento anaeróbico ni la masa corporal (10,85-87); inclusive, la hipertrofia muscular del entrenamiento puede verse afectada con este tipo de alimentación (83). En el cuadro 1 (86) se resumen los efectos de las dietas cetogénicas en los diferentes deportes y sus posibles mecanismos fisiológicos (80,88–90).
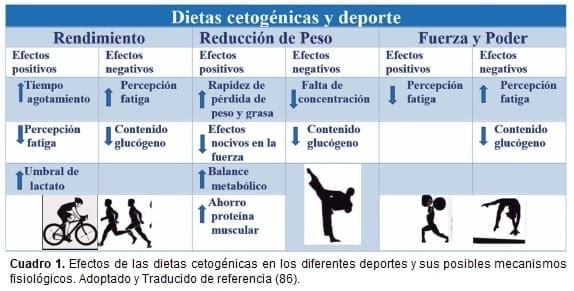
En conclusión, tal como dice Paoli (85), la dieta cetogénica en el deporte sigue siendo una zona de penumbra “el punto medio entre la luz y la sombra, entre la ciencia y la superstición”. Se puede decir que varios estudios respaldan su empleo en atletas de resistencia como una estrategia efectiva para reducir el peso corporal y la masa grasa, particularmente en el período de las 3 a las 12 semanas.
Las investigaciones que demuestran una mejoría significativa en el rendimiento del ejercicio de intensidad moderada son limitadas; sin embargo, el rendimiento del ejercicio de intensidad más alta puede verse afectado. Su empleo por periodos cortos no afecta los parámetros de rendimiento, pero puede conducir a una disminución indeseada de la masa corporal magra o bloquear la hipertrofia muscular. Por lo tanto, no se respalda el uso de las dietas cetogénicas como una estrategia alimentaria efectiva para aumentar el rendimiento deportivo (83).
(Lea También: ¿Qué Leía el Doctor Juvenal Urbino en el Amor en los Tiempos del Cólera?)
Efectos secundarios
El efecto adverso que se reporta con mayor frecuencia con este tipo de alimentación es la falta de observancia del tratamiento debido a las limitadas opciones de alimentos y a otros efectos predecibles, como hipoglucemia, deshidratación y letargia.
Las características de la alimentación también conducen a efectos gastrointestinales, pérdida de peso e hiperlipidemia transitoria. Entre los efectos gastrointestinales, los más frecuentes son náuseas, vómito, estreñimiento y disminución del apetito. Estos se pueden manejar con ajustes en la alimentación por parte de un profesional en nutrición y dietética.
En los pacientes con sobrepeso u obesidad, la pérdida de peso puede ser un efecto benéfico, pero en aquellos desnutridos, como los enfermos con gliomas, obviamente no lo son. Por lo tanto, se requieren ajustes calóricos para evitar la pérdida de peso (50,55,91).
Los cambios en el perfil de los lípidos, como la elevación en ayunas de los valores del colesterol sérico:
Los triglicéridos y las lipoproteínas de baja densidad (LDL) y la disminución de las lipoproteínas de alta densidad (HDL), se presentan durante el primer año de tratamiento, pero tienden a normalizarse después de este tiempo.
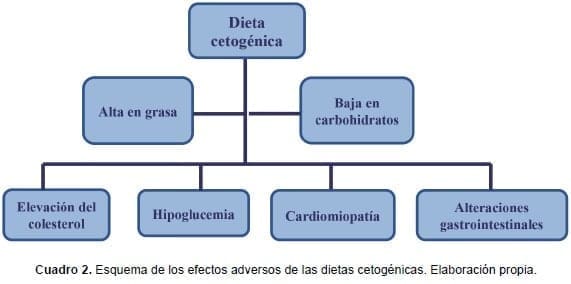
Otros efectos adversos que se han visto con la dieta cetogénica son hepatitis, pancreatitis, hiperuricemia, hipertransaminemia, hipomagnesemia e hiponatremia (33,50,91)substrate utilization; body composition and quality of life (QOL. La restricción estricta de carbohidratos puede generar deficiencias de vitaminas y minerales, y propiciar la osteopenia y la osteoporosis. Esto hace necesario emplear suplementos para alcanzar las cantidades requeridas (50,55,91).
El empleo por tiempos prolongados de la dieta cetogénica puede causar también aterosclerosis, cardiomiopatía, nefrolitiasis, neuropatía del nervio óptico y anemia. En el metabolismo, puede alterar el catabolismo y reducir la síntesis de proteínas funcionales. Además, el poder cumplir con las necesidades calóricas se dificulta debido a la pérdida de apetito y a la disminución de atractivo organoléptico de los alimentos (50,91) (cuadro 2).
Contraindicaciones y seguimiento
Las dietas cetogénicas están contraindicadas en forma absoluta cuando existen alteraciones metabólicas incluidas la deficiencia de piruvato carboxilasa o de carnitina, y los defectos en la oxidación de los ácidos grasos, como aquellos en el transportador de carnitina y porfiria (11).
Algunas de las contraindicaciones relativas son las hiperlipidemias y la litiasis renal. Por esta razón, antes de comenzar este tipo de régimen alimentario, se sugiere solicitar exámenes de sangre y orina. En sangre, se deben determinar la acil-carnitina, el lactato y el perfil de lípidos. En la orina, se deben evaluar los ácidos orgánicos, la relación entre calcio y creatinina, y practicar el uroanálisis.
Durante el seguimiento y, por lo menos, cada tres meses, se deben practicar exámenes de sangre, como hemograma completo, glucemia, electrolitos que incluyan calcio, magnesio y fósforo, albúmina, lipasa, selenio, fosfatasa alcalina, 25-hidroxivitamina D, perfil lipídico en ayunas, carnitina (si está en tratamiento con valproato) y niveles de beta-hidroxibutirato; y en la orina, uroanálisis y la relación entre calcio y creatinina.
Efectos secundarios
La dieta cetogénica tradicional, es decir, la más estricta, genera problemas de observancia y tolerancia. Las versiones modificadas, que son menos estrictas, son más llevaderas.
Algunos de los efectos secundarios agudos que pueden presentarse en el inicio la dieta, son náuseas, vómito, hipoglucemia y cetosis excesiva que conduce a letargia (11).
Los efectos secundarios crónicos pueden ser:
- Gastrointestinales: estreñimiento, pérdida de peso, deficiencia de vitaminas y minerales (selenio, vitamina D y calcio) y pancreatitis
- Renal: cálculos
- Cardiaco: intervalo QT prolongado, miocardiopatía
- Crecimiento y desarrollo: baja talla, osteopenia
- Exámenes de laboratorio: baja albúmina, baja carnitina, perfil anormal de lípidos.
Conclusión
Las dietas cetogénicas se han empleado desde hace muchos años, principalmente en los pacientes con epilepsia, y su empleo se ha extendido a otras enfermedades como el cáncer, las enfermedades neurológicas, la obesidad y la resistencia a la insulina. Aunque se han obtenido buenos resultados, existe dificultad para estandarizar los datos debido a la inexactitud de la información sobre la ingestión de alimentos y el cumplimiento de la dieta a largo plazo, y el número limitado de pacientes y su deserción, lo cual hace difícil reproducir y generalizar los resultados de los estudios con este tratamiento nutricional.
La dieta cetogénica no es inocua; es necesario que su indicación, implementación y seguimiento estén a cargo de profesionales de la salud idóneos en el tema, quienes pueden establecer los riesgos y beneficios que se pueden obtener en cada una de las indicaciones.
Conflicto de interés
Asesor científico de Boydorr Nutrition.
Referencias
- 1. McDonald TJW, Cervenka MC. Lessons learned from recent clinical trials of ketogenic diet therapies in adults. Curr Opin Clin Nutr Metab Care. 2019;22(6):418–24.
- 2. Kverneland M, Molteberg E, Iversen PO, Veierød MB, Taubøll E, Selmer K, et al. Effect of modified Atkins diet in adults with drug-resistant focal epilepsy: A randomized clinical trial. Epilepsia. 2018;59(8):1567–76.
- 3. Sremanakova J, Sowerbutts AM, Burden S. A systematic review of the use of ketogenic diets in adult patients with cancer. J Hum Nutr Diet. 2018;31(6):793–802.
- 4. Klement RJ. The emerging role of ketogenic diets in cancer treatment. Curr Opin Clin Nutr Metab Care. 2019;22(2):129–34.
- 5. Phillips MCL, Murtagh DKJ, Gilbertson LJ, Asztely FJS, Lynch CDP. Low-fat versus ketogenic diet in Parkinson’s disease: A pilot randomized controlled trial. Mov Disord. 2018;33(8):1306–14.
- 6. Brenton JN, Banwell B, Bergqvist AGC, Lehner-Gulotta D, Gampper L, LeythamE, et al. Pilot study of a ketogenic diet in relapsing-remitting MS. Neurol Neuroimmunol Neuroinflamm. 2019;6(4):e565.
- 7. Evcili G, Utku U, Öğün MN, Özdemir G. Early and long period follow-up results of low glycemic index diet for migraine prophylaxis. Agri. 2018;30(1):8–11.
- 8. Hallberg SJ, McKenzie AL, Williams PT, Bhanpuri NH, Peters AL, Campbell W, et al. Effectiveness and Safety of a Novel Care Model for the Management of Type 2 Diabetes at 1 Year: An Open-Label, Non-Randomized, Controlled Study. Diabetes Ther. 2018;9(2):583–612.
- 9. Ota M, Matsuo J, Ishida I, Takano H, Yokoi Y, HoriH, et al. Effects of a medium-chain triglyceride-based ketogenic formula on cognitive function in patients with mild-to-moderate Alzheimer’s disease. Neurosci Lett. 2019;690:232–6.
- 10. Vargas S, Romance R, Petro JL, Bonilla DA, Galancho I, Espinar S, et al. Efficacy of ketogenic diet on body composition during resistance training in trained men: a randomized controlled trial. J Int Soc Sports Nutr. 2018;15(1):31. Dhamija R, Eckert S, Wirrell E. Ketogenic diet. Can J Neurol Sci. 2013;40(2):158–67.
- 11. Huttenlocher PR, Wilbourn AJ, Signore JM. Mediumchain triglycerides as a therapy for intractable childhood epilepsy. Neurology. 1971;21(11):1097–103.
- 12. Walczyk T, Wick JY. The Ketogenic Diet: Making a Comeback. Consult Pharm. 2017;32(7):388–96.
- 13. Paoli A, Bianco A, Damiani E, Bosco G. Ketogenic diet in neuromuscular and neurodegenerative diseases. Biomed Res Int. 2014;2014:474296.
- 14. Medeiros D, Wildman R, editores. Lipids: fatty acids, triglycerides, phospholipids, and sterols. En: Advanced Human NutritionthCuarta edición. Jones & Barlett Learning; 2019. p. 111-146.
- 15. Mayes P. Metabolismo de lípidos. En: Harper H, editor. Manual de química fisiológica. Cuarta edición. México: Litografía Maico; 1973. p. 297–343.
- 16. McDonald TJW, Cervenka MC. The Expanding Role of Ketogenic Diets in Adult Neurological Disorders. Brain Sci. 2018;8(8).
- 17. Hipócrates. The genuine work of Hippocrates. Baltimore: Williams and Wilkins; 193p.
- 18. Guelpa G, Marie A. La lutte contre l’épilepsie par la désintoxication et par la rééducation alimentaire. Rev Ther Medico-Chirurgicale. 1911;78:8–13.
- 19. Conklin HW. Cause and treatment of epilepsy. J Am Osteopathic Assoc. 1922;26:11–4.
- 20. Wilder HH. Anthropometric measurements. Science. 1921;53(1358):20.
- 21. Martin-McGill KJ, Jackson CF, Bresnahan R, Levy RG, Cooper PN. Ketogenic diets for drug-resistant epilepsy. Cochrane Database Syst Rev. 2018;11:CD001903.
- 22. Hong AM, Turner Z, Hamdy RF, Kossoff EH. Infantile spasms treated with the ketogenic diet: prospective single-center experience in 104 consecutive infants. Epilepsia. 2010;51(8):1403–7.
- 23. Caraballo RH. Nonpharmacologic treatments of Dravet syndrome: focus on the ketogenic diet. Epilepsia. 2011;52(Suppl 2):79–82.
- 24. Nabbout R, Copioli C, Chipaux M, Chemaly N, Desguerre I, Dulac O, et al. Ketogenic diet also benefits Dravet syndrome patients receiving stiripentol: a prospective pilot study. Epilepsia. 2011;52(7):e54-57.
- 25. Caraballo RH, Cersósimo RO, Sakr D, Cresta A, Escobal N, Fejerman N. Ketogenic diet in patients with myoclonic- astatic epilepsy. Epileptic Disord. 2006;8(2):151–5.
- 26. Kilaru S, Bergqvist AGC. Current treatment of myoclonic astatic epilepsy: clinical experience at the Children’s Hospital of Philadelphia. Epilepsia. 2007;48(9):1703–7.
- 27. Lemmon ME, Terao NN, Ng Y-T, Reisig W, Rubenstein JE, Kossoff EH. Efficacy of the ketogenic diet in Lennox- Gastaut syndrome: a retrospective review of one institution’s experience and summary of the literature. Dev Med Child Neurol. 2012;54(5):464–8.
- 28. Nabbout R, Mazzuca M, Hubert P, Peudennier S, Allaire C, FlurinV, et al. Efficacy of ketogenic diet in severe refractory status epilepticus initiating fever induced refractory epileptic encephalopathy in school age children (FIRES). Epilepsia. 2010;51(10):2033–7.
- 29. Kang H-C, Lee YJ, Lee JS, Lee EJ, Eom S, You SJ, et al. Comparison of short- versus long-term ketogenic diet for intractable infantile spasms. Epilepsia. 2011;52(4):781–7.
- 30. Cusmai R, Martinelli D, Moavero R, Dionisi Vici C, Vigevano F, Castana C, et al. Ketogenic diet in early myoclonic encephalopathy due to non ketotic hyperglycinemia. Eur J Paediatr Neurol. 2012;16(5):509–13.
- 31. Nangia S, Caraballo RH, Kang H-C, Nordli DR, Scheffer IE. Is the ketogenic diet effective in specific epilepsy syndromes? Epilepsy Res. 2012;100(3):252–7.
- 32. Mosek A, Natour H, Neufeld MY, Shiff Y, Vaisman N. Ketogenic diet treatment in adults with refractory epilepsy: a prospective pilot study. Seizure. 2009;18(1):30–3.
- 33. Klein P, Janousek J, Barber A, Weissberger R. Ketogenic diet treatment in adults with refractory epilepsy. Epilepsy Behav. 2010;19(4):575–9.
- 34. Kossoff EH, Rowley H, Sinha SR, Vining EPG. A prospective study of the modified Atkins diet for intractable epilepsy in adults. Epilepsia. 2008;49(2):316–9.
- 35. Swerdlow RH. Brain aging, Alzheimer’s disease, and mitochondria. Biochim Biophys Acta. 2011;1812(12):1630– 9.
- 36. Wilkins HM, Swerdlow RH. Amyloid precursor protein processing and bioenergetics. Brain Res Bull. 2017;133:71–9.
- 37. Castellano C-A, Nugent S, Paquet N, Tremblay S, Bocti C, LacombeG, et al. Lower brain 18F-fluorodeoxyglucose uptake but normal 11C-acetoacetate metabolism in mild Alzheimer’s disease dementia. J Alzheimers Dis. 2015;43(4):1343–53.
- 38. aylor MK, Sullivan DK, Swerdlow RH, Vidoni ED, Morris JK, Mahnken D, et al. A high-glycemic diet is associated with cerebral amyloid burden in cognitively normal older adults. Am J Clin Nutr. 2017;106(6):1463–70.
- 39. de la Monte SM. Insulin Resistance and Neurodegeneration: Progress Towards the Development of New Therapeutics for Alzheimer’s Disease. Drugs. 2017;77(1):47– 65.
- 40. Gaspar JM, Baptista FI, Macedo MP, Ambrósio AF. Inside the Diabetic Brain: Role of Different Players Involved in Cognitive Decline. ACS Chem Neurosci. 2016;7(2):131–42.
- 41. Nafar F, Clarke JP, Mearow KM. Coconut oil protects cortical neurons from amyloid beta toxicity by enhancing signaling of cell survival pathways. Neurochem Int. 2017;105:64–79.
- 42. Reger MA, Henderson ST, Hale C, Cholerton B, Baker LD, Watson S, et al. Effects of beta-hydroxybutyrate on cognition in memory-impaired adults. Neurobiol Aging. 2004;25(3):311–4.
- 43. Henderson ST, Vogel JL, Barr LJ, Garvin F, Jones JJ, Costantini LC. Study of the ketogenic agent AC-1202 in mild to moderate Alzheimer’s disease: a randomized, double-blind, placebo-controlled, multicenter trial. Nutr Metab (Lond). 2009;6:31.
- 44. Taylor MK, Sullivan DK, Mahnken JD, Burns JM, Swerdlow RH. Feasibility and efficacy data from a ketogenic diet intervention in Alzheimer’s disease. Alzheimers Dement (N Y). 2018;4:28–36.
- 45. Krikorian R, Shidler MD, Dangelo K, Couch SC, Benoit SC, Clegg DJ. Dietary ketosis enhances memory in mild cognitive impairment. Neurobiol Aging. 2012;33(2):425. e19-27.
- 46. Newport MT, VanItallie TB, Kashiwaya Y, King MT, Veech RL. A new way to produce hyperketonemia: use of ketone ester in a case of Alzheimer’s disease. Alzheimers Dement. 2015;11(1):99–103.
- 47. Rebello CJ, Keller JN, Liu AG, Johnson WD, Greenway FL. Pilot feasibility and safety study examining the effect of medium chain triglyceride supplementation in subjects with mild cognitive impairment: A randomized controlled trial. BBA Clin. 2015;3:123–5.
- 48. Ohnuma T, Toda A, Kimoto A, Takebayashi Y, Higashiyama R, Tagata Y, et al. Benefits of use, and tolerance of, medium-chain triglyceride medical food in the management of Japanese patients with Alzheimer’s disease: a prospective, open-label pilot study. Clin Interv Aging. 2016;11:29–36.
- 49. George AJ, Holsinger RMD, McLean CA, Laughton KM, Beyreuther K, Evin G, et al. APP intracellular domain is increased and soluble Abeta is reduced with diet-induced hypercholesterolemia in a transgenic mouse model of Alzheimer disease. Neurobiol Dis. 2004;16(1):124–32.
- 50. Rusek M, Pluta R, Ułamek-Kozioł M, Czuczwar SJ. Ketogenic Diet in Alzheimer’s Disease. Int J Mol Sci. 2019;20(16).
- 51. Kashiwaya Y, Takeshima T, Mori N, Nakashima K, Clarke K, Veech RL. D-beta-hydroxybutyrate protects neurons in models of Alzheimer’s and Parkinson’s disease. Proc Natl Acad Sci USA. 2000;97(10):5440–4.
- 52. Vanitallie TB, Nonas C, Di Rocco A, Boyar K, Hyams K, Heymsfield SB. Treatment of Parkinson disease with diet-induced hyperketonemia: a feasibility study. Neurology. 2005;64(4):728–30.
- 53. Benlloch M, López-Rodríguez MM, Cuerda-Ballester M, Drehmer E, Carrera S, Ceron JJ, et al. Reply to “When Is a Ketogenic Diet Ketogenic? Comment on Satiating Effect of a Ketogenic Diet and Its Impact on Muscle Improvement and Oxidation State in Multiple Sclerosis Patients. Nutrients 2019, 11, 1156”. Nutrients. 2019;11(8).
- 54. Branco AF, Ferreira A, Simões RF, Magalhães-Novais S, Zehowski C, Cope E, et al. Ketogenic diets: from cancer to mitochondrial diseases and beyond. Eur J Clin Invest. 2016;46(3):285–98.
- 55. Bozzetti F, Zupec-Kania B. Toward a cancer-specific diet. Clin Nutr. 2016;35(5):1188–95.
- 56. Weber DD, Aminzadeh-Gohari S, Tulipan J, Catalano L, Feichtinger RG, Kofler B. Ketogenic diet in the treatment of cancer – Where do we stand? Mol Metab. 2020;33:102–21.
- 57. Cohen CW, Fontaine KR, Arend RC, Soleymani T, Gower BA. Favorable Effects of a Ketogenic Diet on Physical Function, Perceived Energy, and Food Cravings in Women with Ovarian or Endometrial Cancer: A Randomized, Controlled Trial. Nutrients. 2018;10(9).
- 58. Allen BG, Bhatia SK, Anderson CM, Eichenberger-Gilmore JM, Sibenaller ZA, Mapuskar KA, et al. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism. Redox Biol. 2014;2:963–70.
- 59. Nebeling LC, Miraldi F, Shurin SB, Lerner E. Effects of a ketogenic diet on tumor metabolism and nutritional status in pediatric oncology patients: two case reports. J Am Coll Nutr. 1995;14(2):202–8.
- 60. Fearon KC, Borland W, Preston T, Tisdale MJ, Shenkin A, Calman KC. Cancer cachexia: influence of systemic ketosis on substrate levels and nitrogen metabolism. Am J Clin Nutr. 1988;47(1):42–8.
- 61. Weeks HD, Weidman-Evans E. Adjuvant metabolic therapy for glioblastoma multiform. Clinical Nutrition ESPEN. 2017;19:70–2.
- 62. Mayer A, Vaupel P, Struss H-G, Giese A, Stockinger M, Schmidberger H. Strong adverse prognostic impact of hyperglycemic episodes during adjuvant chemoradiotherapy of glioblastoma multiforme. Strahlenther Onkol. 2014;190(10):933–8.
- 63. Champ CE, Palmer JD, Volek JS, Werner-Wasik M, Andrews DW, Evans J, et al. Targeting metabolism with a ketogenic diet during the treatment of glioblastoma multiforme. J Neurooncol. 2014;117(1):125–31.
- 64. Schwartz K, Chang HT, Nikolai M, Pernicone J, Rhee S, OlsonK, et al. Treatment of glioma patients with ketogenic diets: report of two cases treated with an IRBapproved energy-restricted ketogenic diet protocol and review of the literature. Cancer Metab. 2015;3:3.
- 65. Elsakka AMA, Bary MA, Abdelzaher E, Elnaggar M, Kalamian M, MukherjeeP, et al. Management of Glioblastoma Multiforme in a Patient Treated With Ketogenic Metabolic Therapy and Modified Standard of Care: A 24-Month Follow-Up. Front Nutr. 2018;5:20.
- 66. Artzi M, Liberman G, Vaisman N, Bokstein F, Vitinshtein F, AizensteinO, et al. Changes in cerebral metabolism during ketogenic diet in patients with primary brain tumors: 1H-MRS study. J Neurooncol. 2017;132(2):267–75.
- 67. Rieger J, Bähr O, Maurer GD, Hattingen E, Franz K, BruckerD, et al. ERGO: a pilot study of ketogenic diet in recurrent glioblastoma. Int J Oncol. 2014;44(6):1843–52.
- 68. Zuccoli G, Marcello N, Pisanello A, Servadei F, Vaccaro S, MukherjeeP, et al. Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: Case Report. Nutr Metab (Lond). 2010;7:33.
- 69. Santos JG, Da Cruz WMS, Schönthal AH, Salazar MD, Fontes CAP, Quirico-SantosT, et al. Efficacy of a ketogenic diet with concomitant intranasal perillyl alcohol as a novel strategy for the therapy of recurrent glioblastoma. Oncol Lett. 2018;15(1):1263–70.
- 70. Seyfried TN, Kiebish M, Mukherjee P, Marsh J. Targeting energy metabolism in brain cancer with calorically restricted ketogenic diets. Epilepsia. 2008;49 Suppl 8:114–6.
- 71. Kuchkuntla AR, Shah M, Velapati S, Gershuni VM, Rajjo T, NandaS, et al. Ketogenic Diet: an Endocrinologist Perspective. Curr Nutr Rep. 2019;8(4):402–10.
- 72. Velapati SR, Shah M, Kuchkuntla AR, Abu-Dayyeh B, Grothe K, Hurt T, et al. Weight Regain After Bariatric Surgery: Prevalence, Etiology, and Treatment. Curr Nutr Rep. 2018;7(4):329–34.
- 73. Wheless JW. History of the ketogenic diet. Epilepsia. 2008;49 Suppl 8:3–5.
- 74. Atkins RC. Dr. Atkins’ New Diet Revolution. New York: HarpPeren; 1998p.
- 75. MD Atkins, Robert. Dr. Atkins’ New Diet Revolution. Government Institutes; 200p.
- 76. Kuchkuntla AR, Limketkai B, Nanda S, Hurt RT, Mundi MS. Fad Diets: Hype or Hope? Curr Nutr Rep. 2018;7(4):310–23.
- 77. Murphy EA, Jenkins TJ. A ketogenic diet for reducing obesity and maintaining capacity for physical activity: hype or hope? Curr Opin Clin Nutr Metab Care. 2019;22(4):314–9.
- 78. Cox PJ, Kirk T, Ashmore T, Willerton K, Evans R, Smith A, et al. Nutritional Ketosis Alters Fuel Preference and Thereby Endurance Performance in Athletes. Cell Metab. 2016;24(2):256–68.
- 79. Wilson JM, Lowery RP, Roberts MD, Sharp MH, Joy JM, Shields A, et al. The Effects of Ketogenic Dieting on Body Composition, Strength, Power, and Hormonal Profiles in Resistance Training Males. J Strength Cond Res. 2017;.
- 80. Wolfe RR. Branched-chain amino acids and muscle protein synthesis in humans: myth or reality? J Int Soc Sports Nutr. 2017;14:30.
- 81. Paoli A, Cancellara P, Pompei P, Moro T. Ketogenic Diet and Skeletal Muscle Hypertrophy: A Frenemy Relationship? J Hum Kinet. 2019;68:233–47.
- 82. Harvey KL, Holcomb LE, Kolwicz SC. Ketogenic Diets and Exercise Performance. Nutrients. 2019;11(10).
- 83. Chang C-K, Borer K, Lin P-J. Low-Carbohydrate-High- Fat Diet: Can it Help Exercise Performance? J Hum Kinet. 2017;56:81–92.
- 84. Paoli A, Bianco A, Grimaldi KA. The Ketogenic Diet and Sport: A Possible Marriage? Exerc Sport Sci Rev. 2015;43(3):153–62.
- 85. Burke LM, Ross ML, Garvican-Lewis LA, Welvaert M, Heikura IA, Forbes G, et al. Low carbohydrate, high fat diet impairs exercise economy and negates the performance benefit from intensified training in elite race walkers. J Physiol (Lond). 2017;595(9):2785–807.
- 86. Burke LM. Re-Examining High-Fat Diets for Sports Performance: Did We Call the “Nail in the Coffin” Too Soon? Sports Med. 2015;45 Suppl 1:S33-49.
- 87. McSwiney FT, Wardrop B, Hyde PN, Lafountain RA, Volek JS, Doyle L. Keto-adaptation enhances exercise performance and body composition responses to training in endurance athletes. Metab Clin Exp. 2018;81:25–34.
- 88. Paoli A, Grimaldi K, D’Agostino D, Cenci L, Moro T, BiancoA, et al. Ketogenic diet does not affect strength performance in elite artistic gymnasts. J Int Soc Sports Nutr. 2012;9(1):34.
- 89. Greene DA, Varley BJ, Hartwig TB, Chapman P, Rigney M. A Low-Carbohydrate Ketogenic Diet Reduces Body Mass Without Compromising Performance in Powerlifting and Olympic Weightlifting Athletes. J Strength Cond Res. 2018;32(12):3373–82.
- 90. Benlloch M, López-Rodríguez MM, Cuerda-Ballester M, Drehmer E, Carrera S, Ceron J, et al. Satiating Effect of a Ketogenic Diet and Its Impact on Muscle Improvement and Oxidation State in Multiple Sclerosis Patients. Nutrients. 2019;11(5).
Recibido: Febrero 5, 2020
Aceptado: Mayo 21, 2020
Correspondencia:
Patricia Savino
patricia.savino@gmail.com





