Durante gran parte del siglo 20, la cirugía y la radioterapia eran considerados los pilares del tratamiento del CCyC, siendo la quimioterapia una opción utilizado sólo en escenarios paliativos en tumores avanzados.
La quimioterapia sólo empezó a utilizarse formalmente en este tipo de tumores hacia los años 70s.
Un artículo de la revista Cancer publicado en 1984 resume claramente que tipo de quimioterapias se solían utilizar y en qué escenarios clínicos (41). Para esa época, el metotrexate era el fármaco más estudiado, utilizado principalmente en CCyC de tipo escamoso recurrente (42). Se utilizaba a dosis de 40- 60 mg/m2 de superficie de área corporal, intravenoso, semanal (diferentes esquemas con dosis mucho más altas fueron también estudiados pero no se encontró mayor efectividad pero si una mayor toxicidad) (43).
Otros medicamentos también utilizados en el siglo pasado eran la bleomicina, el cisplatino, la ciclofosfamida y la hidroxiurea. También para esta época se introducía el concepto de quimioterapia de inducción o quimioterapia neoadyuvante previa al tratamiento quirúrgico (44).
Además de la terapia neoadyuvante, la quimioterapia adyuvante también fue estudiada en diferentes escenarios, algunas veces precedida de radioterapia, pero sin encontrar ningún beneficio en cuanto a desenlaces de sobrevida (45).
Hasta este punto de la historia, parecía que el uso de quimioterapia no tuviera un rol significativo en el tratamiento del CCyC, pues los resultados de su uso en los escenarios pre y posquirúrgicos no mostraban beneficios mejores que aquellos proporcionados por la radioterapia.
Con el aumento del conocimiento en la biología tumoral, y extrapolando de hallazgos encontrados en el tratamiento de otros tumores, en los 90s diferentes estudios evaluaron el rol de la quimioradioterapia concurrente, pues ya se sabía que algunos agentes quimioterapéuticos permitían una radiosensibilización de las células tumorales (46).
De acuerdo con lo anterior, y posterior a la realización de diversos ensayos clínicos, varios meta-análisis fueron publicados, en los cuales se encontró un beneficio estadísticamente significativo del uso de quimioradioterapia concurrente sobre el uso de radioterapia sola, principalmente en los escenarios de enfermedad locoregional resecable, pero también en otros estadios de la enfermedad (47,48).
Nacimiento de la terapia dirigida en el cáncer de cabeza y cuello
En diferentes cánceres de origen epitelial, las mutaciones driver en el gen del receptor del factor de crecimiento epidérmico han mostrado ser críticas en el desarrollo de la malignidad, además de muchas veces asociarse con una enfermedad más agresiva y de peor pronóstico. Esto se ha evidenciado no sólo en el CCyC, sino también en tumores como el cáncer de colon y recto y el cáncer de pulmón de célula no pequeña (49,50). Mendelsohn et al fueron pioneros en considerar el bloqueo de este receptor como una posible alternativa terapéutica.
Hasta la fecha, cetuximab, un anticuerpo monoclonal tipo IgG1 quimérico dirigido contra EGFR es el único agente que ha demostrado una mejor sobrevida en pacientes con CCyC de tipo escamocelular, en combinación con radioterapia vs radioterapia sola (51) y combinación con quimioterapia a base de platinos (52).
Panitumumab, un anticuerpo monoclonal totalmente humano dirigido contra EGFR no demostró mejoría en la sobrevida de los pacientes con CCyC, al igual que otros agentes dirigidos como los inhibidores de tirosina quinasa gefitinib, erlotinib y afatinib (53).
A pesar de los resultados positivos con cetuximab, la tasa de respuesta total en el escenario clínico de CCyC resistente o metastásico es de solo el 13% con una mediana de sobrevida libre de progresión (PFS) de 2,3 meses como agente único, y de 2,8 meses en combinación con quimioterapia (52,54).
Diferentes estrategias se han utilizado para estudiar la presencia de biomarcadores genéticos y moleculares que pudieran predecir la respuesta a cetuximab, o marcadores de resistencia que de ser bloqueados mejoraran los resultados con este medicamento.
Algunas de las mutaciones susceptibles de inhibición del EGFR en tumores como el cáncer de pulmón de célula no pequeña han sido evaluados también en el CCyC, sin embargo, este tipo de alteraciones no fueron encontradas (55).
Diferentes estrategias se encuentran en estudio actualmente para evaluar agentes que puedan generar un bypass de los mecanismos de resistencia existentes, sin embargo, a la fecha ninguno ha demostrado algún tipo de beneficio (56).
Gracias al proyecto del “The Cancer Genome Atlas”55, múltiples vías de señalización alteradas se pudieron evidenciar en las muestras de pacientes con CCyC. Estas alteraciones obedecen a 6 principales vías de señalización: 1 Vías mediadas por receptores de tirosina quinasa, 2 Vía de las MAPK, 3 Vía PI3K/ AKT/mTOR, 4 Vía del ciclo celular, 5 Vía de la reparación del DNA y 6 Vías epigenéticas (56). Dentro de estas alteraciones se encuentran genes como: FGF1-3, HER2, IGF-1R, HRAS, PIK3CA, PTEN, CDKN2A, CCND1, CDK6, PARP, ATR, KMT2C, KMT2D, ARID1A y NSD1.
Inhibición del checkpoint inmunológico en el cáncer de cabeza y cuello
El premio Nobel del 2018 fue otorgado a los doctores Jim Alisson y Tasuku Honjo por sus descubrimientos relacionados con el checkpoint inmunológico y su papel en la evasión al sistema inmune mediada por algunos tumores. CTLA-4 y PD1 son receptores en los linfocitos T que cuando son estimulados inducen una inactivación de estos.
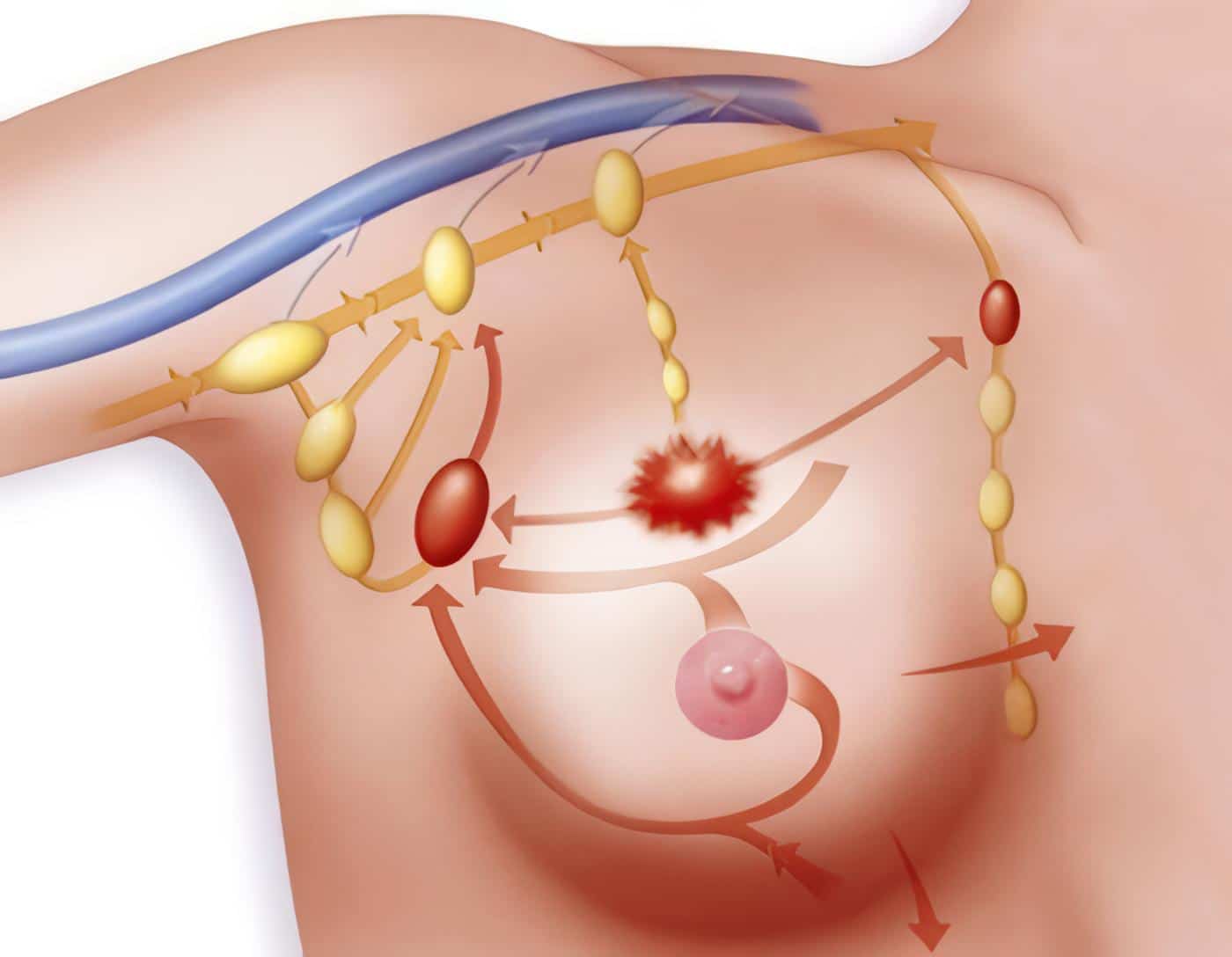
Basado en lo anterior, aquellos tumores con altos niveles de expresión de las moléculas PD-L1 (ligando para PD1) y B7-1/ B7-2 (ligando para CTLA4) parecieran depender de la evasión tumoral como principal hallmark en su proceso de oncogénesis, lo que hipotéticamente los haría más susceptibles a la inhibición de esta vía. Un esquema de la vía de señalización de la interacción PD1/PD-L1 se detalla en la figura 4.
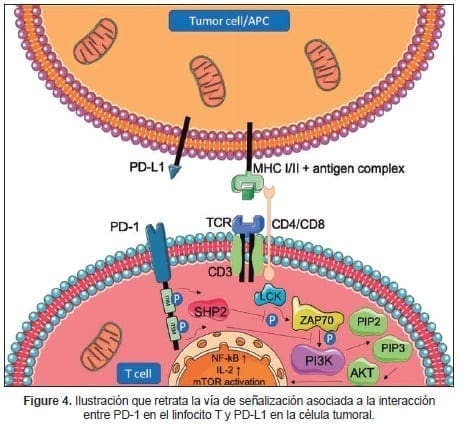
Esta hipótesis fue rápidamente confirmada en múltiples estudios realizados en diversos tumores incluyendo cáncer de pulmón, el melanoma y el cáncer de células renales (57). Un meta-análisis publicado en la revista Oral Oncology, evaluó la eficacia de la inhibición del checkpoint inmunológico en el tratamiento del CCyC de tipo escamoso.
Los autores encontraron 8 estudios diferentes, de los cuales dos correspondían a ensayos clínicos aleatorizados, en los cuales se demostró que el uso de nivolumab (anti- PD1) y pembrolizumab (anti-PD1) mostró una diferencia estadísticamente significativa en la sobrevida con respecto a la terapia estándar en los pacientes con enfermedad avanzada (58).
El estudio KEYNOTE-048, un ensayo clínico de fase III que evaluó la eficacia del uso de pembrolizumab como monoterapia vs pembrolizumab + quimioterapia vs quimioterapia + cetuximab en el escenario de CCyC escamocelular recurrente o metastásico. El brazo de pacientes que recibieron pembrolizumab en monoterapia, tuvo una mediana de sobrevida de 14,9 meses vs 10,7 meses de los pacientes que recibieron quimioterapia + cetuximab (p = 0.0007) (59).
El estudio CheckMate 141 encontró también beneficios con el uso de Nivolumab en el escenario de enfermedad resistente a primera línea de quimioterapia basada en platinos.
Los autores compararon la sobrevida global de pacientes con CCyC que recibieron nivolumab como monoterapia vs pacientes que recibieron una de las siguientes: metotrexate, docetaxel o cetuximab. La mediana de sobrevida en el grupo de Nivolumab fue de 7,5 meses, mientras que la de los grupos que recibieron terapia estándar fue de 5,1 meses (p = 0,01) (60).
El estudio KEYNOTE-040 que evaluó la eficacia del uso de pembrolizumab como monoterapia vs uno de los siguientes: metotrexate, docetaxel y cetuximab, en el escenario de enfermedad resistente o metastásica. Los investigadores encontraron una mediana de sobrevida en el grupo de pembrolizumab de 8,4 meses, y de 6,9 meses en el grupo de cuidado estándar (p = 0,0161) (61).
(Lea También: Melanoma: Más Allá de la Historia)
Nuevas terapias en desarrollo
En las últimas tres décadas, la biología molecular ha avanzado a pasos agigantados, logrando el desarrollo de herramientas tales como CRISPR/Cas9 (62), la reprogramación celular y la modificación genética de células autólogas de pacientes con cáncer para usarse como terapia celular, además de otros enfoques terapéuticos del cáncer como la nanomedicina y las “vacunas” del cáncer.
En el caso de CRISPR/ Cas y otros mecanismos de edición genética (terapia génica), diferentes estudios in vitro y ensayos clínicos en fases iniciales se han realizado para evaluar la restauración de genes supresores tumorales (63) (principalmente TP53) que se encuentren truncados o que hayan sufrido deleción durante la oncogénesis (64,65).
El uso de células T con receptor quimérico para el antígeno (células CAR-T) fue un descubrimiento revolucionario para el tratamiento de malignidades hematológicas refractarias a varias líneas de tratamiento, incluyendo el trasplante de progenitores hematopoyéticos, en el manejo de linfoma difuso de células B grandes y de la leucemia linfoblástica aguda.
Sus resultados demostraron indiscutiblemente su efectividad en el tratamiento de estos pacientes (66,67). Las células CAR-T tienen la capacidad de dirigir toda una respuesta inmune adaptativa celular tanto de linfocitos T CD8+ como de linfocitos T CD4+, dirigida contra aquellas células que expresen en su membrana alguna molécula particular, en el caso de los linfomas y las leucemias, es CD19, antígeno exclusivo de los linfocitos B.
Este enfoque en los tumores sólidos es mucho más complejo de aplicar, pues muchas veces no existen antígenos restringidos al tumor, o cuando estos existen suelen ser intracelular y no expresados en la membrana de la célula. Algunos antígenos candidatos a este tipo de terapia son: MUC1 y ligandos promiscuos del tipo ErbB (68-70).
Conclusión
La historia del CCyC resulta fascinante, al igual que la de los diferentes tipos de tumores. Es de resaltar la persistencia a lo largo de miles de años, en que los académicos han permanecido curiosos e inquietos por entender mejor estas enfermedades y encontrar una solución.
La mayoría de los avances históricos en el tratamiento del CCyC se realizaron en los últimos trecientos años, pero los incrementos más sustanciales en la sobrevida de los pacientes sin duda se han logrado tan sólo en las últimas 4-5 décadas, todo gracias a los avances en biología molecular, al descubrimiento de la estructura del DNA, al proyecta genoma humano y por supuesto al Atlas del Genoma del Cáncer (TCGA).
En los años por venir se esperan muchos avances, cada vez más fundamentados en terapias moleculares, que se caracterizan por ser más específicas, más efectivas y con menos eventos adversos.
Agradecimientos
Quisiera agradecer especialmente a los doctores Henry Idrobo y Andrés Felipe Cardona, quienes, desde su experiencia en la oncología y la investigación, han servido como guías y mentores, aportando significativamente al futuro talento humano en oncología del país, dejando un legado en todos los que hemos tenido la oportunidad de aprender de ellos.
Referencias
-
1. Chow LQM. Head and Neck Cancer. N Engl J Med 2020; 382:60–72.
-
2. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394–424.
-
3. ACKERKNECHT EH. Historical notes on cancer. Med Hist. 1958;2:114–119.
-
4. Moodie RL. Tumors of the head among the pre-Columbian Peruvians. Ann Med Hist. 1926;8:394–412.
-
5. Bernal JE, Briceno I. Genetic and other diseases in the pottery of Tumaco-La Tolita culture in Colombia- Ecuador. Clin Genet. 2006;70:188–191.
-
6. Bhikha R, Glynn J. The theory of humours revisited. Int J Dev Res. 2017;7:15029–15034.
-
7. Hajdu SI. A note from history: Landmarks in history of cancer, part 1. Cancer. 2011;117:1097–1102.
-
8. di Lonardo A, Nasi S, Pulciani S. Cancer: We should not forget the past. J. Cancer. 2015;6:29–39.
-
9. Lukong KE. Understanding breast cancer – The long and winding road. BBA Clin. 2017;7:64–77.
-
10. Natale G, Bocci G, Ribatti D. Scholars and scientists in the history of the lymphatic system. J. Anat. 2017;231:417–429.
-
11. Shedd DP. The Work of Henry T. Butlin, an Early Head and Neck Surgeon. Am J Surg. 1997;173:234–236.
-
12. Inchingolo F, Santacroce L, Ballini A, Topi S, Dipalma G, Haxhirexha K et al. Oral Cancer: A Historical Review. Int J Environ Res Public Health. 2020;17:3168.
-
13. McGurk M, Goodger NM. Head and neck cancer and its treatment: historical review. Br J Oral Maxillofac Surg . 2000;38:209–220.
-
14. Martin HE. The history of lingual cancer. Am J Surg. 1940;48:703–716.
-
15. Redmond DE. Tobacco and Cancer: The First Clinical Report, 1761. N Engl J Med. 1970;282:18–23.
-
16. von Soemmerring ST. De Morbis vasorum absorbentium corporis humani… Varrentrapp et Wenneri, 1795.
-
17. Pott P. The chirurgical works of Percivall Pott, F.R.S., surgeon to St. Bartholomew’s Hospital, a new edition, with his last corrections. 1808. Clin Orthop Relat Res. 2002;:4–10.
-
18. Marchetti P. Observationum medico-chirurgicarum rariorum sylloge. Cadorinis, 1737.
-
19. Louis A. Memoire physiologique et pathologique sur la langue. 1770.
-
20. Absolon KB, Rogers W, Aust JB. Some historical developments of the surgical therapy of tongue cancer from the seventeenth to the nineteenth century. Am J Surg. 1962;104:686–691.
-
21. Middeldorpf AT. Die Galvano caustik ein Beitrag zur operativen Medicin. Josef Max & Comp., 1854.
-
22. Maisoneuve M. Sur un cas d’extirpation presque totale de la langue au moyen de la cauterisation en flesches. J Compt Rend Acad Sc. 1863;57: 831.
-
23. Billroth T. Osteoplastiche Resectionen des Unterkiefers nach Eigener Methode. Arch Klin Chri . 1862;2:651–657.
-
24. Stell PM. History of surgery of the upper jaw. Tumours Up jaw Edinburgh Ed Churchill Livingstone 1993;:1–15.
-
25. Garcia M. IV. Observations on the human voice. Proc R Soc London 1856;:399–410.
-
26. Sir Morell Mackenzie (1837–1892). Nature. 1937;140:16.
-
27. Stevenson RS, Guthrie D. A history of oto-laryngology. E. & S. Livingstone, 1949.
-
28. Thomson SC. Cancer of the Larynx. Laryngoscope. 1921;31:522–527.
-
29. Thomson S. The history of cancer of the larynx. J Laryngol Otol . 1939;54:61–87.
-
30. Stell PM. The first laryngectomy. J Laryngol Otol . 1975;89:353–358.
-
31. Röntgen WC. Über eine neue Art von Strahlen. Sitzungsberichte der Physik.-Med. Gesellschaft zu Würzbg . 1895;137:132–141.
-
32. Dunn PM. Wilhelm Conrad Röentgen (1845-1923), the discovery of x rays and perinatal diagnosis. Arch. Dis. Child. Fetal Neonatal Ed. 2001;84(2):F138-9.
-
33. Radvanyi P, Villain J. La découverte de la radioactivité. Comptes Rendus Phys. 2017;18:544–550.
-
34. Paterson R, Parker HM. A Dosage System for Gamma Ray Therapy. Br J Radiol 1934;7:592–632.
-
35. Coutard H. Roentgentherapie des epitheliomas de la region amygdalienne, de l’hypopharynx et du larynx au cours des annees 1920 a 1926. Radiophys et radiothérapie . 1932;2:11–27.
-
36. Duane W. Methods of preparing and using radioactive substances in the treatment of malignant disease, and of estimating suitable dosages. Bost Med Surg J. 1917;177:787–799.
-
37. Dominici H. Du traitement des tumeurs malignes par le rayonnement ultrapénétrant du radium. Bull Cancer. 1908;1:124–156.
-
38. Butlin HT. The hunterian lecture on what operation can do for cancer of the tongue. Br Med J. 1898;1:541– 544.
-
39. Butlin HT. On the Early Diagnosis of Cancer of the Tongue, and on the Results of Operations in Such Cases. Br Med J. 1909;1:462–463.
-
40. Crile G. Excision of cancer of the head and neck: With special reference to the plan of dissection based on one hundred and thirty-two operations. J Am Med Assoc .1906;XLVII:1780–1786.
-
41. Watne AL. Treatment alternatives: Head and neck cancers. Cancer . 1984;54:2673–2681.
-
42. Hong WK, Bromer R. Chemotherapy in Head and Neck Cancer. N Engl J Med. 1983;308:75–79.
-
43. Levitt M, Mosher MB, DeConti RC, Farber LR, Skeel RT, Marsh JC et al. Improved therapeutic index of methotrexate with ‘leucovorin rescue’. Cancer Res. 1973;33:1729–1734.
-
44. Baker SR, Makuch RW, Wolf GT. Preoperative Cisplatin and Bleomycin Therapy in Head and Neck Squamous Carcinoma: Prognostic Factors for Tumor Response. Arch Otolaryngol . 1981;107:683–689.
-
45. Laramore GE, Scott CB, Al-Sarraf M, Haselow RE, Ervin TJ, Wheeler R et al. Adjuvant chemotherapy for resectable squamous cell carcinomas of the head and neck: Report of intergroup study 0034. Int J Radiat Oncol Biol Phys . 1992;23:705–713.
-
46. Cognetti DM, Weber RS, Lai SY. Head and neck Cancer an evolving treatment paradigm. Cancer. 2008;113:1911–1932.
-
47. Pignon JP, Bourhis J, Domenge C, Designé L. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma: three metaanalyses of updated individual data. MACH-NC Collaborative Group. Meta-Analysis of Chemotherapy on Head and Neck Cancer. Lancet. 2000;355:949–955.
-
48. Baujat B, Audry H, Bourhis J, Chan ATC, Onat H, Chua DTT et al. Chemotherapy in locally advanced nasopharyngeal carcinoma: an individual patient data meta-analysis of eight randomized trials and 1753 patients. Int J Radiat Oncol Biol Phys. 2006;64:47–56.
-
49. Krasinskas AM. EGFR Signaling in Colorectal Carcinoma. Patholog Res Int . 2011;2011:1–6.
-
50. Fernández-Trujillo L, Garcia-Robledo JE, Zúñiga- Restrepo V, Sua LF. Clinical characteristics and PDL1 expression in primary lung squamous cell carcinoma: A case series. Respir Med Case Reports . 2020;30:101114.
-
51. Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 2006;354:567–78.
-
52. Vermorken JB, Mesia R, Rivera F, Remenar E, Kawecki A, Rottey S et al. Platinum-Based Chemotherapy plus Cetuximab in Head and Neck Cancer. N Engl J Med. 2008;359:1116–1127.
-
53. Soulieres D, Senzer NN, Vokes EE, Hidalgo M, Agarvala SS, Siu LL. Multicenter phase II study of erlotinib, an oral epidermal growth factor receptor tyrosine kinase inhibitor, in patients with recurrent or metastatic squamous cell cancer of the head and neck. J Clin Oncol. 2004;22:77–85.
-
54. Vermorken JB, Trigo J, Hitt R, Koralewski P, Diaz- Rubio E, Rolland F et al. Open-label, uncontrolled, multicenter phase II study to evaluate the efficacy and toxicity of cetuximab as a single agent in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck who failed to respond to platinum-based therapy. J Clin Oncol. 2007;25:2171– 2177.
-
55. Lawrence MS, Sougnez C, Lichtenstein L, Cibulskis K, Lander E, Gabriel SB et al. Comprehensive genomic characterization of head and neck squamous cell carcinomas. Nature. 2015;517:576–582.
-
56. Gougis P, Bachelard CM, Kamal M, Gan HK, Borcoman E, Torossian N et al. Clinical development of molecular targeted therapy in head and neck squamous cell carcinoma. JNCI Cancer Spectr. 2019;3(4):pkz055
-
57. Beltran E, Garcia-Robledo JE, Rodríguez-Rojas LX, Rengifo M, Perez B, Pachajoa H et al. Clear cell renal carcinoma synchronous with dedifferentiated liposarcoma: a case report and review of the literature. J Med Case Rep. 2020;14(1):4.
-
58. Ghanizada M, Jakobsen KK, Grønhøj C, von Buchwald C. The effects of checkpoint inhibition on head and neck squamous cell carcinoma: A systematic review. Oral Oncol. 2019;90:67–73.
-
59. Burtness B, Harrington KJ, Greil R, Soulières D, Tahara M, de Castro G et al. Pembrolizumab alone or with chemotherapy vs. cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet .2019;394:1915– 1928.
-
60. Ferris RL, Blumenschein G, Fayette J, Guigay J, Colevas AD, Licitra L et al. Nivolumab for Recurrent Squamous- Cell Carcinoma of the Head and Neck. N Engl J Med. 2016;375:1856–1867.
-
61. Cohen EEW, Soulières D, Le Tourneau C, Dinis J, Licitra L, Ahn MJ et al. Pembrolizumab vs. methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE- 040): a randomised, open-label, phase 3 study. Lancet. 2019;393:156–167.
-
62. Garcia-Robledo JE, Barrera MC, Tobón GJ. CRISPR/ Cas: from adaptive immune system in prokaryotes to therapeutic weapon against immune-related diseases. Int Rev Immunol . 2020;39:11–20.
-
63. Birkeland A, Ludwig ML, Spector ME, Brenner JC. The potential for tumor suppressor gene therapy in head and neck cancer. Discov Med 2016;21:41.
-
64. Liu S, Chen P, Hu M, Tao Y, Chen L, Liu H et al. Randomized, controlled phase II study of post-surgery radiotherapy combined with recombinant adenoviral human p53 gene therapy in treatment of oral cancer. Cancer Gene Ther. 2013;20:375–378.
-
65. Yoo GH, Moon J, LeBlanc M, Lonardo F, Urba S, Kim H et al. A phase 2 trial of surgery with perioperative INGN 201 (Ad5CMV-p53) gene therapy followed by chemoradiotherapy for advanced, resectable squamous cell carcinoma of the oral cavity, oropharynx, hypopharynx, and larynx: Report of the southwest oncology group. Arch Otolaryngol – Head Neck Surg. 2009;135:869–874.
-
66. Anagnostou T, Riaz IB, Hashmi SK, Murad MH, Kenderian SS. Anti-CD19 chimeric antigen receptor T-cell therapy in acute lymphocytic leukaemia: a systematic review and meta-analysis. Lancet Haematol . 2020;7:e816–e826.
-
67. Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. 2017;377:2531–2544.
-
68. Mei Z, Zhang K, Lam AKY, Huang J, Qiu F, Qiao B et al. MUC1 as a target for CAR-T therapy in head and neck squamous cell carinoma. Cancer Med. 2020;9:640–652.
-
69. Wang S, Zhu Z. Enhanced chimeric antigen receptor T-cell therapy: A novel approach for head and neck cancers. Oral Dis. 2019;25:355–356.
-
70. Papa S, Adami A, Metoudi M, Achkova D, van Schalkwyk M, Parente Pereira A et al. A phase I trial of T4 CAR T-cell immunotherapy in head and neck squamous cancer (HNSCC). J Clin Oncol . 2018;36:3046– 3046.
Recibido: Noviembre 10, 2020
Aceptado: Diciembre 02, 2020
Correspondencia:
Juan Esteban Garcia-Robledo
juanesmd23@gmail.com