El descubrimiento de los estrógenos (estriol, estrona y estradiol) a partir de orina de mujeres embarazadas por Butenandt y Doisy (16). Proporcionó el ímpetu para comprender mejor la estructura, biosíntesis, secreción y función de los diversos estrógenos.
Durante las décadas siguientes:
Se acumularon observaciones de que una pequeña cantidad de estas hormonas podría causar un crecimiento profundo de diversos tejido diana. Los estrógenos están involucrados en una gran cantidad de procesos fisiológicos del cuerpo, así como también están relacionados con algunas patologías (30) MER-25 (ethamoxytriphetol. Por lo tanto, está claro que la esteroidogénesis ovárica tiene gran importancia en el desarrollo normal de la mama y en la génesis del CM (31).
Como hemos visto, el vínculo entre los estrógenos y el crecimiento y desarrollo del CM se ha reconocido durante más de un siglo, y la dependencia del CM en la acción estrogénica se reconoció por primera vez mediante la regresión inducida por la ooforectomía bilateral en mujeres premenopáusicas (13). Posteriormente, se correlacionó la función ovárica con la producción de estrógenos y el aislamiento de la proteína receptora de estrógenos, combinado con una mayor incidencia de tumores con receptores de estrógeno (RE) positivos en mujeres posmenopáusicas.
A su vez, esto condujo a la identificación de una fuerte asociación entre la dosis de estrógeno y la duración de la exposición a este con un mayor riesgo de CM (31). Es por lo tanto lógico que el siguiente paso histórico haya sido la identificación de fármacos que actuaran sobre los estrógenos y sus receptores como tratamiento del CM.
Tratamientos ablativos hormonales
Probablemente uno de los éxitos más importantes en el tratamiento del CM avanzado a principios del siglo XX fue la alteración del entorno endocrino interno tumoral a través de la terapia hormonal. El fundamento de este tratamiento es la dependencia bien demostrada de la mama a la estimulación hormonal (21).
Los primeros intentos de alterar el curso del CM en el ser humano mediante la administración de hormonas sexuales fueron ambiguos (32). En 1935, Haddow et al. observaron que algunos hidrocarburos cancerígenos con una ligera actividad estrogénica retardaban el crecimiento de los carcinomas mamarios, por lo que iniciaron ensayos terapéuticos con los propios estrógenos en el tratamiento del CM avanzado (21,32).
El primer informe clínico del uso de andrógenos en el CM metastásico fue:
El de Ulrich y Loeser en 1939, que describieron el uso de propionato de testosterona para tratar el CM avanzado (33). La administración de esteroides androgénicamente activos a mujeres con CM avanzado se volvió una práctica común en ese entonces: se administraban 100 mg intramusculares de manera trisemanal, con lo que se lograban tasas de respuesta del 20-25%, con una mejoría en el control de síntomas del 50% (21,34,35). Los andrógenos podían utilizarse tanto en el período premenopaúsico como en el posmenopáusico; y los estrógenos solo en pacientes posmenopáusicas.
A mediados de los años 1940’s, y de manera paradójica, los estrógenos también formaban parte del arsenal del tratamiento del CM, principalmente para aquellas pacientes con lesiones en tejidos blandos (12).
Los primeros estudios realizados fueron con estrógenos sintéticos no esteroideos en dosis altas, como el etinilestradiol y dietilestilbestrol (DES)16 con lo que se lograba regresión tumoral hasta en un 20% de los casos, aunque a costa de una alta toxicidad (36).
Desafortunadamente, las pacientes que tenían una respuesta inicial favorable, eventualmente tenían un recrudecimiento del proceso de la enfermedad en meses o años (32). En la actualidad ambas terapias están proscritas.
Desarrollo temprano de antiestrógenos y eficacia en el tratamiento del CM
El descubrimiento de hormonas estrogénicas producidas en el ovario por Edgar Allen y Edward Doisy en 1923 (37) impulsó la búsqueda de un antagonista terapéutico para reducir la incidencia de CM en individuos predispuestos a la enfermedad por su sensibilidad a las hormonas estrogénicas. Los primeros antiestrógenos no esteroideos MER-25 y clomifeno, fueron sintetizados como reguladores de la fertilidad en pacientes con anovulación, y posteriormente se descubrió su utilidad en otras patologías como el CM (16,30).
Leonard Lerner
En 1958, Leonard Lerner et al (38) publicaron un artículo de referencia sobre las propiedades farmacológicas del primer antiestrógeno no esteroideo, el etamoxitrifetol (MER-25). Este compuesto fue descubierto de forma serendípica al encontrarse que tenía una estructura similar a la de los estrógenos (trifeniletileno), y que tenía una acción antiestrogénica débil pero constante en todos los modelos animales (39).
Los doctores Roy Hertz de los Institutos Nacionales de Salud de los Estados Unidos (NIH) y Robert Kintner de la Universidad de Harvard, fueron los primeros en investigar su utilidad en el tratamiento de CM con resultados alentadores. Sin embargo, los estudios clínicos posteriores demostraron que el fármaco era demasiado tóxico para el uso general (causando alucinaciones, episodios psicóticos, pesadillas y alteraciones del sueño entre otros) (30).
Posteriormente, se descubrió que un compuesto sucesor, el clomifeno (una mezcla de isómeros geométricos estrogénicos y antiestrogénicos de un trifeniletileno) también era inductor de la ovulación en mujeres subfértiles (38).
En 1964, Herbst y colaboradores (40) demostraron que el citrato de clomifeno podría tener eficacia en pacientes con CM. Sin embargo, la evaluación clínica de estos compuestos para esas indicaciones nunca se llevó a cabo debido a la concentración del esfuerzo en el uso de clomifeno en la inducción de la ovulación en mujeres infértiles anovulatorias (30).
En 1960, se patentó trifeniletileno como una terapia anti-CM, siendo la nafoxidina, uno de sus derivados, la base estructural del lasofoxifeno, el primer modulador selectivo del RE. Posteriormente, se descubriría el tamoxifeno como base fundamental de la terapia hormonal en mujeres con CM (39).
Descubrimiento del receptor de estrógeno – métodos de identificación y tipos de ensayo
A partir de la observación de que la cantidad de estrógeno requerida para su actividad fisiológica era mínima, Edward Jensen intuyó que probablemente influenciaba la reacción de numerosas moléculas que participaban en los fenómenos metabólicos (41) y observó la naturaleza temporal de la respuesta estrogénica, y la ausencia de oxidación de estradiol a estrona en vivo, es decir, el ejercicio de su actividad sin transformación metabólica (42).
En 1960, junto con Jacobson, utilizando estradiol marcado con radio-isótopos, demostraron la absorción específica del mismo en el útero y la vagina de ratones castrados (22,43,44).
Trabajos subsecuentes por Noteboom y Gorski demostraron que el sitio de unión era estereoespecífico y que podría tratarse de una proteína con actividad de nucleotidasa, de unión reversible (45) y más adelante, Toft y Gorski aislarían una macromolécula con las características esperadas en un receptor (46). En 1980, Jensen y Green produjeron anticuerpos monoclonales para determinar la existencia de proteínas receptoras de unión a estrógeno intracelulares (47) y más adelante, King utilizó dichos anticuerpos en tejido congelado de humanos donde observó tinción específica nuclear (48).
En 1986 el grupo liderado por Chambon logró clonar el gen del RE (49) y, utilizando estudios de mutagénesis, encontraron que el receptor consta de dominios de unión a DNA que contienen motivos dedos de zinc y dominios de unión a ligando (50), elementos estructurales clave de los factores de transcripción dependientes de ligando (51).
Y en 1966, un segundo RE fue identificado por Gustafsson y colaboradores.
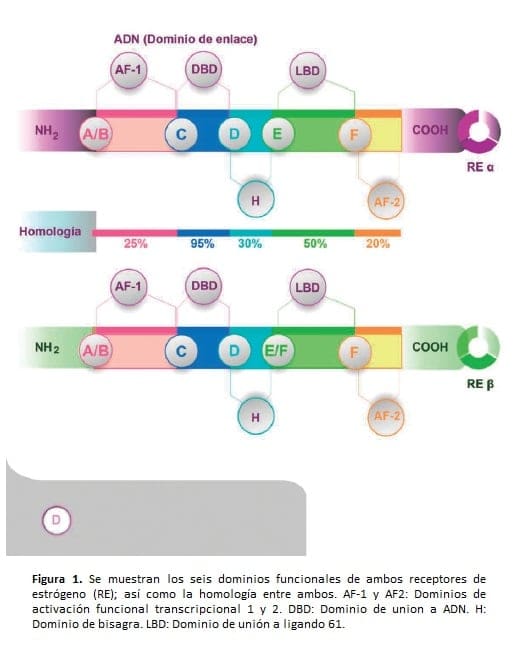
Este RE se expresaba predominantemente en células epiteliales de testículo y ovario y era homólogo al RE previamente descubierto en ciertas regiones (52). El primero fue renombrado como REα y este último fue denominado Reβ (Figura 1) (51).
En CM, el grupo de Jensen determinó que el consumo de estradiol era mayor que el detectado en el tejido mamario normal y que era posible determinar la expresión de RE en el tejido neoplásico, la cual es de predominio nuclear. Con ello definieron dos subtipos de tumores mamarios: RE positivos y RE negativos (53).
Posteriormente, junto con otros grupos, observaron que medir la cantidad de receptor en el tumor (evaluado en la mastectomía), podía ayudar a predecir la respuesta a tratamientos hormonales y la recurrencia (54–58), para lo cual propusieron dos tipos de inmunoensayos (22): 1) Enzimático: mide la cantidad de receptor en el citosol, cuantificada a través de colorimetría usando una curva estandarizada; 2) Inmunocitoquímico: Usa cortes de micras de espesor del tumor, a los que se les aplica el método de peroxidasa-antiperoxidasa, con el cual se tiñe el núcleo de las células donde se localiza el receptor. Este último es el más utilizado en la actualidad.
Con lo anterior, fue posible identificar mejor a las pacientes que se beneficiarían de terapia hormonal y a su vez, disminuir tratamientos innecesarios a aquellas que no obtendrían ningún beneficio (59, 60).
Mecanismo de acción de los estrógenos
Ambos receptores de estrógeno (REα y REβ), pertenecen a la superfamilia de receptores nucleares.
Contienen seis dominios funcionales: amino terminal (A/B), de unión a ADN (C), de bisagra (D), de unión a ligando (E) y carboxi-terminal (F); ambos receptores son homólogos en los dominios C y E pero divergen en A/B, D y F (Figura 1). REα se expresa mayormente en útero e hipófisis y en menor cantidad en hígado, hipotálamo, hueso, glándula mamaria, cérvix y vagina (29).
A pesar de que la descripción del descubrimiento de todas las vías de señalización del RE está fuera del ámbito de este artículo, un esquema detallado de los principales mecanismos de acción del RE se muestra en la Figura 2.
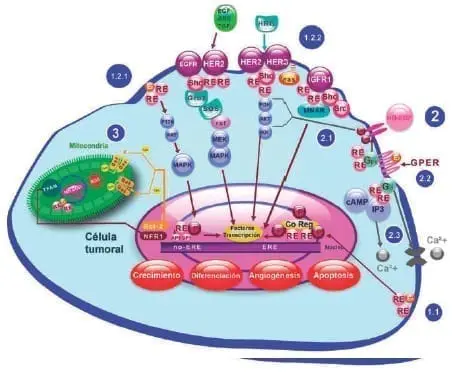
Figura 2. Resumen de las vías de señalización del receptor de estrógeno (RE) descubiertas hasta el momento.
1) Vía genómica (nuclear): 1.1) Clásica: En esta vía el estrógeno se une al receptor para promover su dimerización y fosforilación (65), lo que permite la unión del complejo “ligando-RE” con co-reguladores esteroideos (Co Reg) y elementos de respuesta a estrógenos (ERE). 1.2) Vía alterna:
1.2.1) Independiente de ERE: El complejo “ligando-RE” interactúa con otros factores de transcripción como la Proteína Activadora 1 (AP1) y la Proteína Específica 1 (SP1) (66).
1.2.2) Independiente de ligando: Mediada por factores de crecimiento (EGFR, HER2, y receptor de factor de crecimiento similar a la insulina tipo 1 (IGFR1)), que activan cascadas de proteínas cinasas (Ras-ERK; PI3K-Akt)66. Todas finalizan con cambios en la transcripción génica que regulan el crecimiento, diferenciación, apoptosis y angiogénesis celular; acciones moduladas por la estructura del ligando, el subtipo de receptor e isoforma, el gen promotor y el balance de co-activadores y co-represores (67,68).
2)Vía no genómica (citosólica) (69): Comienza con la union del ligando al Receptor de Estrógeno Unido a Proteina G (GPER) que lleva a la liberación de las subunidades α y βγ de proteínas G heterotriméricas.
2.1) Activación de cascadas de proteínas cinasas: La subunidad βγ activa metaloproteasas de matriz que liberan el EGF unido a Heparina, el cual es autofosforilado al unirse a su receptor, que activa las MAP cinasas Erk1/2 (induce transcripción de c-fos, Egr-1, ERRα y aromatase en el núcleo) y PI3K (fosforila la cinasa Akt que fosforila a su vez al factor de transcripción FOXO3a en el núcleo).
2.2) Activación de ciclina de Adenosin Monofosfato(cAMP): La subunidad α activa Adenolil Ciclasa en el citosol, que genera cAMP, el cual activa la Proteína Cinasa A que fosfolila a la proteína elemento de respuesta de unión con cAMP (CREB) que modifica la expresión de ciertas proteínas (Ej. Ciclina D1, que promueve el progreso del ciclo celular).
2.3) Activación de vías de calcio: La liberación de la subunidad α de proteínas G heterotriméricas activa la Fosfolipasa C, que une Fosfatidilinositol 4,5-bifosfato a diacilglicerol e IP3. Este último libera calcio, el cual activa diversas enzimas en el citosol y activa Erk1/2. La unión de estrógenos a GPER también facilita la apertura de canales L de calcio en la membrana citoplásmica.
3) Interacción núcleo-mitocondria: La transcripción nuclear de NRF1(Factor Respiratorio Nuclear 1) promueve la transcripción del factor mitocondrial TFAM (Factor FA de Mantenimiento del ADN mitocondrial) que a su vez regula genes codificados en el mtADN (70). En algunas células, RE interactúa con el loop-D del mtADN, lo que incrementa directamente la actividad de la enzima recolectora de ROS MnSOD (Manganasa-superóxido dismutasa) y del gen GPX1 (glutatión peroxidasa) que las protegen de apoptosis inducida por oxidación mediada por ROS (especies reactivas de oxígeno) (71).
La interacción también es indirecta, a través de las proteínas de la familia de Bcl2, que controlan la integridad de la membrana externa mitocondrial impidiendo la salida de Citocromo-C (clave para la apoptosis) (72). Los estrógenos protegen a la célula de la apoptosis al favorecer la transcripción de Bcl2 (73).
Aunque ambos receptores pueden encontrarse en el tejido mamario normal, REα sólo se encuentra en el núcleo de algunas células epiteliales y regula el crecimiento y la elongación ductal (62); además, se ha encontrado en 50-80% de los tumores mamarios y su expresión se correlaciona con factores de buen pronóstico (63); mientras que REβ se localiza en células epiteliales y estromales de la glándula mamaria normal y su expresión se ha visto disminuida en algunas neoplasias invasoras de esta región; además, algunos estudios sugieren que inhibe la función transactivadora de REα, lo que le confiere propiedades antiproliferativas y otros han asociado la expresión positiva del receptor en células neoplásicas con un pronóstico favorable; sin embargo, aún hace falta más investigación en esta área (64).
Desarrollo de modelo murino para la investigación de CM hormonodependiente
Gracias al trabajo de muchos investigadores que sentaron las bases (74-79), en 1958 Huggins presentó el primer modelo murino en el que era posible producir carcinomas mamarios en un período menor a 30 días al administrar 3-metilcolantrano (un compuesto aromático) a través del tracto gastrointestinal de ratas.
Con ello logró demostrar tres hitos en el estudio del CM: 1) la mayoría de los tumores producidos por este método eran hormono-dependientes (cuando se retiraba el soporte hormonal interno del animal, la mayoría de los tumores disminuían de tamaño, y esta disminución era debido a la atrofia de las células epiteliales y no a necrosis de las mismas; 2) la administración de dihidrotestosterona también producía atrofia en las células neoplásicas, mientras que inducía proliferación del tejido mamario no neoplásico; 3) existía un porcentaje bajo de tumores que continuaban creciendo a pesar del retiro de soporte hormonal, pero aún en estos se podían identificar áreas de atrofia coexistiendo con zonas de proliferación, por lo que no todas las células en un mismo tumor tenían la misma respuesta al tratamiento (80).
Estos hallazgos fueron de suma relevancia, ya que aunque el concepto de dependencia hormonal había sido establecido previamente en tumores provenientes de humanos, no había sido conseguido en modelos murinos; además, gracias a estos estudios fue que nació el concepto de terapia hormonal (81).
Desarrollo del tamoxifeno y actividad antitumoral
En los años setentas el tamoxifeno fue el primer antiestrógeno no esteroideo que representó un cambio radical en el tratamiento del CM. El compuesto ICI 46474 (tamoxifeno) se sintetizó por primera vez en 1963 como un medicamento anticonceptivo (82).
Sin embargo, por su efectos estrogénicos paradójicos también fue estudiado como un medicamento para tratar la infertilidad por sus efectos inductores de ovulación en mujeres con amenorrea secundaria (83).
Sin embargo, serendípicamente se descubrió que tenía un efecto antiestrogénico, ya que en estudios en ratas se encontró que la forma transisomérica del compuesto prevenía la implantación de embriones en el útero y causaba cornificación del epitelio vaginal como un efecto atípico al inhibir la respuesta de los estrógenos exógenos (82).
Estudios de laboratorio demostraron que, a nivel celular, el tamoxifeno se unía al RE citoplasmático pero que esto no provocaba síntesis de ADN a nivel nuclear actuando como un falso mensajero al bloquear la actividad del RE (84).
En ratas se encontró que dependiendo de la dosis y del tejido en el que actuaba podía tener efectos pro o antiestrogénicos: en el tejido mamario tenía un fuerte efecto antiestrogénico, mientras que en el epitelio uterino su efecto era proestrogénico (85). Más tarde, se confirmó que este efecto uterino aumentaba el riesgo de cáncer de endometrio en mujeres tratadas crónicamente con tamoxifeno (86).
Los efectos antitumorales del tamoxifeno:
Fueron descritos por V. Craig Jordan y colaboradores, al observar que prevenía la inducción y crecimiento de tumores mamarios inducidos por carcinógenos en ratas (87).
En 1969 se realizó el primer estudio con tamoxifeno en pacientes con CM recurrente, encontrando remisión hasta en el 22% de los casos (88). Posteriormente, se llevaron a cabo otros estudios que confirmaron su efectividad en pacientes con CM avanzado, utilizándose principalmente en el contexto paliativo (89).
Debido a su baja incidencia de efectos adversos, el estudio del tamoxifeno se extendió a etapas tempranas del CM, y con más de 30 mil pacientes incluidas en estudios aleatorizados se demostró una reducción de aproximadamente 25% en recaída y 17% en mortalidad en tumores con receptores hormonales positivos (90).
Más adelante, al observarse en los estudios en adyuvancia que el uso de tamoxifeno disminuía la aparición de tumores contralaterales (aunado a la prevención de carcinognénesis en estudios con ratones). Se llevaron a cabo estudios utilizando tamoxifeno en mujeres sin CM pero con alto riesgo de padecerlo, demostrándose una disminución en la incidencia de CM. Por lo que se convirtió en el primer tratamiento preventivo para cualquier tipo de cáncer, sentando los principios de la quimioprevención (91,92).
Desde su aprobación por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) en 1977, el tamoxifeno se ha utilizado para tratar a millones de mujeres y hombres con CM RH positivos, y sigue siendo tratamiento de elección en algunos escenarios.
A lo largo del tiempo ha demostrado tener efectos sobre la reducción de riesgo de aproximadamente 50% para recaída o aparición de nuevos tumores en pacientes con cáncer localizado (93). También se utiliza como tratamiento neoadyuvante antes de la cirugía o tratamiento primario en mujeres no candidatas a cirugía.
En el contexto metastásico ha demostrado tener un efecto en el crecimiento de la enfermedad, y adicionalmente. Ha demostrado capacidad para disminuir el riesgo de cáncer en mujeres con alto riesgo para desarrollar cáncer.
Descubrimiento de la aromatasa y producción extraglandular de estrógenos
Desde los años treintas se tenía evidencia de que la testosterona podía convertirse en “hormonas femeninas”, y el estudio de la síntesis de los estrógenos permitió identificar metabolitos precursores que a su vez llevaron al reconocimiento del proceso de aromatización (94).
Sin embargo, fue hasta los años ochenta cuando se logró la purificación de la enzima aromatasa, miembro de la familia citocromo P450, por Yoshio Owasa y colaboradores, y hasta el 2009 la cristalización de su estructura por Ghosh y colaboradores (95). Por otro lado, Paul MacDonald, Pentti Siiteri y colaboradores fueron los primeros en describir la actividad aromatasa extraglandular (94). Demostrando que el tejido adiposo era rico en aromatasa y la fuente principal de síntesis de estrógenos en mujeres posmenopaúsicas (96).
Además, estudios en mujeres posmenopáusicas mostraron que la conversión de androstendiona a estrógeno era mayor en sujetos con obesidad (97). Lo que más adelante fue de interés para investigadores como un blanco terapéutico tanto para el CM como para otras patologías como la infertilidad.
Desarrollo de inhibidores de aromatasa esteroideos y no esteroideos
En los años setentas, Harry y Angela Brodie probaron más de 100 inhibidores de aromatasa (IA) esteroideos. Lo que llevó a la identificación de la 1,4,6-androstatriendiona y la 4-hidroxi androstenediona (4-OH-A) como los candidatos más prominentes (98).
En colaboración con Charles Coombes, Paul Goss y Mitch Dowsett se lanzó el primer ensayo clínico con un IA selectivo (4-OH-A o formestano) para el tratamiento del CM en el Hospital Royal Marsden en Londres, Inglaterra, demostrándose su eficacia en pacientes que habían progresado al tratamiento con tamoxifeno (99).
Más adelante, se reconoció que el formestano no era lo suficientemente potente para bloquear a la aromatasa, y se buscaron inhibidores más potentes.
Con el reconocimiento de la inhibición de la aromatasa como un blanco importante para el tratamiento del CM. Varias compañías farmacéuticas contribuyeron con la identificación y el desarrollo clínico de inhibidores esteroideos y no esteroideos de la enzima aromatasa.
El primer agente de segunda generación fue el inhibidor CGS-16949A, fadrozole, que inhibía más eficazmente la producción de estrógenos pero inesperadamente tenía también efecto al bloquear a la aldosterona y nunca tuvo un uso clínico (100,101).
Posteriormente, gracias a estudios preclínicos en ratones y cultivos celulares de CM (MCF.7Ca), se desarrollaron dos inhibidores de tercera generación reversibles no esteroideos, el anastrazol y el letrozol, y un inhibidor esteroideo, el exemestano. Diversos estudios mostraron que estos IA eran más efectivos y con un efecto más prolongado para reducir el volumen de los tumores que el tamoxifeno (94).
Comparación entre los antiestrógenos y los IA
Estudios colaborativos, multicéntricos, multinacionales y aleatorizados que incluyeron alrededor de diez mil pacientes con CM. Compararon directamente la efectividad de los IA contra el tamoxifeno en pacientes con cáncer avanzado (102).
Todos demostraron superioridad en eficacia clínica, con un perfil de toxicidad distinto. Los IA se asociaron con un incremento en el riesgo de osteoporosis, osteopenia, artralgias y mialgias, mientras que el tamoxifeno se asoció con un mayor riesgo de trombosis venosa profunda y tromboembolia pulmonar.
Estos estudios colocaron a los IA como primera línea en el tratamiento del cáncer avanzado. Posteriormente, iniciaron los estudios en el contexto de enfermedad temprana con distintos diseños: comparación directa con tamoxifeno (ATAC, BIG-FEMTA), switch (MA-17, ABCSG-ARNO, BIG- 1-98) y en la neoadyuvancia.
En todos ellos también se demostró superioridad de los IA, y actualmente se consideran el tratamiento de primera elección para la adyuvancia en mujeres posmenopaúsicas (103). Recientemente, también se ha probado su eficacia en estudios de prevención para pacientes con alto riesgo de desarrollar cáncer (104).
(Lea También: Presente y Futuro del Tratamiento del CM)
Antagonistas del receptor de estrógeno (fulvestrant)
El desarrollo de moléculas pequeñas para el tratamiento del cáncer se ha enfocado en encontrar compuestos que ocupen sitios de unión que afectan de forma directa la unión de proteínas. Sin embargo, otra opción es la inducción de degradación de proteínas mediante la desestabilización de receptores (105).
Dado que los moduladores de los receptores de estrógenos pueden tener efectos diversos dependiendo de su sitio de acción. Este tipo de fármacos parece particularmente interesante para lograr la inhibición selectiva de estos receptores causando menos efectos adversos.
El descubrimiento de que la adición de un grupo decametileno en la posición 7α del estradiol podía generar un antiestrógeno puro sin inhibir la unión con el receptor. Llevó a la búsqueda de compuestos que carecieran de efectos sobre el endometrio, encontrándose así el ICI182780, ahora conocido como fulvestrant (106).
Estudios in vivo e in vitro demostraron que el fulvestrant tenía una potencia antiestrogénica incluso superior al tamoxifeno, y posteriormente los ensayos clínicos han demostrado que, en pacientes con CM avanzado, este compuesto tiene mayor tasa de beneficio clínico que otras hormonoterapias (107).
Cinasas dependientes de ciclinas y desarrollo del CM
La pérdida de control del ciclo celular es una de las principales características de las células malignas. En el CM en específico, el estudio del ciclo celular y de los diferentes puntos de control y vías de regulación ha llevado a entender algunos mecanismos de resistencia a la hormonoterapia.
A principios de los años noventa, estudios realizados en líneas celulares de CM detectaron la sobreexpresión de diversas ciclinas. Particularmente D1 y E1, así como una asociación entre esta sobreexpresión y los desenlaces negativos de los pacientes (108).
Estudios adicionales detectaron que hasta el 45% de las biopsias tumorales de mama expresaban altos niveles de mARN de Ciclina D1. Por lo que se consideró que esta unidad regulatoria del ciclo celular participaba de forma predominante en el control de la proliferación celular en CM (109).
Así mismo, se observó que uno de los factores más importantes para la oncogénesis en CM era la fosforilación de las cinasas dependientes de ciclinas (CDK) CDK4 y CDK6. Que a su vez tenía como consecuencia la activación de la proteína del retinoblastoma (Rb) (110).
Este fenómeno, acoplado a la desregulación de la expresión de ciclina D1, conducía a la progresión del ciclo celular y a la proliferación oncogénica (111).
Inhibidores de cinasas dependientes de Ciclina CDK 4/6
Los primeros intentos farmacológicos se centraron en generar inhibidores no específicos de CDK, también conocidos como inhibidores “pan-CDK”. El primero, y más estudiado, de dichos inhibidores fue el flavopiridol, que se utilizó en más de sesenta estudios en diferentes tipos de tumores (112). Sin embargo, los intentos iniciales fueron desalentadores. Ya que las tasas de respuesta in vivo no se correspondieron con el efecto in vitro.
La segunda generación de inhibidores se caracterizó por ser más específica, intentándose bloquear de forma selectiva algunas CDK, principalmente CDK1 y CDK2 (110). Dinaciclib, un inhibidor selectivo de CDK1, CDK2, CDK5 y CDK9, mostró beneficio en algunos tumores. Pero tuvo resultados negativos en un ensayo aleatorizado fase II en CM (113).
Los estudios iniciales de inhibidores de CDK, por lo tanto, no cumplieron con sus objetivos, principalmente debido a que su potencial de inhibición era leve y a la inadecuada selección de pacientes. Ya que se estudiaron muchos tipos de tumores al mismo tiempo.
Para la tercera generación de inhibidores de CDK, el interés se centró en el desarrollo de fármacos que inhibieran CDK4 y CDK6. Con la intención de generar la detención citostática del ciclo celular en G0/G1.
Esto llevó al descubrimiento por parte de la empresa Pfizer del compuesto PD 0332991, que mostró una inhibición altamente específica de CDK4 y CDK6 después de su administración oral en ratones, y que hoy en día se conoce como palbociclib (114,115).
Al mismo tiempo, Novartis llevó a cabo la demostración de la utilidad del inhibidor LEE011 (después conocido como abemaciclib) en líneas celulares de neuroblastoma116 y liposarcoma (117). Mientras que Eli Lilly mostró que otro inhibidor de CDK4 y CDK6, LY2835219 (ribociclib) tenía actividad farmacológica sobre células de melanoma. Tanto solo como en combinación con quimioterapia (118, 119).
El siguiente paso fue la utilización de estos fármacos en el CM.
Esto se vio motivado por la observación de que la resistencia al tratamiento endócrino parecía deberse a la falta de regulación en genes asociados a la proliferación que se encuentran regulados por el eje CDK4/6-Rb (120).
Hasta el día de hoy, los tres inhibidores de CDK4 y CDK6 han sido utilizados en por lo menos ocho ensayos clínicos aleatorizados fase III y en un estudio aleatorizado fase II en CM metastásico con RH positivos.
En conjunto, estos estudios demuestran que, comparados con terapia hormonal en monodroga. El tratamiento con inhibidores de CDK4/6 más terapia hormonal se asocia con una mejoría significativa en SG, supervivencia libre de progresión y tasa de respuesta en pacientes con CM RH positivos (121).
Identificación de mutaciones en RE en pacientes con CM tratadas con hormonoterapia
Con el advenimiento de las terapias hormonales, comenzaron también múltiples estudios para evaluar su efectividad. En retrospectiva se observó que era posible alcanzar regresión tumoral en más del 80% de las pacientes, pero estas duraban 12-18 meses en promedio y posteriormente. Usualmente ocurría adaptación tumoral y recaída (122). Santen y colaboradores propusieron que lo anterior podría deberse a hipersensibilidad al estradiol por activación de MAP cinasa (123).
En 2009, Fuqua y colaboradores identificaron una transición de lisina por arginina en el residuo 33 del REα (K303R) en lesiones malignas y premalignas de la mama que les confería hipersensibilidad a estrógenos y resistencia a tamoxifeno, y propusieron que el mecanismo de resistencia involucraba una unión entre el receptor mutante y la subunidad reguladora p85α de la cinasa fosfatidilinositol-3-OH (PI3K) que llevaba al incremento de su actividad y activación de la vías de supervivencia de PKB/Akt; proponiendo esta mutación como un marcador predictor de respuesta a tratamiento, y al bloqueo de la vía PI3K/Akt como una estrategia de tratamiento en neoplasias resistentes a terapia hormonal (124).
A partir de ese momento, diversos investigadores identificaron mutaciones en la subunidad α del RE (125,126) o en su ligando (127,128) hasta en 20% de las neoplasias que progresan después de terapia hormonal (129); proponiéndose como mecanismos clave en la activación del receptor independiente de estrógenos y la resistencia endocrina adquirida (130).