Resultados
Características de los pacientes con adenocarcinoma de pulmón
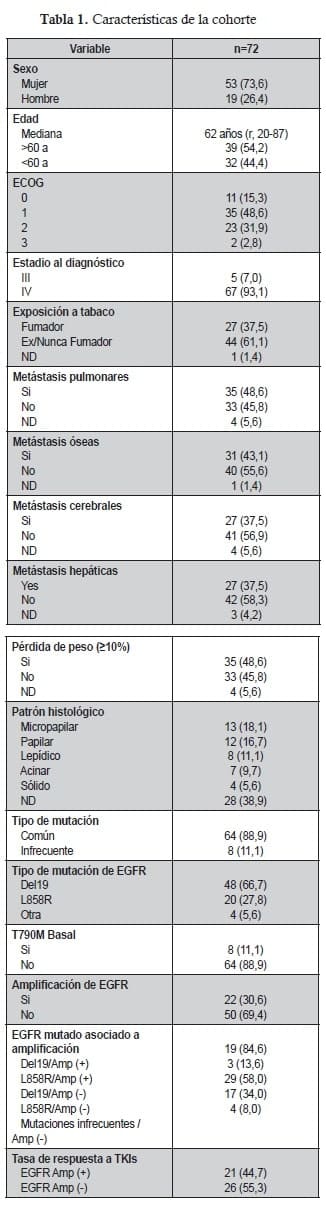
Se seleccionaron un total de 72 adultos pacientes con adenocarcinoma de pulmón mutado EGFR, tratados con TKI en dos instituciones de Colombia. La Tabla 1 resume las características demográficas y clínicas de la población estudiada. La edad mediana en la muestra fue de 62 años (rango 20-87 años), 53 pacientes con adenocarcinoma de pulmón (73%) fueron mujeres, 46 (65%) tuvieron un puntaje de ECOG de 0-1, el sitio más común de afectación metastásica fue el hígado en 27 (37,5%) pacientes y el síntoma más frecuente fue tos crónica en 44 (61%) de los individuos muestreados. La minoría de la muestra (37,5%) tuvo un antecedente de tabaquismo positivo.
 Características moleculares con adenocarcinoma de pulmón
Características moleculares con adenocarcinoma de pulmón
De los 72 pacientes con adenocarcinoma de pulmón, el 89% albergaban la mutación Del19 (66,7%) o L858R (27,8%). También se identificaron un total de 22 (30,6%) pacientes con mutación concomitante de EGFR y amplificación con FISH. La amplificación se observó con mayor frecuencia en las muestras tumorales con Del19 en el 39,6% de los pacientes con adenocarcinoma de pulmón, en comparación con el 15% en el grupo de L858R (p = 0,05). También se asoció con una puntuación ECOG de 0-1 (p = 0,001) pero no se asoció con el tabaquismo (p = 0,85), con la edad superior a 60 años (p = 0,43) sexo (p = 0,2) o el patrón histológico (p = 0,71). Los perfiles moleculares se presentan en la Tabla 1.
Características del tratamiento, respuesta y análisis de supervivencia
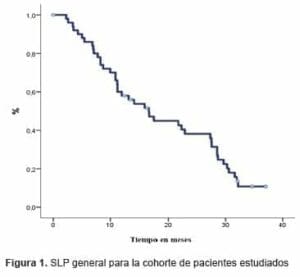
La supervivencia libre de progresión (SLP) para la cohorte fue de 16,7 meses (IC95 11,1-22,3) (Figura 1).
 42 Pacientes (58,3%) recibieron quimioterapia como tratamiento de primera línea antes de la introducción de Erlotinib a la terapia estándar. Se observó una respuesta completa o parcial en 23 (54,8%) de los pacientes y se correlacionó con una mejor SLP, de 8,9 meses, en comparación con 5,13 meses en los que no respondieron (p = 0,003).
42 Pacientes (58,3%) recibieron quimioterapia como tratamiento de primera línea antes de la introducción de Erlotinib a la terapia estándar. Se observó una respuesta completa o parcial en 23 (54,8%) de los pacientes y se correlacionó con una mejor SLP, de 8,9 meses, en comparación con 5,13 meses en los que no respondieron (p = 0,003).
Se observó respuesta al tratamiento con quimioterapia en el 36% de los pacientes con deleción del exón 19 en comparación con el 33,3% con mutación en el exón 21 (p = 0,057). En términos de SLP después de la quimioterapia, la mutación del EGFR también se asoció con mejores resultados, alcanzando 8,32 meses para el Exón 19, 5,83 meses para el exón 21 y 3,97 meses para otras mutaciones (p <0,001). La amplificación de EGFR se asoció con una mejor respuesta a la quimioterapia (p = 0,01), pero no con una mejor SLP después de esta (p = 0,18).
En términos de respuesta a Erlotinib, se observó una respuesta completa o parcial en 47 (65,3%) pacientes con adenocarcinoma de pulmón. La SLP en meses de respondedores a los TKIs fue de 27,5 en comparación con 7,43 en pacientes que no respondieron (p = 0,001). Cuando se estratificó por mutación, el 81,3% de los pacientes con mutaciones del exón 19 lograron respuesta terapéutica, mientras un 40% de los mutantes del exón 21 y el 0% de los pacientes con otras mutaciones (p = 0,001).
Cuando se estratificó por mutación:
La SLP arrojó una diferencia significativa entre el tipo de mutación (p <0,001) 27,5 meses para el Exón 19, 10,8 meses para el Exón 21 y 3,4 para otras mutaciones (Figura 2A). La amplificación de EGFR también reveló una diferencia en la mediana de SLP de 28,5 meses para las muestras amplificadas y 11 en las no amplificadas (p = 0,002) (Figura 2B). Al combinar la amplificación de EGFR y el tipo de mutación, el EGFR amplificado en el Exón 19 alcanzó una SLP similar en comparación con el EGFR amplificado en el Exón 21 (p = 0,166) (Figura 2C).
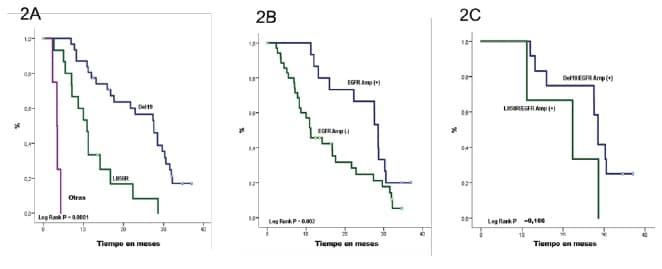
- Figura 2. SLP según mutaciones y estado de amplificación de EGFR*
- 2A) SLP según mutaciones de EGFR. La mutación EGFR en el Exón 19 (Deleción 19) tuvo una SLP de 27,5 meses (IC 95% 21,7-33,3), para el Exón 21 (L858R) la SSA fue de 10,8 meses (IC 95% 8,5-13,2) y para otras mutaciones 3,4 meses (IC 95% 2,1-4,6)
- 2B) SLP según el estado de amplificación EGFR. Los pacientes con amplificación de EGFR (EGFR Amp (+)) mostraron una SLP de 28,5 meses (IC del 95%: 22,0-38,5), en contraste, pacientes sin amplificación de EGFR (Amp del EGFR (-) tuvieron una SSP de 11 meses (IC del 95%). 19,5).
- 2C) SLP según la mutación de EGFR y el estado de amplificación. La SLP en pacientes con mutación y amplificación de EGFR (EGFR Mut / Amp (+)) con mutación del Exón 19 (Del19) fue de 28,5 meses (IC del 95% 26,9-30,0) y con la sustitución del Exón 21 (L858R) fue de 22,3 meses (95% CI 4,5-40,0). Los pacientes con mutación de EGFR y ausencia de amplificación (EGFR Mut / Amp (-)) mostraron una SLP de 21,7 meses (IC del 95%: 11,7-31,7) en los que tenían la mutación del exón 19 (Del19) y 8,7 meses (IC del 95%: 6,4- 15,8) en aquellos con sustitución Exón 21 (L858R).
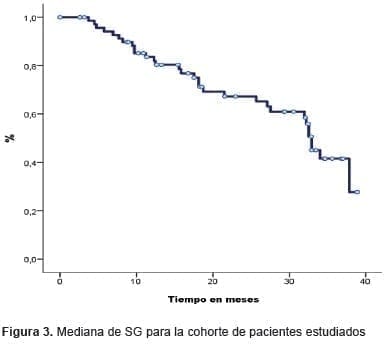
La mediana de supervivencia global (SG) fue de 32,9 meses (Figura 3).
 Se observó una SG más larga en pacientes con mutaciones del Exón 19 (37,83 meses) en comparación con el Exón 21 (18,13 meses) y otras mutaciones (6,35 meses) (p = 0,001) (Figura 4A). De manera similar, la amplificación de EGFR también se asoció con una mejor OS (p = 0,009) (Figura 4B). La amplificación combinada de EGFR y la mutación del exón 19 ofrecieron una SG de 37,8 meses en comparación con 27,5 meses en el exón 21 amplificado de EGFR mutado (p <0,001) (figura 4C).
Se observó una SG más larga en pacientes con mutaciones del Exón 19 (37,83 meses) en comparación con el Exón 21 (18,13 meses) y otras mutaciones (6,35 meses) (p = 0,001) (Figura 4A). De manera similar, la amplificación de EGFR también se asoció con una mejor OS (p = 0,009) (Figura 4B). La amplificación combinada de EGFR y la mutación del exón 19 ofrecieron una SG de 37,8 meses en comparación con 27,5 meses en el exón 21 amplificado de EGFR mutado (p <0,001) (figura 4C).
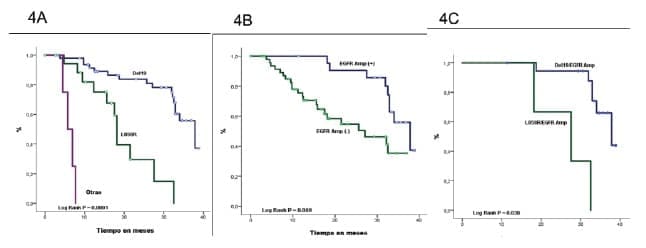
- Figura 4. SG según la mutación y el estado de amplificación de EGFR*
- 4A) SG según la mutación EGFR. La mutación EGFR en el Exón 19 (Deleción 19) tuvo una SG de 37,8 meses (IC 95% 31,2-44,4), para el Exón 21 (L858R) la SG fue de 18,1 meses (IC 95% 17,2-19,9) y para otras mutaciones fue de 6,4 meses (95% CI 3,3-8,1).
- 4B) SG según el estado de amplificación de EGFR. Los pacientes con amplificación de EGFR (EGFR Amp (+)) mostraron una SG de 37,8 meses (IC del 95%: 30,9-44,7); en cambio, los pacientes sin amplificación de EGFR (EGFR Amp (-)) tenían una SG de 27,1 meses (IC del 95%: 12,8 -41,3).
- 4C) SG según la mutación EGFR y el estado de amplificación La SG en pacientes con mutación y amplificación de EGFR (EGFR Mut / Amp (+)) con mutación del Exón 19 (Del19) fue de 37,8 meses (IC 95% 31,0-44,6) y con la sustitución del Exón 21 (L858R) fue de 27,5 meses (95% CI 12,4-42,5). Los pacientes con mutación de EGFR y amplificación ausente (EGFR Mut / Amp (-)) presentaron una SG de 32,5 meses (IC del 95%: 18,6-34,7) en los que tenían la mutación del exón 19 (Del19) y 17,5 meses (IC del 95%: 14,6- 20,3) en aquellos con sustitución Exón 21 (L858R).
Discusión
Las mutaciones de los genes de la vía de señalización del receptor del factor de crecimiento epidérmico (EGFR) son mutaciones somáticas asociadas con pronóstico adverso en los Pacientes con Adenocarcinoma de Pulmón de células no pequeñas (NSLC).
Comúnmente se pensaba que la activación de mutaciones somáticas en un alelo de un oncogen, es decir, una mutación heterocigótica (“un golpe”) era suficiente para la tumorigénesis (19,20). Sin embargo, otros mecanismos principales de la activación de oncogenes, “Copy Number Gains” (CNG) por su nombre y siglas en inglés, debido a la amplificación focal o polisomía cromosómica, se han relacionado con una mayor transcripción de alelos mutantes y por ende mayor actividad del gen de EGFR (21).
La ganancia en el número de copias de este gen, está asociada con la activación de mutaciones solo en el locus oncogénico mutado, pero no en otros loci oncógenos (1). Este fenómeno ha sido descrito como desequilibrio específico del alelo mutante (MASI) causado por el aumento del número de copias o disomía uniparental (DUP) debido a la pérdida completa del alelo natural (20,21).
Estas desregulaciones del gen EGFR, más la expresión de la proteína EGFR, se están estudiando como biomarcadores correlacionados con la respuesta al tratamiento con TKIs y la supervivencia en pacientes con NSCLC avanzado (15,22-25).
En el estudio actual, se informa el análisis molecular del gen del EGFR en 72 pacientes con Pacientes con Adenocarcinoma de Pulmón que recibieron Erlotinib como tratamiento de primera o segunda línea. Todos los pacientes tenían una mutación EGFR y aproximadamente un tercio de los pacientes tenían un número de copias del gen EGFR aumentado. Los tipos más comunes de mutaciones detectadas fueron la mutación del exón 19 (66,7%) y la mutación desustitución del exón 21 L858R (27,8%).
Los pacientes con estas mutaciones sensibilizantes que respondieron a Erlotinib (ORR = 65,3%):
Se asociaron con una mayor supervivencia global (SG) y supervivencia libre de progresión (SLP) (p = 0,001), en comparación con los que no respondieron. Al igual que lo publicado en estudios previos, los pacientes con mutación Del19 tuvieron mejores resultados clínicos que los pacientes con mutación por sustitución de L858R (26).
Estos resultados también sugieren una asociación estadísticamente significativa para los pacientes con un mayor número de copias del gen EGFR (detectado por FISH) en la terapia con TKIs. Estos casos mostraron una respuesta más alta (ORR = 95,5%), SLP (22,3 meses para amplificados y 12,4 meses en no amplificados, p = 0,002) y SG (37,8 meses, IC 95% 30,9-44,7 y 12,4 meses, IC 95% 5,3-19,5); p = 0,009) en comparación con pacientes con tumores negativos. Además, la amplificación de EGFR se asoció con una mejor respuesta a la quimioterapia, sin embargo, no se identificaron diferencias en la SLP en este subgrupo (p = 0,18).
Estos hallazgos son consistentes con estudios previos. Cappuzzo y otros:
Publicaron un estudio retrospectivo que muestra que los pacientes con NSCLC y tumores EGFR positivos para FISH (amplificación génica y polisomía alta), tuvieron tasas significativamente más altas de respuesta a Gefitinib (54% y 25%), SLP (9,1 y 6,3 meses) y tasas de supervivencia a 1 año (48,8% y 62,3%) más altas, que los pacientes con tumores FISH negativos, quienes sufrieron de enfermedad progresiva en más del 70%.
El tiempo hasta la progresión fue de 3,5 meses o menos, y la mediana de supervivencia fue de 7 meses o menos (22). Por otra parte, en una revisión sistemática y de meta-análisis de Dahabreh et al., que incluyó 22 estudios con 1.821 pacientes (población caucásica y asiática), se describió que el aumento del número de copias del gen EGFR se asocia significativamente con una mejor SG (HR = 0,77; IC del 95%: 0,66-0,89; p = 0,001) y SLP (HR = 0,60; IC del 95%: 0,46-0,79; p <0,001) entre los Pacientes con Adenocarcinoma de Pulmón tratados con TKIs (23).
Finalmente, un metanálisis y una revisión sistemática recientes, realizados por Zhang et al., de 17 estudios con un total de 2.047 pacientes:
Demostraron que el aumento del número de copias del gen EGFR se asocia con una mayor tasa de respuesta y SLP en la población asiática y caucásica (p≤0,008), y una mejor SG en pacientes caucásicos (p≤0,018) (15). Los resultados de este estudio indican que el alto número de copias del gen EGFR identificado por FISH, puede ser un biomarcador eficaz para la sensibilidad a Erlotinib en pacientes Pacientes con Adenocarcinoma de Pulmónhispanos con NSCLC avanzado.
Aunque las mutaciones de EGFR se consideran el primer paso en la tumorigénesis en el NSCLC, la presencia de células cancerosas que albergan tanto EGFR como mutaciones de EGFR, sugiere que estas dos alteraciones genéticas coexistentes, cooperan en el desarrollo del tumor (19,27).
Además, la combinación de estos dos mecanismos activadores (mutación y MASI) puede conferir una mayor ventaja de crecimiento y supervivencia a la célula maligna que la presencia de un único mecanismo (20). En consecuencia, los tumores con ambos mecanismos activadores parecen ser más dependientes molecularmente de la vía EGFR y, debido a eso, podrían ser más sensibles a TKIs (19).
En este estudio se realizó un análisis de asociación entre el genotipo de la mutación EGFR:
La amplificación de EGFR y los desenlaces del paciente, encontrando una diferencia estadística en la supervivencia (37,8 meses vs 27,5 meses) para la amplificación EGFR y la mutación Del19 o L858R, respectivamente (p <0,001). Sin embargo, la diferencia en SLP no alcanzó significación estadística (p = 0,116).
Por lo tanto, en este estudio, la amplificación de EGFR para la mutación del exón 19 tuvo la mejor respuesta al tratamiento con EGFR-TKI. Además, los pacientes Pacientes con Adenocarcinoma de Pulmón con mutación de sustitución L858R del exón 21 tuvieron una mayor mejoría en la supervivencia cuando la amplificación estaba presente, tanto para la SLP (22,3 meses frente a 8,7 meses) como para la SG (27,5 meses frente a 17,5 meses).
Estos resultados son concordantes con el estudio retrospectivo realizado por Shan et al, que incluyó 86 Pacientes con Adenocarcinoma de Pulmón que albergaban mutaciones activadoras de EGFR y recibieron tratamiento con EGFR-TKI, encontraron en pacientes con deleciones en el exón 19, la mediana de SLP fue significativamente mayor en aquellos con amplificación de EGFR que aquellos sin (18,3 vs. 9,1 meses) (p = 0,021).
Aunque no significativo, los pacientes con la mutación y la amplificación de L858R tuvieron una mediana de la SLP más larga, en comparación con aquellos sin amplificación (16,0 vs. 9,8 meses) (p = 0,178) (19).
Los hallazgos de este estudio son relevantes ya que siguieron a pacientes Pacientes con Adenocarcinoma de Pulmón hispanos:
Mientras que la mayoría de los datos publicados se han limitado a la población caucásica y asiática. La etnicidad podría explicar la variabilidad genética y la capacidad predictiva del número de copias del gen EGFR en poblaciones que podrían albergar diferentes mutaciones somáticas de EGFR y amplificación de EGFR.
Las limitaciones son su naturaleza retrospectiva y un tamaño de muestra pequeño. Además, no se incluyó la histología de células escamosas u otros factores coexistentes, como la expresión de la proteína EGFR y el estado de la mutación KRAS. También se sabe que estos factores afectan la respuesta de TKIs en NSCLC.
Conclusiones
Los estudios en diversas poblaciones permiten la expansión del conocimiento del paisaje genómico del NSCLC. Los resultados de este estudio respaldan la hipótesis, según la cual, el número de copias del gen EGFR detectado por FISH y las mutaciones sensibilizantes de EGFR, son biomarcadores asociados con una mejor supervivencia global, supervivencia libre de progresión y respuesta al tratamiento con EGFR-TKI en pacientes con NSCLC avanzado.
En la búsqueda de herramientas predictivas y de pronóstico, se podría agregar el número de copia del gen EGFR como una nueva herramienta de diagnóstico, que permitirá el logro de un método de identificación preciso para pacientes con NSCLC avanzado que se beneficiarán con el tratamiento con TKIs.
Impacto Ambiental
Se dio manejo de residuos de análisis de histopatología, marcadores y demás reactantes de la manera estipulada por la normatividad vigente de manejo de residuos, establecido por la autoridad sanitaria competente. No se consideran otros impactos ambientales.
Conflicto de interés
Los autores declaran no tener ningún conflicto de interés.
Consideraciones Éticas
El estudio, al ser de carácter retrospectivo, en donde no hubo modificaciones en variables fisiológicas, psicológicas o sociales, se considera un estudio Sin Riesgo según el decreto 8430. Se dio protección y anonimización de datos personales en concordancia con la Ley de habeas data. Este estudio fue aprobado por el Comité de Ética e Investigación de las instituciones participantes.
Financiación de la investigación
El presente estudio ha sido respaldado por la Fundación para la Investigación Clínica y Aplicada del Cáncer – FICMAC (Bogotá, Colombia), Grant de investigación 017-2015.
Referencias
- 1. Molina JR, Yang P, Cassivi SD, Schild SE, Adjei AA. Non–Small Cell Lung Cancer: Epidemiology, Risk Fac-tors, Treatment, and Survivorship. Mayo Clin Proc Mayo Clin. 2008 May; 83(5):584–94.
- 2. Lynch TJ, Bell DW, Sordella R, Gurubhagavatula S, Okimoto RA, Brannigan BW, et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non–Small-Cell Lung Cancer to Gefiti-nib. N Engl J Med. 2004 May 20; 350(21):2129–39.
- 3. Shepherd FA, Rodrigues Pereira J, Ciuleanu T, Tan EH, Hirsh V, Thongprasert S, et al.
- 4. Erlotinib in Previously Treated Non–Small-Cell Lung Cancer. N Engl J Med. 2005 Jul
- 5. 14; 353(2):123–32.
- 6. Tsao M-S, Sakurada A, Cutz J-C, Zhu C-Q, Kamel-Reid S, Squire J, et al. Erlotinib in Lung
- 7. Cancer — Molecular and Clinical Predictors of Outcome. N Engl J Med. 2005 Jul 14; 353(2):133–44.
- 8. Marchetti A, Martella C, Felicioni L, Barassi F, Salvatore S, Chella A, et al. EGFR mutations in non-small-cell lung cancer: analysis of a large series of cases and development of a rapid and sensitive method for diagnostic screening with potential implications on pharmacologic treatment. J Clin Oncol Off J Am Soc Clin Oncol. 2005 Feb 1; 23(4):857–65.
- 9. Huang S-F, Liu H-P, Li L-H, Ku Y-C, Fu Y-N, Tsai H-Y, et al. High frequency of epidermal growth factor receptor mutations with complex patterns in non-small cell lung cancers related to Gefitinib responsiveness in Taiwan. Clin Cancer Res off J Am Assoc Cancer Res. 2004 Dec 15; 10(24):8195–203.
Bibliografía
- 10. Arrieta O, Cardona AF, Martín C, Más-López L, Corrales-Rodríguez L, Bramuglia G, et al. Updated Frequency of EGFR and KRAS Mutations in NonSmall-Cell Lung Cancer in Latin America: The Latin-American Consortium for the Investigation of Lung Cancer (CLICaP). J Thorac Oncol off Publ Int Assoc Study Lung Cancer. 2015 May; 10(5):838–43.
- 11. Arrieta O, Cardona AF, Federico Bramuglia G, Gallo A, Campos-Parra AD, Serrano S, et al. Genotyping non-small cell lung cancer (NSCLC) in Latin America. J Thorac Oncol off Publ Int Assoc Study Lung Cancer. 2011 Nov; 6(11):1955–9.
- 12. Tokumo M, Toyooka S, Kiura K, Shigematsu H, Tomii K, Aoe M, et al. The relationship between epidermal growth factor receptor mutations and clinicopathologic features in non-small cell lung cancers. Clin Cancer Res off J Am Assoc Cancer Res. 2005 Feb 1; 11(3):1167–73.
- 13. Thatcher N, Chang A, Parikh P, Rodrigues Pereira J, Ciuleanu T, von Pawel J, et al. Gefitinib plus best sup-portive care in previously treated patients with refractory advanced non-small-cell lung cancer: results from a ran-domised, placebo-controlled, multicentre study (Iressa Survival Evaluation in Lung Cancer). Lancet Lond Engl. 2005 Nov 29; 366(9496):1527–37.
- 14. Kris MG, Natale RB, Herbst RS, Lynch TJ, Prager D, Belani CP, et al. Efficacy of Gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase, in symptomatic patients with non-small cell lung cancer: a randomized trial. JAMA. 2003 Oct 22; 290(16):2149–58.
Fuente
- 15. Fukuoka M, Yano S, Giaccone G, Tamura T, Nakagawa K, Douillard J-Y, et al. Multi-institutional randomized phase II trial of Gefitinib for previously treated patients with advanced non-small-cell lung cancer (The IDEAL 1 Trial) [corrected]. J Clin Oncol Off J Am Soc Clin Oncol. 2003 Jun 15; 21(12):2237–46.
- 16. Pérez-Soler R, Chachoua A, Hammond LA, Rowinsky EK, Huberman M, Karp D, et al. Determinants of tumor response and survival with Erlotinib in patients with non-small-cell lung cancer. J Clin Oncol Off J Am Soc Clin Oncol. 2004 Aug 15; 22(16):3238–47.
- 17. Santarpia M, Altavilla G, Salazar MF, Magri I, Pettineo G, Benecchi S, et al. Tyrosine kinase inhibitors for non non-small-cell lung cancer: finding patients who will be responsive. Expert Rev Respir Med. 2011 Jun; 5(3):413–24.
- 18. Zhang X, Zhang Y, Tang H, He J. EGFR gene copy number as a predictive/biomarker for patients with non-small-cell lung cancer receiving tyrosine kinase inhibitor treatment: a systematic review and meta-analysis. J In-vestig Med Off Publ Am Fed Clin Res. 2017; 65(1):72– 81.
- 19. Taniguchi K, Okami J, Kodama K, Higashiyama M, Kato K. Intratumor heterogeneity of epidermal growth factor receptor mutations in lung cancer and its correlation to the response to Gefitinib. Cancer Sci. 2008 May; 99(5):929–35.
- 20. Bai H, Wang Z, Wang Y, Zhuo M, Zhou Q, Duan J, et al. Detection and Clinical Significance of Intratumoral EGFR Mutational Heterogeneity in Chinese Patients with Advanced Non-Small Cell Lung Cancer. Plos One. 2013 Feb 13; 8(2):e54170.
Referencias Bibliográficas
- 21. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer Oxf Engl 1990. 2009 Jan; 45(2):228– 47.
- 22. Shan L, Wang Z, Guo L, Sun H, Qiu T, Ling Y, et al. Concurrence of EGFR amplification and sensitizing mu-tations indicate a better survival benefit from EGFR-TKI therapy in lung adenocarcinoma patients. Lung Cancer Amst Neth. 2015 Sep; 89(3):337–42.
- 23. Gandhi J, Zhang J, Xie Y, Soh J, Shigematsu H, Zhang W, et al. Alterations in genes of the EGFR signaling pathway and their relationship to EGFR tyrosine kinase inhibitor sensitivity in lung cancer cell lines. Plos One. 2009; 4(2):e4576.
- 24. Soh J, Okumura N, Lockwood WW, Yamamoto H, Shigematsu H, Zhang W, et al. Oncogene mutations, copy number gains and mutant allele specific imbalance (MASI) frequently occur together in tumor cells. PloS One. 2009 Oct 14; 4(10): e7464.
- 25. Cappuzzo F, Hirsch FR, Rossi E, Bartolini S, Ceresoli GL, Bemis L, et al. Epidermal growth factor receptor gene and protein and Gefitinib sensitivity in non-small-cell lung cancer. J Natl Cancer Inst. 2005 May 4; 97(9):643–55.
- 26. Dahabreh IJ, Linardou H, Kosmidis P, Bafaloukos D, Murray S. EGFR gene copy number as a predictive biomarker for patients receiving tyrosine kinase inhibitor treatment: a systematic review and meta-analysis in non-small-cell lung cancer. Ann Oncol off J Eur Soc Med Oncol. 2011 Mar; 22(3):545–52.
Fuentes Bibliográficas
- 27. Hirsch FR, Varella-García M, McCoy J, West H, Xavier AC, Gumerlock P, et al. Increased epidermal growth factor receptor gene copy number detected by fluorescence in situ hybridization associates with increased
sensitivity to Gefitinib in patients with bronchioloalveolar carcinoma subtypes: A Southwest Oncology Group Stu-dy. J Clin Oncol Off J Am Soc Clin Oncol. 2005 Oct 1; 23(28):6838–45. - 28. Hsu W-H, Yang JC-H, Mok TS, Loong HH. Overview of current systemic management of EGFR-mutant NSCLC. Ann Oncol off J Eur Soc Med Oncol. 2018 Jan 1; 29(suppl_1): i3–9.
- 29. Lee CK, Wu Y-L, Ding PN, Lord SJ, Inoue A, Zhou C, et al. Impact of Specific Epidermal Growth Factor Receptor (EGFR) Mutations and Clinical Characteristics on Outcomes after Treatment with EGFR Tyrosine Kinase Inhibitors versus Chemotherapy in EGFR-Mutant Lung Cancer: A Meta-Analysis. J Clin Oncol Off J Am Soc Clin Oncol. 2015 Jun 10; 33(17):1958–65.
- 30. Zhao Z-R, Wang J-F, Lin Y-B, Wang F, Fu S, Zhang S-L, et al. Mutation abundance affects the efficacy of EGFR tyrosine kinase inhibitor readministration in non-small-cell lung cancer with acquired resistance. Med Oncol Northwood Lond Engl. 2014 Jan; 31(1):810.
Recibido: 8 de febrero de 2019
Aceptado: 8 de mayo de 2019
Correspondencia:
Andrés Felipe Cardona a_cardonaz@yahoo.com

 Características moleculares con adenocarcinoma de pulmón
Características moleculares con adenocarcinoma de pulmón