Nancy Dora Marín Agudelo1, Jhan Sebastián Saavedra Torres2, Luisa Fernanda Zúñiga Cerón3, Carolina Salguero4
Resumen
Los probióticos se han utilizado para el tratamiento de un gran número de patologías pediátricas y del adulto; principalmente, para el tratamiento de problemas gastrointestinales que cursan con la alteración en la microbiota intestinal.
El objetivo de emplear probióticos radica en ayudar a la microbiota intestinal a regular sus desequilibrios, pues dentro de las especies que colonizan nuestras mucosas, éstas han sido reconocidas como organismos generalmente seguros.
Así pues, el uso de estos microorganismos representa un beneficio para la salud puesto que se valen de mecanismos bioquímicos que causan efectos antimicrobianos y fisiológicos.
También se ha comprobado que los probióticos son importantes para la maduración de la inmunidad humoral en la primera infancia y para tratar y prevenir la diarrea infecciosa. Sin embargo, se requieren más investigaciones para documentar el uso y sus pautas específicas para los probióticos en grupos concretos de pacientes.
Palabras clave: Diarrea, probióticos, prebióticos, microbiota intestinal, suplementos dietarios, mucosa intestinal. (Lea también: Artículo de Investigación: Valoración de la Flexión Lumbar)
Probiotics: Live Microorganisms that Prevent Diseases in Adults and Children
Abstract
Probiotics have been used in a large number of adult and pediatric pathologies; mainly for the treatment of gastrointestinal problems that occur with the alteration in the intestinal microbiota.
The aim of using probiotics is to help intestinal microbiota to regulate its imbalances; since within the species that colonize our mucous, these have been recognized as agencies usually safe.
Thus, the use of these microorganisms represents a health benefit because avail themselves of biochemical mechanisms that cause antimicrobial and physiological effects. It has also been found that probiotics are important for the maturation of the humoral immunity in early childhood, and for treating and preventing infectious diarrhea; however, more research is needed to document the use and specific guidelines for probiotics in specific groups of patients.
Keywords: Diarrhea, probiotics, prebiotics, intestinal microbiota, dietary supplements, intestinal mucosa.
Introducción
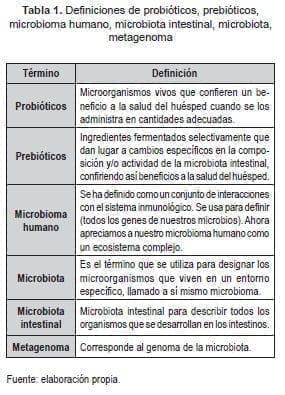
La definición del término probiótico ha sido modificada a lo largo de la historia de acuerdo con el avance en los conocimientos que se han logrado en ese campo (1) como se registra en la Tabla 1.
El término probiótico fue usado por primera vez en el año 1965 por Lilly y Stillwell, quienes con él hacían referencia a aquel factor de origen microbiológico que estimula el crecimiento de otros organismos (2, 3).
Posteriormente, en 1974, Parker los define como los microorganismos y compuestos que participan en el balance y desarrollo microbiano intestinal (4− 6). En el año 1989, R. Fuller enfatizó en el requisito de viabilidad para los probióticos e introdujo la idea de que poseen un efecto beneficioso para el huésped, definiendo los probióticos como aquellos microorganismos vivos (7), principalmente bacterias y levaduras, que son agregados como suplemento en la dieta y que afectan en forma beneficiosa el desarrollo de la microbiota en el intestino (8−11).
 El cuerpo humano alberga muchas especies de bacterias, virus, hongos y protozoarios (microbiota normal) (12). Casi todos son comestibles, definidos como microorganismos que viven de modo simbióticos en el huésped humano o dentro del mismo, pero rara vez suscita enfermedad.
El cuerpo humano alberga muchas especies de bacterias, virus, hongos y protozoarios (microbiota normal) (12). Casi todos son comestibles, definidos como microorganismos que viven de modo simbióticos en el huésped humano o dentro del mismo, pero rara vez suscita enfermedad.
Los sitios anatómicos donde por lo general se encuentran bacterias son la piel (estafilococos y difteroides), la bucofaringe (estreptococos, anaerobios), el intestino grueso (enterococos, bacilos entéricos), y la vagina (lactobacilos) (13).
Actualmente, la OMS define a los probióticos como microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio a la salud (4, 5, 6) y cuyos atributos se registran en la Tabla 2.
Es decir que, los probióticos conforman cultivos de microorganismos vivos que se aplican en los alimentos del hombre y de los animales con el fin de modificar de manera benéfica la composición de la microbiota intestinal para generar ventajas en el consumidor (14−16).
 En ese sentido, la definición de los prebióticos los caracteriza como sustancias de la dieta (fundamentalmente consistentes en polisacáridos, no almidón y oligosacáridos, no digeribles por las enzimas humanas) que nutren a grupos seleccionados de microorganismos que habitan en el intestino y favorecen el crecimiento de bacterias beneficiosas por sobre las nocivas (17).
En ese sentido, la definición de los prebióticos los caracteriza como sustancias de la dieta (fundamentalmente consistentes en polisacáridos, no almidón y oligosacáridos, no digeribles por las enzimas humanas) que nutren a grupos seleccionados de microorganismos que habitan en el intestino y favorecen el crecimiento de bacterias beneficiosas por sobre las nocivas (17).
Así pues, el objetivo de usar probióticos persigue que estos ayuden a la microbiota intestinal que aparece naturalmente en el organismo humano (18−20) promoviendo los beneficios consignados en la Tabla 3. Adicionalmente, algunos preparados con probióticos han sido utilizados para evitar la diarrea provocada por antibióticos.
Existen algunos estudios que documentan los efectos benéficos de los probióticos para el tratamiento de una serie de trastornos gastrointestinales y extraintestinales entre los que se incluyen: la enfermedad intestinal inflamatoria (EII), el síndrome de intestino irritable (SII), las infecciones vaginales, y como refuerzo inmunológico. Además, algunos probióticos han demostrado aumentar la sobrevida de los recién nacidos pretérmino (9, 16, 17).
 En principio, cualquier componente de la microbiota de ocupación podría ser candidato a considerarse probiótico porque todos ellos participan sinergísticamente en la producción de beneficios que otorga el conjunto microbiótico (21).
En principio, cualquier componente de la microbiota de ocupación podría ser candidato a considerarse probiótico porque todos ellos participan sinergísticamente en la producción de beneficios que otorga el conjunto microbiótico (21).
Sin embargo, en la práctica, los probióticos pertenecen fundamentalmente a dos grupos microbianos: los lactobacilos y las bifidobacterias (21, 22). Dentro de las especies que colonizan nuestras mucosas, estas dos conforman las únicas que pueden ser inocuas bajo cualquier circunstancia.
Por ello, se les reconoce como organismos generalmente seguros o GRAS (Generally Regarded as Safe) y con presunción calificada de seguridad o QPS (Qualified Pre sumption of Safety) de acuerdo con la FDA (Food and Drug Administration) de los Estados Unidos y la EFSA (European Food Safety Authority) (23).
En esa línea, se ha demostrado que los probióticos promueven el crecimiento bacteriano. Además, ayudan a mejorar la absorción de minerales en el intestino, a reducir los niveles séricos del colesterol y a restaurar la microbiota autóctona del sistema digestivo cuando ha sufrido daños como consecuencia del estrés intestinal (uso de antibióticos), radiaciones, infecciones y en personas con el sistema inmunológico deficiente o neonatos en cuidados intensivos (14, 24) (Figura 1).
 En ese sentido, las diversas funciones e interacciones que permiten estos microorganismos se insertan entre las digestivas, metabólicas e inmunológicas; las cuales se irán abordando a lo largo del presente artículo.
En ese sentido, las diversas funciones e interacciones que permiten estos microorganismos se insertan entre las digestivas, metabólicas e inmunológicas; las cuales se irán abordando a lo largo del presente artículo.
Sin embargo, esas funciones se mantienen aparentemente en equilibrio en un individuo sano, salvo cuando se presentan factores de riesgos que involucran el desequilibrio del ecosistema bacteriano y se promueve la acción de estimular la producción de bacterias patógenas sobre las benéficas; por ejemplo en pacientes: inmunosuprimidos, con presencia de virus, deficiencias alimenticias y enfermedades del Sistema Gastro Intestinal.
En virtud de lo anterior, los probióticos representan un beneficio para la salud mediante el uso de mecanismos bioquímicos que causan efectos antimicrobianos y fisiológicos.
Los efectos antimicrobianos derivan de la colonización competitiva donde los microorganismos probióticos despojan a microorganismos patógenos de sus nutrientes o nichos de implantación en la mucosa intestinal (21, 25), por ejemplo: al producir ácidos orgánicos como el ácido láctico o el acético, los probióticos disminuyen el pH intestinal causando un ambiente hostil para los patógenos.
También, a través de la producción de peróxido de hidrógeno y dióxido de carbono, los probióticos inhiben la adhesión y crecimiento de las bacterias nocivas. Los microorganismos probióticos de la leche producen la enzima β-galactosidasa o lactasa que acelera la digestión de lactosa hecho que beneficia a las personas con deficiencia de lactasa.
Por otra parte, los efectos fisiológicos pueden variar de manera cuantitativa y cualitativa de acuerdo con las condiciones inmunitarias del huésped y la cepa del probiótico utilizada (9). No obstante, se ha demostrado que al estimular la reacción inmunitaria en sujetos sanos, los probióticos confieren protección contra procesos infecciosos y contra otras alteraciones en las que interviene el sistema inmunitario (26).
Respecto a la seguridad de los probióticos y simbióticos, que son mezclas de uno o varios organismos probióticos con uno o más compuestos prebióticos (23), la balanza de beneficios frente a los riesgos se inclina hacia los probióticos ya que el riesgo de infección es bajo (21).
Aunque, existen grupos selectos de pacientes en los cuales se recomienda manejar con precaución su administración, en especial en pacientes críticos, prematuros y algunos pacientes inmunodeprimidos (6, 27).
En efecto, si bien las bacterias de los géneros Lactobacillus y Bifidobacterium se consideran como no infectivas y seguras, los pacientes inmunodeprimidos no deben tomar probióticos sin la supervisión de un médico, pues en estas circunstancias el microorganismo podría llegar a comportarse como un agente patógeno oportunista (22).
Teniendo en cuenta estas precauciones, los probióticos optimizan las condiciones del ecosistema intestinal e influyen efectivamente en procesos como la digestión, la inmunidad y la resistencia a enfermedades (28, 29).
Metodología
Se desarrolló una revisión bibliográfica en un margen de tiempo entre el año 1985 al 2016 permitiendo un total de 90 documentos seleccionados con un alto rigor metodológico, a partir de la búsqueda bibliográfica en las bases de datos Scielo, NEJM, Elsevier, Pubmed, Redalyc, Wiley, Springer, ScienceDirect, Medwave, Nature Riviews, Cochrane, EBSCO, Naxos, Bases de datos a las que ofrecen acceso la Universidad del Cauca y la Universidad de Harvard.
La búsqueda se limitó a la revisión de artículos publicados en el idioma inglés y español; y se desarrolló utilizando los términos MeSH: “Probióticos”, “Enfermedades infecciosas”, “Dietary Supplements”, “Probiotics”, “Microbiota”, “Microbiota-Gastrointestinal” y “Microbiota Intestinal”.
Para la gestión y la organización de la información, se utilizó el programa Mendeley de libre acceso. Se seleccionaron únicamente estudios tipo: estudios de cohorte, estudios de intervención, meta-análisis, artículos originales y artículos de revisión documental que demostraran rigor sistemático y que se enfocaran en los aspectos clínicos, bioquímicos, biológicos, patológicos y experimentales acerca de las innovaciones en el uso de probióticos.
Adicionalmente, se realizaron revisiones de textos, manuales, mapas conceptuales y archivos que contuvieran información relevante y constatada sobre la biología de los probióticos en la actualidad. Finalmente, se construyó un marco teórico representado en el presente artículo.
1 Bact. PhD. Docente, Sede de Investigación Universitaria, Sector Salud, Universidad de Antioquia, Medellín, Colombia.
2 Estudiante de medicina. Departamento de Ciencias. Facultad de Ciencias de la Salud, Universidad del Cauca.
3 Estudiante de medicina. Departamento de Medicina. Facultad de Ciencias de la Salud, Universidad del Cauca.
4 Bqm., Econ. Candidata de Doctorado. Departamento de Biología Celular y Molecular, Universidad de Harvard, Cambridge, USA.
Función Protectora de los Probióticos
Diversos estudios realizados in vivo e in vitro han logrado dilucidar algunos de los mecanismos por los cuales los probióticos cumplen una función protectora en el organismo (30, 31). Las investigaciones in vitro han comprobado que las bacterias de los probióticos actúan sobre las células epiteliales intestinales favoreciendo la expresión del mRNA para dos mucinas, la MUC2 y MUC3, que constituyen glicoproteínas con una acción protectora ante las infecciones intestinales (32).
Adicionalmente, se ha demostrado que el uso de cepas adhesivas de lactobacilos promueven el desarrollo de una barrera de mucosa más efectiva y protegen el organismo de la infección por rotavirus, aunque no se conoce si se lleva a cabo mediante un antagonismo directo o si el probiótico ejerce un efecto de estimulación sobre el sistema inmune (33–35), aunque es posible que se deba a un efecto combinado de ambos mecanismos (7).
El Microbioma Humano
El termino microbioma humano se usa para designar a todos los genes de nuestros microbios. Gracias a los estudios e investigaciones recientes, ahora reconocemos a nuestro microbioma humano como un ecosistema complejo, con distintos nichos biológicos (36).
También, se ha logrado un entendimiento más claro acerca de la función de la comunidad microbiana en el huésped, que puede facilitar una mejor comprensión de las enfermedades infecciosas y la susceptibilidad a las infecciones (30, 37). No obstante, es importante reconocer que la microbiota constituye un sistema de interacciones que contribuye en el desarrollo fisiológico, orgánico y metabólico de los seres humanos (36).
Puesto que, el organismo humano es una red compleja de células y microbios (38), particularmente, el microbioma intestinal constituye una comunidad taxonómicamente compleja y ecológicamente dinámica e influye en el desarrollo, la maduración y la regulación (39), la estimulación y la supresión del sistema inmune (40).
Por su parte, el sistema inmune asociado a mucosas incluye el 80 % de las células inmunes activas del cuerpo. La mayoría de ellas se encuentran presentes en el sistema gastrointestinal interactuando con los antígenos de los alimentos y con este “órgano” que es el microbioma (39).
Por otra parte, el microbioma humano, se ha caracterizado como el conjunto de interacciones con el sistema inmunológico; como parte integral de procesos fundamentales como la producción de vitaminas, la digestión (39), la homeostasis energética,(40) la integridad de la barrera intestinal y la angiogénesis en el cuerpo humano (21).
La Microbiota Intestinal
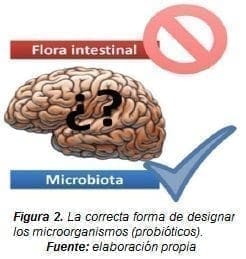
El término microbiota intestinal hace referencia al ecosistema microbiano que coloniza el tracto gastrointestinal (7, 41) (Figura 2). Se sabe que la forma correcta de designar a estos microorganismos es microbiota intestinal, aunque también se les puede llamar biota intestinal o bacterias intestinales.
Por su parte, el término flora intestinal fue acuñado porque antes las bacterias se consideraban vegetales unicelulares de suerte que su uso era predominante, pero las investigaciones actuales evidencian que se encuentra mal designado en el mundo científico y médico.
 El cuerpo humano consta de una microbiota que actúa de manera benéfica en el organismo, mas si se altera o se asocia a algunos factores de riesgo, se pueden desarrollar patologías y respuestas inadecuadas que conllevan desequilibrios biológicos del sistema y alteraciones inmunológicas (7, 11, 42, 43).
El cuerpo humano consta de una microbiota que actúa de manera benéfica en el organismo, mas si se altera o se asocia a algunos factores de riesgo, se pueden desarrollar patologías y respuestas inadecuadas que conllevan desequilibrios biológicos del sistema y alteraciones inmunológicas (7, 11, 42, 43).
A eso se suma que, la microbiota colónica tiene como función primordial recuperar energía a partir del contenido de la comida que ha escapado de la digestión en el tracto gastrointestinal superior, a través del proceso de fermentación. Aproximadamente, el 8% del total de energía diaria se deriva de la fermentación bacteriana colónica (44).
Ahora bien, en la microbiota intestinal de un adulto, se destaca la presencia de Lactobacillus (45, 46), los cuales desempeñan un papel importante en la biotransformación de los esteroides, incrementan las células productoras de inmunoglobulina A (IgA) y protegen al organismo de la colonización por bacterias patógenas u otros agentes de origen infeccioso (47).
Otra de las funciones de la microbiota consiste en ayudar a mantener la arquitectura normal de las vellosidades, participar en la producción de vitaminas y nutrientes, además de metabolizar un gran número de compuestos exógenos y endógenos (47, 48).
En esa misma vía, las vitaminas producidas por la microbiota intestinal crean un aporte adicional para el huésped (30). Estudios realizados con ratones nacidos en ambientes libres de gérmenes demandan vitamina K y mayores contribuciones de ciertas vitaminas del grupo B para su adecuado desarrollo (49), aspectos en los cuales puede contribuir el uso de probióticos.
La síntesis de vitaminas se ha atribuido a diversos grupos de la microbiota intestinal (Bifidobacterium, Bacteroides, Eubacterium y Fusobacterium) y también a bacterias lácticas utilizadas en fermentaciones alimentarias (Propionibacterium y Lactobacillus) (50).
Específicamente, se ha demostrado que las vitaminas B6, B12, tiamina, ácido fólico y ácido nicotínico son sintetizadas en cantidades importantes por diversas especies del género Bifidobacterium de origen humano (51). Sin embargo, el grado en que son asimiladas por el huésped se desconoce puesto que se ha detectado la presencia de cantidades considerables de vitaminas del grupo B en las heces (49).
La Microbiota Intestinal en la Salud y la Enfermedad
La microbiota intestinal desempeña un papel importante en la salud de los individuos y cumple funciones como: proteger al organismo contra la colonización de gérmenes patógenos, ayudar a regular el tránsito intestinal, conjugar los ácidos biliares, fermentar los carbohidratos no digeridos, producir vitaminas y factores de crecimiento, participar en la maduración del sistema inmunológico y mejorar o restablecer la homeostasis de la microbiota intestinal después de haber sido sometida a condiciones de estrés (52–54).
El tracto intestinal conforma un ambiente rico en nutrientes envasados con un máximo de 100 billones de microbios. La gran mayoría residen en el colon, donde se acercan a las densidades de 1011−1012 células/ml, las más altas registradas en cualquier hábitat microbiano (52, 55).
La complejidad del ecosistema microbiano intestinal ha sido estudiada y revisada extensamente durante los últimos años. El tracto gastrointestinal humano adulto contiene los tres dominios de la vida: Archae, Bacteria y Eukarya (19).
Y se encuentran representados en cuatro tipos bacterianos: Firmicutes (Gram-positivos), Bacteroidetes (Gram-negativos), Actinobacterias (Gram-positivas) y Proteobacterias (Gram-negativas) (53, 56). La concentración y complejidad de los microorganismos intestinales aumentan de manera progresiva desde el estómago hasta el ciego.
En el colon, más del 99% de las bacterias corresponden a las ya mencionadas; no obstante, existe una predominancia de Firmicutes con un 64% y Bacteroidetes con 23% (57). Los hongos y Archaea pueden ser también residentes, pero comprenden menos del 1% de la población total, lo que señala que el ecosistema intestinal está dominado claramente por las bacterias (56).
Antes del nacimiento, el tracto gastrointestinal es estéril y durante el parto se produce la primera exposición microbiana del recién nacido a la microbiota vaginal de la madre dando lugar a la colonización inicial del tracto gastrointestinal del recién nacido.
Esto se ha evidenciado gracias a la detección de diferencias en la microbiota intestinal de los niños nacidos por cesárea o por vía vaginal, reflejando la importancia de la vía de nacimiento en la conformación inicial de la microbiota intestinal del recién nacido (5).
Factores adicionales a esta exposición inicial también influyen en la composición de la microbiota intestinal normal incluyendo el pH, la motilidad intestinal, la temperatura, la concentración de oxígeno, el recambio epitelial y moco, entre otros (58).
Si bien hay diversidad en la composición bacteriana de recién nacidos y lactantes, se ha reportado que las bifidobacterias y otras bacterias productoras de ácido láctico constituyen la microbiota intestinal predominante en lactantes (59).
Adicionalmente, se ha logrado demostrar que la leche materna posee un efecto prebiótico gracias a la presencia de lactosa como carbohidrato fundamental, oligosacáridos variados y complejos principalmente galacto-oligosacáridos y ácido siálico presente en la alfa lactoalbúmina, los cuales desempeñan un papel importante en el desarrollo de la microbiota bifidógena del lactante (60).
El paso siguiente al destete consiste en la introducción de alimentación complementaria, en la cual se ajusta el perfil de la microbiota intestinal, haciéndola cada vez más similar al perfil de la microbiota de los adultos.
Este ecosistema varía en cada tramo del intestino, en composición y en número de especies bacterianas. Comprende la distribución en diferentes géneros como Lactobacillus y Bifidobacterium, además, algunas formulaciones pueden incluir algunas cepas de Streptococcus, Enterococcus, Pediococcus, Propionibacterium, Bacillus y Escherichia (61, 62).
En ese contexto, los probióticos se han utilizado para el tratamiento de un gran número de patologías pediátricas y del adulto, principalmente para el tratamiento de problemas gastrointestinales que cursan con la alteración en la microbiota intestinal incluyendo la diarrea infecciosa, la enterocolitis necrotizante y, más recientemente, en procesos inflamatorios crónicos como la enfermedad inflamatoria intestinal o en trastornos funcionales como el cólico del lactante o el estreñimiento.
También se ha valorado su efecto beneficioso en alteraciones inmunológicas como la dermatitis atópica y en la prevención y tratamiento de la alergia alimentaria. Si bien los probióticos suelen ser útiles en los procesos de rehidratación para tratar la diarrea infecciosa aguda de adultos y niños, se requieren más investigaciones para documentar el uso y pautas específicas del empleo de los probióticos en grupos concretos de pacientes (21).
Adicionalmente, la enterocolitis necrotizante (ECN) constituye una enfermedad grave que afecta al intestino de los neonatos prematuros en las primeras semanas de vida. Aunque la causa de ECN no se conoce completamente, la alimentación con lácteos y el crecimiento bacteriano desempeñan una función benéfica.
Los probióticos han sido utilizados para prevenir la ECN (63). La revisión de estudios Probiotics for prevention of necrotizing enterocolitis in preterm infants determinó que el uso de probióticos reduce la aparición de ECN y la muerte en los neonatos prematuros con menos de 1500 gramos de peso corporal (63).
La Diarrea Aguda Infecciosa
En el tratamiento de la diarrea aguda infecciosa, los probióticos participación mediante la implementación de mecanismos como la estimulación del sistema inmunitario, la competencia por los sitios de adherencia en las células intestinales y la elaboración de sustancias neutralizantes de microorganismos patógenos (28, 42).
Algunas investigaciones han mostrado que la administración oral de L. rhamnosus GG con uso profiláctico redujo significativamente el riesgo de diarrea nosocomial en los lactantes, especialmente en los casos de gastroenteritis nosocomial causada por rotavirus (28).
Esta misma cepa ha demostrado ser eficaz en el tratamiento de la diarrea aguda infantil, pero arroja resultados contradictorios en lo que respecta a la prevención de eccema y sensibilización atópica en niños con riesgo (64). Otro estudio demostró que el tratamiento con L. rhamnosus GG, L. reuteri y S. boulardii disminuyó la incidencia de la diarrea aguda infecciosa, luego del tercer día de tratamiento (65).
Sin embargo, es importante mencionar que los efectos de los probióticos no pueden generalizarse a las poblaciones de niños, adultos, mujeres en gestación o lactancia, o adolescentes, debido a que estos microorganismos pueden actuar de forma diferente en esos grupos.
Aunque en el caso de la prevención de la diarrea, se ha demostrado que suelen ser más eficaces para la prevención de ésta en niños que en adultos (15). En el caso de la diarrea del viajero, causada principalmente por E. coli (enterotoxigénica), el uso profiláctico de L. rhamnosus GG y S. boulardii ha demostrado ser útil en la disminución de la duración y prolongación del cuadro diarreico.
Conjuntamente, existe evidencia de que las cepas probióticas previenen la adhesión y el sobre crecimiento de bacterias Gram-negativas aerobias enterotóxicas y virus enteropatogénicos y, de esta manera, permiten la adherencia de organismos beneficiosos a la superficie intestinal y disminuyen el riesgo de padecer nuevamente dicha enfermedad (66, 67).
La Microbiota en la Enfermedad Inflamatoria Intestinal
Los avances en la investigación de la patogénesis de la inflamación intestinal aguda y crónica demuestran que los probióticos, prebióticos y simbióticos pueden ser útiles en el tratamiento de los trastornos inflamatorios del intestino.
Recientes investigaciones señalan diferencias importantes en la composición de la microbiota intestinal de pacientes con y sin enfermedad inflamatoria intestinal (21). Específicamente, se ha logrado demostrar una reducción en la diversidad de las bacterias intestinales, incluyendo especies de bifidobacterias, bacteroides y lactobacilos a la vez que ocurre un incremento de hongos y de bacteroides y E. coli adherente o invasiva (68).
Por otra parte, el uso de L. casei cepa Shirota ha mostrado un efecto positivo en el mejoramiento y la regulación de la enfermedad inflamatoria intestinal crónica, debido a una reducción en la producción de citoquinas como la interleucina 6 (IL-6) y el interferón gamma (IFN-γ) en la lámina propia de los especímenes de colon estudiados (28).
La administración de L. rhamnosus GG por un corto periodo de tiempo (10 días) produjo un aumento en las células secretoras de imunoglobina A (IgA) contra lactoglobulina y caseína en niños con la enfermedad de Crohn, lo que sugiere una estimulación de la respuesta inmunitaria intestinal.
En el caso de una administración a largo plazo (6 meses) se demostró que el probiótico induce una disminución de la permeabilidad de la mucosa intestinal con el propósito de normalizar la permeabilidad intestinal incrementada mejorando de esta manera la respuesta inflamatoria intestinal (69, 70).
La Terapia con Probióticos en Niños
De manera similar, en el caso de niños con estreñimiento, se ha observado una buena efectividad de la terapia con probióticos, pero no se encuentra establecida su eficacia en general para la edad pediátrica.
Sin embargo, el empleo de prebióticos como la fibra dietética soluble sí ha demostrado que aumenta la capacidad de retención de agua de las heces y estimula el crecimiento de las bifidobacterias probióticas, lo genera un incremento de la media de deposiciones y disminuye su consistencia (65).
Por otro lado, el tratamiento con L. rhamnosus GG previene la recurrencia de gastroenteritis después de un tratamiento con antibióticos, disminuyendo de un 60% a un 16% su incidencia en pacientes que recibieron tratamiento con Vancomicina o Metronidazol y se demostró que un 94% de los pacientes quedó libre de la enfermedad tras un segundo ciclo de tratamiento probiótico (71).
Así mismo, el consumo de leche con probióticos en un lactante de 14 meses de edad con rinorrea, tos seca, fiebre y dificultad respiratoria, resultó en una reducción significativa de bacterias patógenas en cavidades nasales, incluyendo S. aureus, S. pneumoniae y estreptococos del grupo beta-hemolíticos (71).
En el caso de las reacciones alérgicas, los probióticos son efectivos en la respuesta inmune y previenen que los niños sufran reacciones alérgicas, tal como lo demostró Castro y cols., (67) en un ensayo controlado con placebo en mujeres embarazadas que recibieron L. rhamnosus GG cuatro semanas antes del parto y quienes presentaron una disminución significativa de enfermedad atópica en el recién nacido.
Los estudios clínicos con L. rhamnosus GG y B. Lactis indicaron ser útiles en neonatos alérgicos a la leche de vaca. El resultado le otorga al organismo la habilidad para incrementar la permeabilidad intestinal, estimular la secreción de IgA, producir citoquinas reguladoras como la IL-10 y el factor de crecimiento transformante beta (TGF-β), citoquinas asociadas con la supresión de las células Th2, la reducción en la secreción de citoquinas pro-inflamatorias, con un control de la respuesta IgE y reducción de la inflamación alérgica en el intestino (67).
También, se ha demostrado a través de ensayos controlados que los probióticos (específicamente Lactobacillus rhamnosus cepa GG) administrados a las mujeres antes y después del parto, a madres que amamantan o directamente a los lactantes alimentados con lactancia artificial, disminuyen la incidencia de dermatitis atópica a la mitad de los lactantes hasta los cuatro años después del parto.
Resultado relacionado con la alteración de la microbiota especialmente de las bifidobacterias (64, 72). Tannock y cols., (73) demostraron que después de 1 y 6 meses del nacimiento se encontraba L. rhamnosus GG en las heces de cinco de los seis hijos nacidos de madres que habían consumido el probiótico y en dos de los niños tras haber alcanzado los 24 meses de edad (73).
Asimismo, se ha comprobado que los probióticos son importantes para la maduración de la inmunidad humoral en la primera infancia (52), para tratar y prevenir la diarrea infecciosa aguda de lactantes y niños (28) y se ha observado que los Saccharomyces boulardii y los Lactobacillus GG resultan beneficiosos en el tratamiento de la diarrea asociada al consumo de antibióticos (6), siempre que se administre al inicio de la terapia y no cuando ya se haya iniciado el cuadro (6).
En los Casos de Diarrea Persistente en Niños
La diarrea persistente se define como un episodio diarreico de inicio agudo, pero que luego se extiende por 14 días o más. Es una causa importante de morbilidad y mortalidad en niños menores de cinco años en los países en desarrollo. No se comprende del todo la causa de la diarrea persistente, aunque posee una naturaleza probablemente compleja, lo que dificulta a su vez el tratamiento de la patología (74, 75).
La revisión por llevada a cabo por The Cochrane Collaboration encontró cuatro ensayos que incluyeron niños con diarrea persistente. Dos estudios, con un total combinado de 324, mostraron que los probióticos disminuyen la duración de la diarrea y la frecuencia de las heces al día 5.
Una investigación desarrollada con 235 niños sugirió que los probióticos reducen la estancia hospitalaria. Tres de los cuatro ensayos informaron que no hubo eventos adversos. Sin embargo, esta revisión se ve limitada por el reducido número de ensayos con pocos participantes, y por lo tanto, puede no representar una estimación fiable del efecto de los probióticos en estos pacientes (74).
Diarrea Asociada al Clostridium Difficile
Los antibióticos se encuentran entre los medicamentos más prescritos en todo el mundo. El tratamiento con antibióticos puede alterar el equilibrio de los microorganismos que habitan normalmente en los intestinos, lo cual puede resultar en una diversidad de síntomas adversos, en particular, la diarrea.
El Clostridium difficile es un organismo particularmente peligroso que puede colonizar los intestinos cuando el equilibrio saludable normal ha sido alterado. Las enfermedades relacionadas con el Clostridium difficile pueden describir desde la infección asintomática, la diarrea, la colitis y la colitis pseudomembranosa, hasta la muerte. El costo del tratamiento es elevado y la carga económica en el sistema médico resulta considerable (76).
Por otra parte, los probióticos se encuentran disponibles cada vez más en forma de cápsulas y suplementos alimentarios que se venden en tiendas de alimentos naturales y supermercados, pues se consideran ‘alimentos funcionales’ o ‘buenas bacterias’. Adicionalmente, se ha sugerido que los probióticos conforman un medio, tanto para prevenir, como para tratar la diarrea asociada al C. difficile (DACD) (76).
Una revisión referenciada por The Cochrane Collaboration incluye 31 ensayos aleatorios con un total de 4492 participantes. Veintitrés estudios (con 4213 participantes) evaluaron la efectividad de los probióticos para la prevención de la DACD en participantes que reciben antibióticos.
Los resultados señalan que al administrar probióticos con antibióticos, los mismos reducen el riesgo de desarrollar DACD en un 64%. Los efectos secundarios se evaluaron en 26 estudios (con 3964 participantes) y los resultados sugieren que los probióticos disminuyen el riesgo de desarrollar efectos secundarios.
De estos, los más frecuentes informados incluyen dolor abdominal, náuseas, fiebre, heces blandas, flatulencias y trastorno del gusto. En consecuencia, el uso a corto plazo de probióticos parece ser seguro y efectivo, cuando se administran junto con antibióticos en pacientes que no están gravemente debilitados ni inmunocomprometidos (76).
Los Probióticos y la Inmunidad
Los mecanismos de interacción de los probióticos con el sistema inmune son diversos (21). Las investigaciones basadas en estudios con las bacterias del ácido láctico han demostrado el efecto inmunoestimulante de los probióticos en los animales y en los seres humanos (5, 77).
Este efecto está relacionado con la capacidad de los microorganismos probióticos para interactuar con las placas de Peyer y las células epiteliales intestinales; estimular las células B productoras de IgA para la protección de las mucosas (78) y la migración al intestino de las células T. Estas bacterias ácido lácticas también pueden ser captadas por las células M presentes en el epitelio y facilitar la estimulación del tejido linfoide asociado a la mucosa intestinal (79).
Las células dendríticas pueden capturar bacterias probióticas al tener prolongaciones citoplasmáticas que pueden acceder al espacio luminal. Muchos de los efectos inducidos por los probióticos dependen de la interacción del microorganismo con la célula dendrítica, dada la capacidad que posee de polarizar la respuesta inmunológica adaptativa.
El efecto sobre la maduración de esta célula presentadora de antígeno y en su producción de citoquinas depende de la cepa del probiótico, gracias a lo cual se observan casos de inhibición o estimulación de la producción de citoquinas IL-10 e IL-12, lo cual puede favorecer un estado de tolerancia o una respuesta inmune Th1 respectivamente (80).
Los efectos observados dependen del tipo celular estudiado. Mientras en células derivadas del bazo el Lactobacillus casei induce una fuerte respuesta Th1, valorada de acuerdo a los niveles de IL-12 producidos; en las placas de Peyer el efecto inductor por la producción de IL-12 es más bajo (81).
Algunos trabajos de investigación sugieren que la microbiota intestinal podría ser un factor indispensable para el equilibrio entre las respuestas inmunitarias mediadas por los linfocitos Th1 y Th2, importantes en el proceso de inmunomodulación (82).
Los Ligandos de Receptor Tipo Toll y las Células Epiteliales Intestinales
Las células epiteliales intestinales se encuentran sometidas constantemente a estrés citotóxico, metabólico y patogénico que puede producir una rotura en la barrera intestinal, el paso de componentes microbianos y la respuesta proinflamatoria correspondiente (24, 43).
Actualmente, se discute el rol que desempeñan los factores externos, como la dieta en la modificación de la microbiota intestinal, en las poblaciones que producen una ruptura de la integridad de la barrera intestinal y el desarrollo de un estado inflamatorio crónico asociado a la obesidad.
De forma general, hay dos tipos de receptores de reconocimiento de patrones bacterianos (PRRs, por sus siglas en inglés) en nuestro organismo: los llamados receptores tipo Toll (TLRs, por sus siglas en inglés) y los receptores tipo NOD (NLRs, por sus siglas en inglés) que pueden activar el sistema inmune mediante una respuesta inflamatoria. La mayor parte de los TLRs constituyen receptores de superficie mientras que los NOD (NOD1 y NOD2) son citoplasmáticos (43).
Las bacterias comensales secretan ligandos de receptor tipo Toll (TLR) que se unen a TLR sobre la superficie del tejido intestinal normal. Esta interacción estimula la emisión de señales basales que protegen contra el desarrollo de una lesión celular.
La alteración de señales de TLR, o la erradicación de bacterias comensales vinculada con el uso de antibióticos produce la alteración de la capacidad del epitelio intestinal para soportar lesión y reparar el daño celular (24).
Los Probióticos en la Industria
Como parte de la microbiota del hombre, las bacterias desempeñan acciones positivas de protección, regulación, fermentación y descomposición del material alimenticio consumido. Por estas razones, los probióticos se comercializan como cultivos microbianos, congelados y deshidratados (1).
Para poder usar un probiótico como un producto farmacéutico, éste debe cumplir con algunas condiciones de estabilidad durante el proceso de producción, comercialización y distribución. Estas características las poseen, principalmente las bacterias de los géneros Lactobacillus, Bifidobacterium (ambas productoras de ácido láctico) y los enterococos; aunque también se utilizan hongos como el Saccharomyces cerevisiae y algunas especies de E. coli y Bacillus (83).
Además, las bacterias de ácido láctico (LAB), entre las que se encuentra la especie Lactobacillus, han sido utilizadas durante miles de años para la conservación de alimentos mediante fermentación y pueden ejercer una función doble, actuando como agentes fermentadores de alimentos y generar efectos benéficos para la salud (10).
Los alimentos probióticos que contienen β-galactosidasa apaciguan los problemas de digestión de la lactosa (7). Por otra parte, los derivados lácteos como el yogurt y las leches fermentadas ejercen efectos positivos para el del tracto gastrointestinal (84).
El yogurt es un gel de apariencia viscosa, resultante de la acidificación microbiana de la leche, en este proceso de fermentación ácido láctica intervienen las bacterias Lactobacillus delbrueckii subsp bulgaricus y Streptococcus salivarus subsp thermophilus, las cuales deben encontrarse en relación 1:1 para una acción simbiótica efectiva.
Además, el yogurt probiótico incrementa su valor terapéutico ayudando a los consumidores a ingerir alimentos nutricionales que produzcan beneficios adicionales para la salud (85).
La lactulosa, un disacárido sintético distribuido comercialmente y su derivado el lactitol generan efectos favorables sobre las afecciones del colon. Estos dos compuestos no se absorben por lo que pasan prácticamente sin alterar el colon, donde sirven como fuente de energía para la microbiota actuando como prebióticos.
Durante la fermentación de la lactulosa, se forman ácidos grasos de cadena corta, lo que conlleva a la modificación del pH del colon y, este evento junto con la estabilización de la microbiota gastrointestinal, ejercen una acción favorable sobre la diarrea, que, en conjunto con el incremento de los movimientos intestinales y la propia compensación de la microbiota, también producen una acción favorable contra el estreñimiento (7, 14, 86, 87).
Las empresas que comercializan probióticos tienen la necesidad de obtener una biomasa muy elevada de forma económicamente rentable y con la concentración de bacterias viables necesarias para permitir que el efecto beneficioso se mantenga hasta el final de la vida útil del producto (61).
Sin duda existen algunos productos en el mercado de dudoso valor que son considerados como probióticos y las afirmaciones que se hacen sobre ellos son exageradas (88), por eso no se debe negativizar la investigación seria sobre los probióticos y la comprobación de su eficacia.
En algunos aspectos, algunas prácticas comerciales crean una impresión muy simplista de los complejos problemas que restan por aclarar todavía en relación con los probióticos y que se conocerán cada vez mejor a medida que se adquiera más información sobre el equilibrio y las condiciones de la microbiota intestinal normal (89).
Estos productos también poseen una dosis específica. No es posible establecer una dosis mínima que se aplique a todos los probióticos, ya que cada uno tiene una acción y efectividad en diferentes niveles del organismo (16, 90).
Conclusiones
La importancia de los probióticos se refleja en el beneficio que obtiene el organismo en el mejoramiento de las propiedades de la microbiota y la participación en la maduración de la inmunidad humoral en la primera infancia.
Por otra parte, el tracto gastrointestinal constituye una de las principales zonas de contacto con microorganismos potencialmente nocivos como, bacterias y virus. Considerando la cantidad funciones benéficas que cumplen los probióticos en la prevención y o tratamiento de lagunas enfermedades, éstos deberían ser tenidos en cuenta para ser implementados en los protocolos médicos para el tratamiento de entidades como diarrea aguda en neonatos y ancianos, alergias, enfermedades del colón, etc.
Adicionalmente, se requieren mayores estudios sobre probióticos, que contribuyan al mejoramiento del estado de salud por las funciones nutritivas, de protección, desarrollo y proliferación celular e inmunomodulación.
Referencias
1. Qin J, Li R, Raes J, Manimozhiyan A, Slovsten K, Manichanh C, et al. A human gut microbial gene catalog established by metagenomic sequencing. Nature. 2010 Mar; 464 (1): 59–65.
2. Lilly D, Stillwell R. Probiotics: Growth-promoting factors produced by microorganisms. Science. 1965 Feb; 147 (3659): 747–8.
3. Dos Santos F, Ferreira F, Nicoli JR. O probiótico Saccharomyces boulardii. Rev Biol e Ciencias da Terra. 2009; 9 (2): 171–81.
4. Zalba JI, Flichy AJ. Empleo de probióticos en odontología. Nutr Hosp. 2013 Ene; 28 Supl. 1: S49–50.
5. Arribas MB. Probióticos : una nueva estrategia en la modulación del sistema inmune [Tesis doctoral]. Granada: Universidad de Granada; 2009.
6. Oliveira G, González I. Probióticos y prebióticos en la práctica clínica. Nutr Hosp. 2007; 22 Supl. 2: S26–34.
7. Willyard C. Gut reaction: microbes are under the spotlight in efforts to unravel and combat allergies. Nature. 2007; 479 Supl. 5: 7–9.
8. Fuller R. Probiotics in man and animals. J Appl Bacteriol. 1989 May; 66 (5): 365–78.
9. Reyes JA, Rodríguez L. ¿ Qué sabe Ud . acerca de… los probióticos? Rev Mex Ciencias Farm. 2010 Mar; 41 (1): 60–3.
10. World Gastroenterology Organization. Probióticos y prebióticos. Wisconsin: WGO; 2008.
11. Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota in health and disease. Phisiol Rev. 2010 Jul; 90 (3): 859–904.
12. Allen SJ, Martinez EG, Gregorio GV, Dans LF. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev. 2010 Nov; 11: (CD003048).
13. Mcphee SJ. Fisiopatología de la enfermedad: una introducción a la medicina Clínica. 6a Ed. Madrid: McGrawHill; 2010.
14. Silla Mh. Dieta mediterranea y alimentos funcionales (Seguridad Alimentaria). Valencia: UPV; 2004.
15. Marzal MB, CM. Manrique S, Fernández CM. Empleo clínico de los probióticos y aspectos prácticos de su empleo. Nutr Hosp. 2013;28 Supl. 1: S168–70.
16. Johansson ML, Molin G, Jeppsson B, Nobaek S, Ahrné S, Bengmark S. Administration of different Lactobacillus strains in fermented oatmeal soup: in vivo colonization of human intestinal mucosa and effect on the indigenous flora. Appl Environ Microbiol. 1993 Ene; 59 (1): 15–20.
17. World Gastroenterology Organization. Guía Práctica de la Organización Mundial de Gastroenterología: Probióticos y prebióticos. EEUU: WGO; 2011.
18. Shukla S., Shukla A., Mehboob S, Guha S. Meta-analysis: the effects of gut flora modulation using prebiotics, probiotics and synbiotics on minimal hepatic encephalopathy. Aliment Pharmacol Ther. 2011 Mar; 33 (6): 662–71.
19. Panisello J. Nutrición e inversión en salud: microbioma y probióticos (los probióticos en la prevención y el tratamiento de enfermedades pediátricas; evidencias científicas). Pediatría Atención Primaria. 2011; 13 Supl. 20: 25–41.
20. González F, González BE. Criterios de calidad de los microorganismos probióticos y evidencias sobre efectos hipocolesterolémicos. Salus cum propositum vitae[Internet]. 2006 Mar [Citado el 29 jul. 2016]; 7 (1): [aprox. 4 p.]. Disponible en: http://www.respyn. aunl.mx/vii/1/ensayos/criterios.htm
21. Bennett JE, Dolin R, Mandell G. Principles and Practice of Infectious Diseases. 8va Ed. New York: ELSEVIER; 2015.
22. Delgado S. Microbiota intestinal humana: análisis y evolución de poblaciones representativas e iden-tificación de bacterias probióticas [Tesis]. Oviedo: Universidad Oviedo; 2005.
23. Suárez JE. Microbiota autóctona, probióticos y prebióticos. Nutr Hosp. 2013; 28 Supl. 1: S3–9.
24. Madara J. Building an Intestine Architectural Contributions of Commensal Bacteria. N Engl J Med. 2004 Oct; 351 (16): 1685–6.
25. Romero M, Menchén L. Probióticos: nuevas líneas de investigación y aplicaciones terapéuticas en pa-tología digestiva. Nutr Hosp. 2013; 28 Supl. 1: S1–3.
26. Vargas F. Probióticos en enfermedades del tubo digestivo. Rev Gastroenterol México. 2011; 76 Supl. 2: 30–1.
27. Cisternas D. El uso de probióticos en algunas enfermedades gastrointestinales. Medwave. 2011 Jun; 11 (06): 1–3.
28. Peña AS. Flora intestinal , probióticos , prebióticos, simbióticos y alimentos novedosos. Rev esp enfer dig. 2007; 99 (11): 653–8.
29. Monroy MC, Castro T, Castro J, Castro G, de Lara R. Beneficios del uso de los probióticos en la flora bacteriana intestinal de los organismos acuaticos. Contactos. 2012; 85: (11-18).
30. Benítez Bribiesca Luis. El microbioma. Acta Médica Grup Ángeles. 2012; 10 (4): 220–3.
31. Isolauri E, Kirjavainen PV, Salminen S. Probiotics: a role in the treatment of intestinal infection and inflammation? Gut. 2002 May; 50 Supl. 3: S54–9.
32. Mack DR, Michail S, Wei S, McDougall Laura, Hollingsworth MA. Probiotics inhibit enterophatogenic E. coli adherence in vitro by inducing intestinal mucin gene expression. Am J Physiol. 1999 Abr; 276 (4 Pt. 1): G941–50.
33. Saavedra JM, Bauman NA, Oung I, Perman JA, Yolken RH. Feeding of Bifidobacterium and Streptococcus thermophilus to infants in hospital for prevention of diarrhoea and shedding of Rotavirus. Lancet. 1994 Oct; 344 (8929): 1046−9.
34. Isolauri E, Juntunen M, Rautanen TC, Sillanaukee P Koilvula T. A human Lactobacillus strain In, (Lacto-bacillus casei sp strain GG) promotes recovery from acute diarrhoea. Child Pediatr. 1991 Jul; 88 (1): 90–7.
35. Ruiz V, Puig Y, Rodríguez M. Microbiota intestinal, sistema inmune y obesidad. Rev Cuba Invest Biomed [Internet]. 2012 [Citado el 29 de Jul 2016]; 29 (1): [aprox. 14 p.]. Disponible en: http://www.bvs.sld.cu/ revistas/ibi/vol29_3_10/ibi07310.htm.
36. Díaz V. El microbioma humano y su potencial biotecnológico. 2010 Septiembre 28 [Citado el 29 de julio de 2016]. En: Biotech Spain [Internet]. España: Web 4 bio. [aprox. 1 screen]. Disponible en: https:// biotechspain.com/es/tema.cfm?iid=microbioma
37. Cho I, Blasé MJ. The human microbiome: at the interface of health and disease. Nat Rev Genet. 2012 Abr; 13 (4): 260–70.
38. Guarner F. Papel de la flora intestinal en la salud y en la enfermedad. Nutr Hosp. 2007; 22 Supl. 2: S318–31.
39. Salvucci E. El agotamiento del bioma y sus consecuencias. Acta Biol Colomb. 2013; 18 (1): 31−42.
40. Hattori M, Taylor DT. The Human Intestinal Microbiome: A New Frontier of Human Biology. Oxford Journals. 2009 Feb; 16 (1): 1−12.
41. Palmer C, Bik EM, DiGiulio DB, Relman D, Brown P. Development of the human infant intestinal mi-crobiota. PLOS Biol. 2007 Jun; 5 (7): e-177. Epub 2007 Jun 26.
42. Guillermo Cárdenas Guzmán. El microbioma humano. Periodico El Universal,. Mexico; 2004;10–4.
43. Harris K, Kassis A, Major G, Chou C. Is the Gut Microbiota a New Factor Contributing to Obesity and Its Metabolic Disorders? J Obes. 2012; 1 (1): 14.
44. Parracho H, McCartney AL, Gibson GR. Probiotics and prebiotics in infant nutrition. Proc Nutr Soc. 2007 Ago; 66 (3): 405–11.
45. Guarner F. Papel de la flora intestinal en la salud y en la enfermedad. Nutr Hosp. 2007; 22 Supl. 2: 14–9.
46. Nicholson JK, Holmes E, Kinross J, Burcelin R, Gibson G, Jia W, et al. Host-Gut microbiota metabolic interactions. Science. 2012 Jun 8; 336 (6086): 1261–7.
47. Martinez C,. Mesa M. Probióticos: ¿fantasía o realidad? An Med Interna. 2005 Feb; 22 (2): 53–4.
48. [Apellido del autor] CB M. Microbiota y aparato digestivo. Rev española enfermedades Dig. 2001; 93 (5): 325–7.
49. Sanz Y, Collado MC, Haros J, Dalmau J. Funciones metabolico- nutritivas de la microbiota intestinal y su modulación a través de la dieta : probióticos y prebióticos. Acta Pediatr Española. 2004; 62 (11): 520–6.
50. Hooper LV, Midtvedt T. Gordon J. How host microbial interactions shape the nutrient environment of the mammalian intestine. Annu Rev Nutr. 2002; 22: 283–307. Epub 2002 Abr 4.
51. Deguchi Y, Morishita T, Mutai M. Comparative studies on synthesis of water soluble vitamins among human species of bifidobacteria. Agric Biol Chem. 1985; 49 (1):13–9.
52. Ley RE, Peterson DA, Gordon JI. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell. 2006 Feb 24;124 (4): 837–48.
53. Korecka A; Arulampalam V. The gut microbiome: Scourge, sentinel or spectator? J Oral Microbiol. 2012; 4(1): 9367. Epub 2012 Feb 21.
54. Peterson J, Garges S, Giovanni M, McInnes P, Wang L, Schloss J, et al. The NIH human microbiome project. Genome Res. 2009 Dic; 19 (1): 2317–23.
55. Kim G, Deepinder F, Morales W, Hwang L, Weitsman S, Chang C, et al. Methanobrevibacter smithii is the predominant methanogen in patients with constipation-predominant IBS and methane on breath. Dig Dis Sci. 2012 Dic; 57 (12): 3213–8.
56. Bibiloni R, Membrez M, Chou JC. Microbiota intestinal, obesidad y diabetes. Ann Nestlé. 2009; 67 (1): 39–48.
57. Rodrigo L. Tratamiento de las Enfermedades Digestivas. Madrid: Editorial Médica Panamericana; 2008.
58. Ballabriga A (Universidad Autónoma de Barcelona. Departamento de Pediatría). Probioticos en neona-tología. Informe; 2002.
59. Gamiño AE, Barrios MP, Cárdenas LP, Anaya F, Padilla F. Flora normal, probióticos y salud humana. Acta Univ. 2005 Dic; 15 (3): 34–40.
60. Pascual MJ. Uso de prebióticos y probióticos en las fórmulas lácteas infantiles. Nutr Hosp. 2013; 28 Supl. 1: S53–5.
61. Rodríguez JM. Probióticos: del laboratorio al consumidor. Nutr Hosp. 2015; 31 (1): 33–47.
62. Rescigno M. Di Sabatino A. Dendritic cells in intestinal homeostasis and disease. J Clin Invest. 2009 Sept; 119 (1): 2441–50.
63. AlFaleh K, Anabrees J, Bassler D, Al- Kharfi T. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst Rev. 2011 Mar 16; 4 (3): CD005496.pub3
64. Boyle RJ, Ismail IH, Kivivuori S, Licciardi PV, Robins-Browne RM, Mah LJ, et al. Lactobacillus GG treatment during pregnancy for the prevention of eczema: a randomized controlled trial. Allergy. 2011 Abr; 66(4): 509–16.
65. Riechmann R. Empleo de probióticos y prebióticos en pediatría. Nutr Hosp. 2013; 28 (1): 38–45.
66. Kanh M, Fuentes F, Villarroel G. Probióticos en diarrea aguda infecciosa. Rev Chii Pediatr. 2009; 80 (2): 129–36.
67. Castro LA, de Rovetto C. Probióticos: utilidad clínica. Colomb Med. 2006; 37 (4): 308–14.
68. Ng S. C., Hart A. L., Kamm M. A., Stagg A. J. KSC. Mechanisms of action of probiotics: recent advances. Inflamm Bowel Dis. 2009 Feb; 15 (2): 300–10.
69. Borruel N, Casellas F, Guarner F. Probióticos y enfermedad inflamatoria intestinal. Gastroenterol Hepatol. 2013; 25 (9): 46–53.
70. Cuellar S, Blanes A, Dauder B, Diez LM, Espada I, Fernández C, et al. Diarrea aguda y crónica. Panor Actual Med. 2010; 34: 705–832.
71. Bardón B, Santos MM. Empleo de alimentos funcionales y probióticos en la prevención de enfer-medades infecciosas y alérgicas. Nutr Hosp. 2013 Feb; 28 (1): 65–7.
72. Lawrence D, Rosen DS. Clínicas pediátricas de Norteamérica. Volumen 54. Barcelona: Saunders; 2007.
73. Tannock GW. Can the gut microflora of infants be modified by giving probiotics to mothers? J Pediatr Gastroenterol Nutr. 2004 Mar; 38(3): 244–6.
74. Bernaola G, Bada CA, Carreazo NY, Rojas RA. Probiotics for treating persistent diarrhoea in children. Cochrane Database Syst Rev. 2010 Nov; 8 (11): CD007401.pub2
75. Loh G, Blaut M. Role of comensal gut bacteria in inflammatory bowel diseases. Gut Microbes. 2012 Dic; 3 (6): 544–55.
76. Goldenberg JZ, Ma S, Jane D, Martzen MR, Vandvik PO, Thorlund K, et al. Probióticos para la preven-ción de la diarrea asociada al Clostridium difficile en adultos y niños. Cochrane Database Syst Rev. 2006; 5 (3):CD006095.
77. Vásquez MA, Rondón IS, Eslava-Mocha PR. Inmunoestimulantes en teleosteos : Probióticos, b-glucanos y LPS. Orinoquia. 2012; 16 (1): 46–62.
78. Blanco S, Canseco X, Vérez L. La olvidada IgA. Cad Aten Primaria. 2010; 17: 214.
79. Manzano C, Estupiñán D, Poveda E. Efectos clínicos de los probióticos: qué dice la evidencia. Rev Chil Nutr. 2012 Mar; 39 (1): 98–110.
80. Fink LN, Zeuthen LH., Christensen HR, Morandi B., Frøkiaer H, Ferlazzo G. Distinct gut derived lactic acid bacteria elicit divergent dendritic cell-mediated NK cell responses. Int Immunol. 2007 Dic; 19 (12): 1319–27.
81. Chiba Y, Shida K, Nagata S, Wada M, Bian LW, Wang C, et al. Well-controlled proinflammatory cytokine responses of Peyer’s patch cells to probiotic Lactobacillus casei. Immunology. 2010 Jul; 130 (3): 352–62.
82. Davila AM. Estudio sobre la viabilidad y los efectos sobre el sistema inmunitario de Probióticos Inmuno. España: Ysonut; 2010.
83. Fotiadis CI, Stoidis CN, Spyropoulos BG, Zografos ED. Role of probiotics, prebiotics and synbiotics in chemoprevention for colorectal cancer. World J Gastroenterol. 2008 Nov; 14 (42): 6453–7.
84. Taranto MP, Médici M, Font G. Alimentos funcionales probióticos. Química viva. 2005; 4 (1): 26–34.
85. Ruiz J.A, Ramírez AO. Elaboración de yogurt con probióticos (Bifidobacterium spp. y Lactobacillus acidophilus) e inulina. Rev Fac Agron. 2009; 26 (2): 223–42.
86. Joyanes M, Marcos A. Probióticos : características nutricionales y factores implicados. 2001; 7 (1−2): 28–33.
87. Lee YK. Mazmanian SK. Has the microbiota played a critical role in the evolution of the adaptive immune system? Science. 2010 Ago; 330 (6012): 1768–73.
88. Larkin M. Probiotics strain for credibility. Lancet. 1999 Nov; 355(1): 414.
89. Tannock GW. Probiotics: a Critical Review. J Antimicrob Chemother. 1999; 43 (1): 849–52.
90. Sanders ME. How Do We Know When Something Called “Probiotic” Is Really a Probiotic? A Guideline for Consumers and Health Care Professionals. Funct Food Rev. 2009; 1 (1): 3–12.
Recibido: 29 de junio de 2016
Aceptado: 7 de septiembre de 2016.
Correspondencia:
hipocratesjsst@hotmail.com
