Metodología del Ensayo
Metodología del Ensayo

Diseño y Condiciones Del Perfil
1.1 Producto a evaluar:
 1.2 Productos referencia:
1.2 Productos referencia:

1.3 Tiempos de muestreo:
5 – 10 – 15 – 30 y 45 minutos
1.4 Medios evaluados:
Buffer pH 1,2 USP
Solución amortiguadora de Acetato pH 4,5
Solución amortiguadora de Fosfato pH 6,8
1.5 Volumen: 900 ml
1.6 Equipo (Aparato): II (paletas)
1.7 Revoluciones: 75 rpm
1.8 Unidades evaluadas de cada producto: 12
Metodología del Ensayo
El perfil de disolución comparativo para el producto ATENOLOL 100 mg de Laboratorios Genfar S.A se realizó utilizando como referencia el producto TENORMIN (Atenolol 100 mg) de Laboratorios AstraZeneca, de acuerdo a la metodología de la FDA y las condiciones especificadas en las validaciones B-006-17, B-007-17 y B-008-17 de Quasfar M&F S.A..
Metodología Analítica HPLC-UV
Especificaciones de acuerdo a FDA
 Conclusión
Conclusión
Al realizar los perfiles de disolución en las condiciones establecidas se incluye:
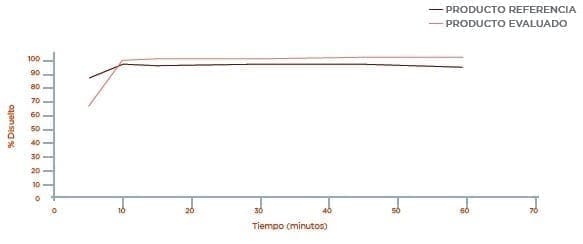
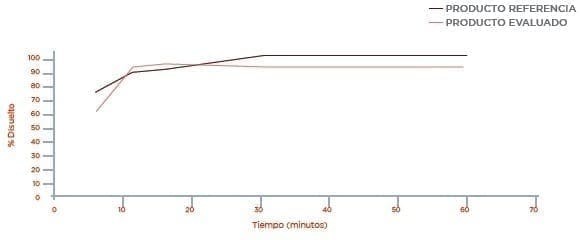
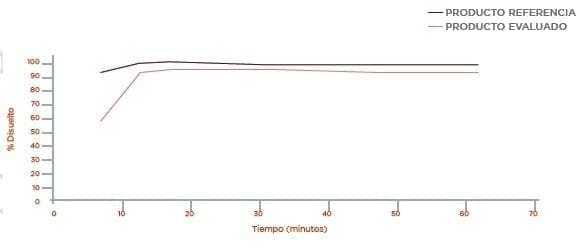
3.1 Los resultados obtenidos en el perfil de disolución comparativo para el producto ATENOLOL 100 mg de Laboratorios Genfar S.A y el producto de referencia TENORMIN (Atenolol 100 mg) de Laboratorios AstraZeneca, presentan una disolución muy rápida por disolverse más del 85 % en los primeros 15 minutos.
Perfil de disolución Medio Buffer pH 1,2 USP

Disolución Medio Buffer Acetato pH 4,5

Perfil de disolución Medio Buffer Fosfato pH 6,8
–Estudio en revisión por INVIMA –
MATERIAL DISEÑADO CON FINES EDUCATIVOS Y DIRIGIDOS AL CUERPO MEDICO.
Información prescriptiva completa a disposición del médico, en la Dirección Medica de Sanofi Aventis de Colombia S.A.
Transversal 23 N 97-73, Ed.City Business, Pisos 8 y 9, Bogotá D.C. Tel: (1) 6214400 – Fax: (1) 7444237


 Metodología del Ensayo
Metodología del Ensayo 1.2 Productos referencia:
1.2 Productos referencia: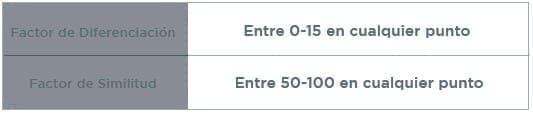 Conclusión
Conclusión