En el periodo de transición en el climaterio (45-55 años), debido inicialmente a la disminución del estradiol (E2)/progesterona (P), y como consecuencia del aumento de la FSH y LH, se presentan una serie de síntomas y signos que conforman lo que se conoce como «síndrome climatérico». Posteriormente, la pérdida progresiva de los estrógenos lleva a modificaciones en la estructura ósea en sus manifestaciones de osteopenia y osteoporosis. En la parte vascular se inicia la formación de placa arterioesclerótica, con disminución del flujo, hipertensión, arterioesclerosis y trombosis22. Existe un mecanismo interesante donde el aumento de peso a expensas del tejido adiposo en forma fisiológica aporta niveles de estrona (E1) y estriol (E3) que junto con las hormonas sexuales de la suprarrenal mantienen unos niveles de hormonas esteroideas hasta la vejez10. El síndrome climatérico se acentúa cuando se presenta falla ovárica prematura (FOP) o en los casos de ooforectomía antes de los 45 años34. Durante este periodo se ha documentado un aumento moderado del IMC35 y la presión arterial36, calcificación de la aorta22, una disminución de la vasodilatación mediada por flujo a nivel endotelial21 y alteración en el perfil lipídico37.
En relación con los antecedentes familiares en un estudio similar realizado en Bogotá54 se encuentran cifras con grandes diferencias, posiblemente por la forma como se elaboró la pregunta. En el primer estudio se solicita solo la información; en el estudio ECCO, si la respuestaera afirmativa o negativa. En estas condiciones, los antecedentes de hipertensión en el presente estudio son menores: hipertensión (89.5 vs. 35%), infarto (57.4 vs. 26.8%), diabetes (82.2 vs. 28.5%), dislipidemia (41.5 vs. 28%), hipotiroidismo (44.4 vs. 24.8%), osteoporosis (54.6 vs. 20.8%) y cáncer mama (55.6 vs. 21.1%). Los datos sobre osteoporosis y diabetes se en cuentran dentro de los valores descritos para el país39,40.
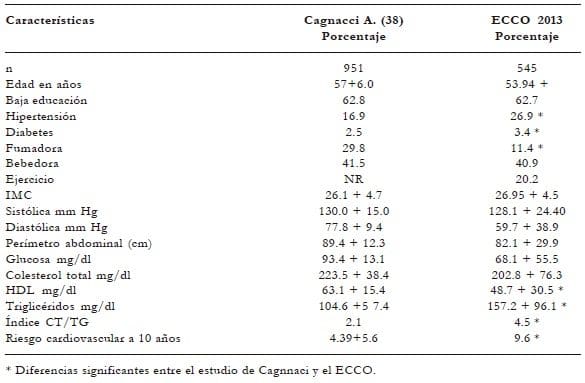
Al comparar los resultados de un estudio de Gagnacci en Italia38 sobre 951 mujeres posmenopáusicas (tabla 8), evaluando algunas características sociodemográficas, estilo de vida, parámetros físicos y paraclínicos, se observa: la edad promedio entre estos dos grupos fue menor en el nuestro (57 vs. 54 años); el nivel educativo, similar (63%); y los niveles de hipertensión, mayores en nuestra población (16.9% vs. 62.7%) así como la diabetes (2.5% vs. 3.4%). De acuerdo con los estilos de vida saludable, nuestras mujeres fuman menos que las europeas (29.8 vs. 11.4%) y el consumo de alcohol es similar (41.5 vs. 40.9%). El ejercicio no fue reportado en el estudio italiano; no obstante, en nuestra muestra el sedentarismo se presenta en un 80%.
La enfermedad cardiovascular (ECV) es una de las principales entidades que causa una alta tasa de morbilidad en el mundo en ambos sexos. En el estudio Global Interhearth Study en el 2004, la ECV fue causa de muerte en el 32% en mujeres y 27% en los hombres alrededor del mundo41. En Europa fue de 54% en mujeres y 43% en hombres, siendo la enfermedad isquémica de miocardio la etiología más frecuente. En Estados Unidos, para el 2007, el número total de 2.427.120 defunciones, de las cuales 616.067 ocurrieron por enfermedad cardiovascular, 562.875 por neoplasias y 135.952 por enfermedad cerebrovascular 42. En Colombia, durante el 2010, las enfermedades cardiocirculatorias fueron la primera causa de mortalidad en la mujer, produciendo 28.888 muertes (32.24%); y la segunda, las enfermedades neoplásicas, ocasionando 18.412 muertes (20.55%)43. Los eventos cardiovasculares tienen un origen multifactorial que incluye factores genéticos, medioambientales, de estilos de vida, nutricionales, biológicos y metabólicos. Las hormonas esteroideas juegan un papel importante en el desarrollo de la ECV, pues marcan diferencias epidemiológicas, de diagnóstico y de manejo entre el hombre y la mujer44. Se ha podido demostrar que las mujeres premenopáusicas que presentan infarto del miocardio (IM) tienen un pobre pronóstico frente a los hombres45. En la evaluación del riesgo cardiovascular se han utilizado diferentes métodos, de los cuales se destaca la escala de Framingham (ERF); basada en la cohorte del estudio del corazón en Framingham, incluye edad, género, colesterol, cigarrillo y presión arterial, y predice cambios cardiacos a 10 años46. Esta escala subestima el riesgo de enfermedad coronaria en mujeres. La escala de riesgo de Framingham basada en el ATP III, no predice la angina ni el riesgo de revascularización47. La escala de riesgo de Reynols (ERR), si bien incorpora la historia familiar y biomarcadores, y estratifica el riesgo en alto y bajo, al ser comparada con la ERF muestra unos datos muy modestos48. La Sociedad Europea de Cardiología propone el uso de la escala SCORE que es una alternativa para cálculo del riesgo global cardiovascular49.
El aumento de la tensión arterial se presenta con más frecuencia en hombres que en mujeres, pero después de la menopausia estos valores se incrementan en estas últimas. Fuera de los factores de riesgo y estilos de vida, los valores tanto sistólicos como diastólicos se aumentan más en mujeres afrodescendientes que en mujeres blancas. El 75% de las mujeres afroamericanas sufren de hipertensión después de los 75 años50. La tensión arterial media en el presunto estudio evidencia una diferencia significativa (p < 0.001) entre las mujeres menores y las mayores de 50 años. Al comparar con el estudio italiano38 las tensiones sistólicas y diastólicas no hay diferencias en entre estos dos estudios (130 x 80 mm Hg vs. 128 x 60 mm Hg). Tabla 8.
Tabla 8. Características clínicas y paraclínicas de un estudio europeo
y el estudio ECCO en mujeres en su periodo de transición
Se ha postulado que después de la menopausia la mujer presenta un aumento de peso con un cambio en su distribución grasa, con un aumento del tejido adiposo a nivel abdominal. Este aumento de la obesidad abdominal incrementa el riesgo de enfermedad cardiovascular, hipertensión, diabetes, apnea del sueño, cáncer endometrial, osteoartritis, disfunciones del comportamiento y deterioro progresivo de su calidad de vida51. Otro de los factores comprometidos en el aumento del tejido adiposo son las hormonas esteroides y la globulina transportadora de hormonas sexuales (SHBG) que interviene en la composición de la masa magra y el peso del cuerpo52.
El índice de masa corporal (IMC) ha sido otra medida clásica en la evaluación del sobrepeso y que presenta un aumento después de la menopausia. Este índice se encuentra asociado al síndrome metabólico y al riesgo cardiovascular. Sin embargo, otros autores opinan que este índice no debe ser tenido en cuenta a medida que progresa el envejecimiento por pérdida de la estatura, disminución de la masa magra, inactividad y disminución hormonal.
En el presente estudio existe un aumento en el IMC entre las menores y las mayores de 50 años (IMC = 26 vs. 27); al comparar con el estudio italiano38 el IMC promedio fue muy similar (IM = 26.5 vs. 27). A pesar de estos resultados, la mayoría de los estudios confirman que las mujeres en la posmenopausia aumentan de peso. Como lo confirma el estudio de la red latinoamericana para el estudio del climaterio (REDLINC), sobre un total de 3.965 mujeres53 el IMC antes y después de la menopausia fue de 26 vs. 28, y en un estudio similar en Bogotá54, sobre un total de 481 mujeres, el IMC fue 27 y 28. En un estudio español, sobre un total de 574 mujeres posmenopáusicas, las no obesas presentaron un IMC promedio de 25 y las obesas de 3255.
Uno de los parámetros para medir la obesidad abdominal ha sido el perímetro de cintura/ cadera. En este sentido, un estudio multicéntrico Redlinc53 encontró que el punto de corte era de 88 cm; cuando existía un factor para síndrome metabólico (SM) era de 85 cm, y con dos o más factores para SM era 91 cm. El National Cholesterol Education Program Adult Treatment Panel III (ATP III), en el 2009, disminuyó el perímetro abdominal para las mujeres a 80 cm. El presente estudio demostró que las mujeres menores de 50 años tenían un perímetro abdominal de 79 cm y después de los 50 años de 82 cm, datos inferiores a los encontrados por Gagnacci38 que fueron de 89 cm.
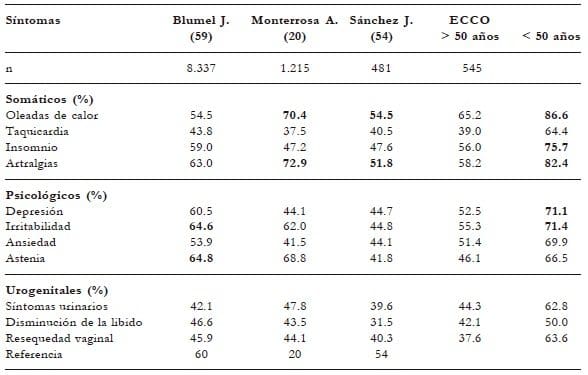
La serie de síntomas que presenta la mujer, previos a la menopausia y durante la transición climatérica, han sido evaluados en diferentes escalas como la Kuperman, la Green o la Cervantes. El simplificar en 11 ítems, como lo hace la escala MRS15, permite aproximarnos a varios de los principales síntomas que presenta la mujer en este periodo. En general las oleadas de calor y la sudoración advierten indirectamente sobre la disminución de la función ovárica con sus repercusiones a nivel del sistema simpático y parasimpático, efectos a nivel del sistema nervioso central, con compromiso de los epitelios y el sistema osteoarticular. Los diferentes estudios confirman que los síntomasvasomotores son uno de los principales síntomas que se encuentran en un 13.9%, dos años antes de la menopausia; durante la premenopausia, en un 55.7%; y después de los cinco años, en un 28.9%56. El estudio SWAN (Women’s Health Across the Nation)57 demostró que la mujeres afrodescendientes e hispanas tenían mayor sintomatología que las nativas; estudio confirmado por Monterrosa y otros11 en el Caribe colombiano. Uno de los desafíos a nivel terapéutico es poder agrupar los síntomas de acuerdo con su intensidad y su correlación con otros sistemas como las oleadas de calor, la depresión, el insomnio y las artralgias58. Al comparar diferentes estudios en la escala MRS, el metaanálisis publicado por Monterrosa y otros describe cómo esta sintomatología varía según la situación geográfica, la raza y el nivel socioeconómico.El presente estudio compara los hallazgos descritos por los Dres. Blumel59, Monterrosa20, Sánchez J.54 y el estudio ECCO, demostrando cómo esta sintomatología varía antes y después de la menopausia en nuestro medio. En general predominan las oleadas de calor (55- 70%); llama la atención –como lo describe Monterrosa– el porcentaje alto (72.9%) de artralgias en una población del Caribe colombiano, confirmado en el estudio ECCO después de la edad de 50 años (82.4%). Si bien el insomnio (47-60%) y la irritabilidad (45-65%) se presentan como síntomas intermedios, el presente estudio evidencia que tanto el insomnio (56 vs. 75%) como la irritabilidad (55 vs. 71%) aumentan significativamente después de los 50 años. La disminución de la libido y la resequedad vaginal permanecen en valores entre 40 y 60% (tabla 9).
Tabla 9. Estudios comparativos en la escala MRS
En relación con el perfil lípido como marcador de la función cardiovascular, debemos referirnos a los valores recomendados por el ATP III en la clasificación del síndrome metabólico. Se postula que las modificaciones que sufren los lípidos después de la menopausia son debidas a la disminución de los niveles plasmáticos de los estrógenos, que cursan con aumento del colesterol total (CT), disminución de la HDL y aumentos de la LDL y de los triglicéridos (TG), descartando la dislipidemia familiar60. Se ha podido demostrar que el aumento del tejido adiposo y el perímetro abdominal se correlaciona directamente con los niveles de triglicéridos61. El 48% de las mujeres americanas por encima de los 40 años tienen niveles de CT por encima de 200 mg/dl y las LDL mayores que 130 mg/dl62. El presente estudio evidencia que en las mujeres después de los 50 años aumentan los niveles de CT (190 mg/dl vs. 202 mg/dl), las LDL (90 mg/dl vs. 99 mg/dl) y los TG (132 mg/dl vs. 157 mg/dl). Si se comparan con el estudio de Cagnacci, los niveles de CT están bajos38, las HDL bajos y los triglicéridos altos.
En la evaluación del riesgo cardiovascular se han utilizado diferentes escalas, de las cuales la más utilizada ha sido la de Framingham, la cual incluye edad, hipertensión, cigarrillo, diabetes e hiperlipidemia. Pero un problema de esta escala es que solo permite la clasificación en riesgo bajo o intermedio. En tres cuartas partes de las mujeres por encima de los 70 años, el riesgo de enfermedad coronaria está en menos del 10%63. Existen otras escalas que incluyen historia familiar, estado socioeconómico y un marcador como la proteína C reactiva. En los países europeos se utiliza el SCORE (Systematic Coronary Risk Evaluation), el ASSIG (Assessing Cardiovascular Risk to Scottish IntercollegiateGuidelines y el QRISK (Q Research Cardiovascular Risk), escalas que no han podido obtener mejores resultados en las predicciones de riesgo que la Framingham64.
Al comparar el presente estudio con los datos reportados por Cagnacci38, se presenta una prevalencia mayor de hipertensión (16.9 vs. 27%), diabetes (2.5 vs. 3.4%), disminución de las HDL (63 vs. 49%), aumento de triglicéridos(105 vs. 157%) y un mayor índice aterogénico (2.1 vs. 4.5%). Todos estos factores de riesgo cardiovascular se confirman al aplicar la escala de Framingham; a 10 años el riesgo es mayor (4.4 vs. 9.6). Como ventajas comparativas, la mujer en Colombia fuma menos (29.8 vs. 11.4%) y su perímetro abdominal es menor (89 vs. 82 cm). Al aplicar la escala de Framingham, el riesgo cardiovascular en esta población de 10 años es alto en relación con otros estudios38,63,65, sugiriendo que debemos alertar a la comunidad médica sobre las recomendaciones de estilos saludables como la dieta, el ejercicio y los controles periódicos en la evaluación cardiovascular.
La pérdida ósea en la mujer se inicia alrededor de los 30 años y se acentúa después de la menopausia. La prevalencia de la osteoporosis se incrementa con el envejecimiento. En los Estados Unidos, de acuerdo con la definición de la OMS, el 30% de las mujeres posmenopáusicas presentan osteoporosis, y el 54% osteopenia. Al comparar los valores de densidad mineral ósea (DMO) a nivel latinoamericano, en mujeres entre los 40 y los 50 años, la DMO a nivel lumbar muestra cifras entre 1.14 y 1.07 (excepto Bogotá, 0.09); y a nivel de cuello de fémur entre 0.91 y 0.93, en ciudades como Sao Paulo, Buenos Aires y Bogotá66, y en Estados Unidos. Se postula que esta pérdida de masa ósea es debida a la disminución de los estrógenos por parte del ovario. Esta pérdida produce dolor crónico y riesgo de fractura. Existen factores de riesgo como los genéticos, raza blanca, ingesta baja en lácteos, alcohol y sedentarismo67; además, el riesgo de fractura está en relación directa con el pico de masa ósea y la velocidad de pérdida, especialmente en los primeros años después de la menopausia. El 50% de las mujeres por encima de los 65 años tiene el riesgo de sufrir osteoporosis y, por lo tanto, fractura por compresión y dolor. La mujer blanca tiene el 16% de riesgo de sufrir fractura de cadera; el estudio RHANES III (Third National Health and Nutrition Examination Survey) report que 21% de las mujeres blancas posmenopáusicas tenían osteoporosis de cadera, las afrodescendientes 10% y las latinoamericanas 16%68.
Son varios los procedimientos aplicados para el diagnóstico de la pérdida ósea. Inicialmente se realizaron RX de columna y cadera, clasificando la deformidad de las vértebras. Posteriormente apareció la absorsiometría dual de energía a los Rx (DEXA), método que hoy es de elección en el diagnóstico y seguimiento69. La DMO por este método mide dos índices: el Z-score y el Tscore. Existen otras pruebas a nivel sanguíneo u urinario como la fosfatasa alcalina específicapara hueso, osteocalcina, procolágeno tipo I-II, fosfatasa ácida tartrato resistente y las piridinolinas urinarias, útiles en conocer la pérdida ósea y para seguimiento terapéutico. Con el fin de calcular el riesgo de fractura se utiliza la Escala de Evaluación de Riesgo de Fractura (Fracture Risk Assessment Tool (FRAX). De acuerdo con los valores propuestos, se confirma en el presente estudio, al aplicar dicha escala FRAX, que el riesgo de fractura por osteoporosis es mayor tanto en las mujeres premenopáusicas como en las posmenopáusicas, en columna () y cadera, 15.8 vs. 18.4 y 10.5 vs. 55.3, respectivamente; cifras promedio más elevadas que las encontradas por otros autores69,70.
Conclusión
El presente estudio evidencia que las características sociodemográficas varían de acuerdo con la región así como los síntomas en la escala MRS. Cabe destacar que es un grupo captado a nivel hospitalario, con un nivel educativo y socioeconómico bajo. A pesar de sus limitantes, la investigación nos demuestra cómo la mujer en su periodo de transición, antes de los 50 años, ya presenta factores de riesgo para enfermedad cardiovascular, síndrome metabólico y osteopenia, que se acentúan después de los 50 años.
La evidencia del presente estudio confirma los resultados encontrados por otros autores. Un registro simple como la historia clínica, aplicar la escala MRS, la escala de Framigham, una densitometría y una química sanguínea mínima nos permiten aproximarnos a establecer los principales síntomas durante este periodo y el cálculo de riesgo de infarto a 5-10 años y de riesgo de fractura. Con estas herramientas tenemos la oportunidad de proponer medidas preventivas a nivel cardiaco óseo, de estilos de vida saludable, nutricionales y terapéuticas (terapia física y apoyo psicológico). Es una oportunidad para trabajar con un equipo interdisciplinario que mejore la salud de la mujer en su periodo de transición.
Conflicto de intereses
No existen conflictos de intereses por parte de los autores. La presente investigación fue financiada por la Asociación Colombiana de Menopausia con el apoyo de hospitales universitarios.Agradecimientos
A la Junta directiva de la Asociación Colombiana de Menopausia 2010-2012. Dres. Vásquez D., Marrugo M., Camero A., Bonilla J., Sierra B., Jáuregui I., Zarama F. y Gómez A. Directivas de las facultades de Medicina de la Universidad Nacional de Colombia, la Universidad de Ciencias Aplicadas y Ambientales, la Universidad del Valle, la Universidad del Cauca y la Universidad del Norte. Hospitales de Engativá, Tunjuelito de Bogotá, Madrid (Cundinamarca), Universitario del Valle, Universitario de Popayán y Universitario de Barranquilla.
Bibliografía
1. Santoro N, Chervenak JL. The menopause transition. Endocrinol Metab Clin North Am 2004;33:627-636.
2. Harlow SD, S. Crawford S, Dennerstein L, et al. Collaboration Recommendations from a multi-studyevaluation of proposed criteria for Staging Reproductive Aging. Climateric 2007;10:112-119.
3. Chedraui P, Blumel JE, Barón G, Gómez G, Onatra W, Monterrosa A, et al. Calidad de vida alterada entre mujeres de edad media: un estudio multicéntrico Latinoamericano. Maturitas 2008;61:323-329.
4. Utian WH. Psychosocial and socioeconomic burder of vasomotor symptoms in menopause: a comprehensive review. Health Qual life Outcome 2005;3:47.
5. Polo-Kantola P, Erkokkola R. Sleep and the menopause. J Br Menopause Soc 2004;10:145-150. 6. Sammartino A, Cirillo D, Mandato VD, DiCarlo C, Nappi C. Osteoporosis and cardiovascular disease: benefit-risk of hormone replacement. J Endocrinol Invest2995;28(10 Suppl):80-40.
7. Susan M, DeLange SM, Camacho PM. Recent Management Controversies in Osteoporosis. US Endocrinology 2011;7(2):141-144.
8. Sirola J, Rikkomen T. Muscle performance after the menopause. J Br Menopause 2005;11:45-50.
9. Okobia MN, Bunker CH. Epidemiological risk factors for breast cancer: a review- Niger. J Clin Pract 2005;8:35-42.
10. Imayama I, Alfano CM, Mason C, et al. Weight and metabolic effects of dietary weight loss and exercise interventions in postmenopausal antidepressant medication users and non-users: a randomized controlled trial. Prev Med 2013;57(5):525-532.
11. Romero IM, Monterrosa A, Paternina A. Menopausia y etnias/razas: ¿Hay diferencias en la presentación de los síntomas? Rev Col Obstet Ginecol 2010;61:319-328.
12. Alder E. The Blatt-Kupperman menopausal index: a crique. Maturitas 1998;29(1):19-24.
13. Greene JG. Constructing a standard climacteric scale. Maturitas 1998;29:25-31.
14. Palacios S, Ferrer-Barriendos J, Parrilla J, et al. Health related quality of life in Spanish women through and beyond menopause development and validation of the Cervantes Scale. Medicina Clínica 2004;122:205-211.
15. Potthoff P, Heinemann LA, Schneider HP, Rosemeier HP, Hauser GA. The Menopause Rating Scale (MRS II): methodological standardization in the German population. ZentralblGynakol 2000;122:280-286.
16. Onatra W, Sánchez J, Acuña R, et al. Epidemiología de la menopausia en Colombia. Rev Col Obstet Ginecol 1994:45(Supp):20-28.
17. NIH State of the Science Conference. Statement on Management of Menopause Related Symptoms. NIH Consens State Sci Statements 2005;22:1-38.
18. Kapur P, Sinha B, Pereira BM. Measuring climacteric symptoms and age at natural menopause in an Indian population using the Greene Climacteric Scale. Menopause 2009; 16:378-384.
19. Blumel JE, Chedraui G, Barón G, Gómez G, Onatra W, Monterrosa A, et al. A large multinational study of vasomotor symptom prevalence, duration, and impact on quality of life in middle-aged women. Menopause 2011;18:778-785
20. Monterrosa AC, Romero IP, Paternina AC. Manifestaciones musculo-articulares y no las oleadas de calor, es el síntoma más prevalente en mujeres climatéricas del Caribe colombiano. Rev Uninorte 2010;26:156-161.
21. Matthews KA, Crawford SL, Chae CU, et al. Are changes in cardiovascular disease risk factors in midlife women due to chronological aging or to the menopausal transition? J Am Coll Cardiol 2009;54:2366-2373.
22. Bechlioulis A, Kalantaridou SN, Naka KK, et al. Endothelial function, but not carotid intima- media thickness, is affected early in menopause and is associated with severity of hot flushes. J Clin Endocrinol Metab 2010 Jan 15.
23. Clarkson TB, Mehaffey MH. Coronary heartdisease of females: lessons learned from non human primates. Am J Primatol 2009;71: 785-793.
24. Manson JE, Chlebowki RT, Stefanick ML, et al. Menopausal Hormone Therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials. JAMA 2013;310(13):1353-1368.
25. Sassarini J, Fox H, Ferrell W, et al. Vascular function and cardiovascular risk factors in women with severe flushing. Clin Endocrinol 2011;74:97-103.
26. Grundy S, Pasternak R, Greenland P, Smith S Jr, Fuster V. Assessment of cardiovascular risk by use of multiple-risk-factor assessment equations: a statement for healthcare professionals from the American Heart Association and the American College of Cardiology. Circulation 1999;100:1481-1492.
27. Wilson PW, D’Agostino RB, Levy D, Belanger AM, et al. Prediction of coronary heart disease using risk factor categories. Circulation 1998;97:1837-1847.
28. Barrett-Connor E, Wehren LE, Siris ES, et al. Osteoporosis and fracture risk in women of different ethnic groups. J Bone Miner Res 2005;20:185-194.
29. Riera-Espinoza G. Epidemiología de la osteoporosis en Latinoamérica. Salud Pública Mex 2009;51:52-55.
30. Onatra W, Posso H, Benavides S. Evaluación de lípidos y ultrasonido de calcáneo con terapia hormonal al de reemplazo en baja dosis durante seis meses en mujeres premenopáusicas. Rev Col de Menopausia 2005;11(4).
31. Van Geel TA, Van den Bergh JP, Dinant GJ, Geusens PP. Individualizing fracture risk prediction. Maturitas 2010;65:143-148.
32. Kanis JA, McCloskey EV, Johansson H, Strom O, Borgstrom F, Oden A, National Osteoporosis Guideline Group. Case finding for the management of osteoporosis with FRAX –assessment and intervention thresholds for the UK. Osteoporos Int 2008;19:1395-1408. 32ª. http://www.shef.ac.uk/FRAX/tool.jsp? country=28
33. Ruiz-Morillo. Epidemiología clínica: Investigación clínica aplicada. Editorial Médica Internacional. Bogotá, 2004.
34. Rivera CM, Crossardt BR, Rhodes DJ, et al. Increased cardiovascular mortality after bilateral oophorectomy. Menopause 2009;16: 15-23.
35. Thurston RC, Sowers MR, Sutton-Tyrrell K, et al. Abdominal adiposity and hot flashes among midlife women. Menopause 2008;15: 429-434.
36. Gerber LM, Sievert LL, Warren BA, et al. Hot flashes are associated with increased ambulatory systolic blood pressure. Menopause 2007;14:308-315.
37. Gast GC, Grobbee DE, Pop VJ, et al. Menopausal complaints are associated with cardiovascular risk factors. Hypertension 2008;1:1492-1498.
38. Cagnacci A, Cannoletta F, Palma R, et al. Menopausal symptoms and risk factors for cardiovascular disease in postmenopause. Climateric 2012;15:157-162.
39. Megarejo E, Urdinola J. Riesgo cardiovascular de la mujer menopáusica. Editorial Panamericana formas e impresos S. A. Bogotá. Colombia. 1 Edit. 2010.
40. Ardila E, Mautalen C, Jiménez C. Osteoporosis en Iberoamérica. Editorial Manual Moderno México, Bogotá. 2 Edit. 2012.
41. Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the Interheart study): case-control study. Lancet 2004;364:937-952.
42. Salud en las Américas. Organización Panamericana de la Salud. 2012.
43. Análisis de situación de salud por regiones en Colombia. Ministerio de Salud y Protección Social. Dirección de Epidemiología y Demografía. Grupo ASIS. 2013.
44. Luczak ED, Leinwand LA. Sex-based cardiac physiology. Ann Rev Physiol 2009;71:1-18.
45. Go AS, Mozaffarian D, Roger VL, et al. Heart disease and stroke statistics 2013 update: a report from the American Heart Association. Circulation 2013;127:e6-e24.
46. D’Agostino RB Sr, Grundy S, Sullivan LM, Wilson P. CHD Risk Prediction Group. Validation of the Framingham coronary heart disease prediction scores: results of a multiple ethnic groups investigation. JAMA 2001;286: 180-187.
47. National Cholesterol Education Program (NCEP). Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation 2002;106(25): 3143-3421.
48. Cook NR, Paynter NP, Eaton CB, et al. Comparison of the Framingham and Reynolds Risk scores for global cardiovascular risk prediction in the multiethnic Women’s Health Initiative. Circulation 2012;125: 1748-1756.
49. Perk J, De Backer G, Gohlke H, et al. European Guidelines on cardiovascular disease prevention in clinical practice (versión 2012): the fifth Joint Task Force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice. Atherosclerosis 2012;223:1-68.
50. Yoon PW, Gillespie CD, George MG, Wall HK; Centers for Disease Control and Prevention (CDC). Control of hypertension among adults – National Health and Nutrition Examination Survey, United States, 2005-2008. MMWR Morb Mortal Wkly Rep 2012;61 (Suppl.)19-25.
51. Guh DP, Zhang W, Bansback N, et al. The incidence of comorbidities related to obesityand overweight: a systematic review and meta-analysis. BMC. Public Health 2009;9:88.
52. Davis SR1, Castelo-Branco C, Chedraui P, et al. Writing Group of the International Menopause Society for World Menopause Day 2012. Understanding weight gain at menopause. Climacteric 2012;15(5):419-429.
53. Blumel E, Chedraui PA, Onatra W, Gómez G, Barón G, Monterrosa A, et al. Optimal waist circumference cutoff value for defining the metabolic syndrome in postmenopausal Latin American women. Menopause 2012;19: 433-437.
54. Sánchez J, Onatra W, Castellanos J, et al. Evaluación del riesgo cardiovascular y calidad de vida en mujeres pre y posmenopáusicas de la consulta de climaterio en 3 hospitales de Bogotá; periodo 2011-2012. Rev Col Menopausia 2013;19:280-291.
55. Cuadros JL, Fernández-Alfonso AM, Chedraui P, et al. Body mass index and its correlation to metabolic and hormone parameters inpostmenopausal Spanish women. Gynecological Endocrinology 2011;27:397-390.
56. Politi MC, Schleinitz MD, Col NF, et al. Revisiting the duration of vasomotor symptoms of menopause: a meta-análisis. J Gen Intern Ned 2008;61:323-329.
57. Thruson RC, Sutton-Tyrrell K, Everson- Rose S, et al. Hot flashes and subclinical cardio vascular disease: findings from Study of Women’s Health Across the Nation. Menopause 2009;16:860-869.
58. Cray LA, Woods NF, Herting JR, et al. Symptom ckuster during the late reproductive state through the early postmenopause. Menopause 2012;19:864-869.
59. Blumel JE, Onatra W, Gómez J, Monterrosa A, Barón G. Menopausal symptoms appear before the menopause and persist 5 years beyond: a detailed analysis of a multinational study. Climateric 2012;15:542-551.
60. Knauff EA, Westerveld HE, Goverde AJ, et al. Lipid profile of women with premature ovarian failure. Menopause 2008;15:919-923.
61. Arsenault BJ, Lemieux I, Depres JP, et al. The hypertriglyceridemic-waist phenotype and the riskof coronary artery disease: results from the EPIC-NorfolkProspective Population Study. CMAJ 2010.
62. Vaccarino V, Badimon L, Corti R, et al. Ischaemic heart disease in women: are there sex differences in pathophysiology and risk factors? Cardiovascular Research 2011;90:9-17.
63. Masson W, Siniawski D, Krauss J, Cagide A. Aplicabilidad clínica de la función de Framingham a 30 años: utilidad en la estratificación del riesgo cardiovascular y en el diagnóstico de placa arterioesclerótica. Rev Esp Cardiol 2011;64:305-311.
64. Berger JS, Jordan CO, Lloyd-Jones D, Blumenthal RS. Screening for cardiovascular risk in asymptomatic patients. J Am Coll Cardiol 2010;55:1169-1177.
65. Sallam T, Watson KE. Predictors of cardiovascular risk in women. Women’s Health 2013;9:491-498.
66. Ardila E, Mautalen C, Jiménez C. Osteoporosis iberoamericana. Manual moderno. México DF, 2012.
67. Sowers MR, Zheng H, Jannausch ML, et al. Amount of bone loss in relation to time around the final menstrual period and folliclestimulating, hormone staging of transmenopause. J Clin Endocr Metab 2010;95: 2155-2162.
68. Looker AC, Johnston CC, Wahner HW, et al. Prevalence of low femoral bone density in older US women from NHANES III. J Bone Miner Res 1995;10:796-802.
69. Gourlay ML, Fine JP, Preisser JS, et al. Bonedensity testing interval and transition to osteoporosis in older women. N Engl J Med 2012; 366:225-233.
70. Roig VD, Conesa A, Hoces OC, et al. Riesgo de fractura de fémur: Comparación de dos modelos de cálculo. Reumatol Clin 2010; 6:39-44.
