Resección Quirúrgica
El tratamiento de elección en el cáncer mamario en hombres es la mastectomía radical modificada, que se emplea en 70 % de los casos, asociada a disección axilar o biopsia del ganglio centinela. La escisión amplia debe incluir siempre la resección del pezón, el cual puede ser tatuado o reconstruido. La mastectomía radical y la parcial (“lumpectomía”), se realizan con menor frecuencia: 8 a 30 % y 1 a 13%, respectivamente. El manejo conser-vador no es muy apropiado en el hombre, por el escaso volumen de la mama y se reserva para algunos casos de tumores pequeños con ginecomastia o para individuos mayores en malas condiciones generales.
Los colgajos con músculo dorsal o recto abdominal se emplean en enfermedades localmente avanzadas 2,4-6.
La primera biopsia de ganglio centinela en cáncer mamario en hombres, se reportó en 1999 28. Desde entonces, en varios estudios se ha llegado a demostrar que la biopsia del ganglio centinela es una herramienta segura que permite una tasa de detección cercana al 100 %. En el Memorial Sloan-Kettering Cancer Center se estudiaron 78 hombres con cáncer mamario, sometidos a biopsia del ganglio centinela. Dicha biopsia fue exitosa en 97 %. El 49% de los hombres con cáncer mamario tuvieron compromiso de ganglios, en comparación con 31 % del grupo femenino. La tasa de falsos negativos fue de 8 %. No se presentó recurrencia axilar en un periodo de 28 meses 29.
El Istituto Europeo di Oncologia (IEO), en Italia, propone la técnica del ganglio centinela en pacientes con tumores primarios menores de 2 cm, sin evidencia clínica de infiltración ganglionar.
En las guías de la American Society of Clinical On-cology (ASCO), se concluye que el uso de la biopsia del ganglio centinela es aceptable en hombres con cáncer mamario 30,31. La contribución de dicho procedimiento es disminuir la morbilidad asociada a la disección axilar.
Radioterapia complementaria posquirúrgica
Es más frecuente el uso de la radioterapia en los hombres que en las mujeres, después de la mastectomía, debido a la mayor frecuencia en ellos de enfermedad localmente avanzada, al mayor compromiso ganglionar y a la loca-lización central del tumor.
En varios estudios retrospectivos se ha reportado un beneficio del control local de la enfermedad tras la radioterapia. Cutuli, et al., recopilaron 690 pacientes de 20 instituciones francesas, en un periodo de treinta años. El porcentaje de recaída en 496 pacientes trata-dos con radioterapia fue de 9,5 %, con una diferencia significativa entre pacientes irradiados y no irradiados (7,3 % Vs. 13 %) 32. Ribeiro, et al., en una segunda cohorte de 428 pacientes, demostraron una diferencia significativa en las tasas de supervivencia libre de enfer-medad a cinco años, entre pacientes que fueron tratados sólo con mastectomía y pacientes con mastectomía y radioterapia (44,6 % Vs. 77,2 %) 33.
Las guías de manejo de radioterapia en mujeres y hombres son similares y sus indicaciones serían: tumores T3-T4, e incluso tumores T2, debido a la casi constante localización retroareolar de la neoplasia maligna en hombres, tumores mayores de 1 cm con extensión a la piel, la areola o el músculo, el compromiso de cuatro o más ganglios, la extensión ganglionar extracapsular y, además, los múltiples focos macroscópicos, el alto grado del tumor, la alta tasa de proliferación, la inva-sión del espacio perivascular y el compromiso de los márgenes 2,5,9.
El compromiso de tres ganglios axilares requiere irradiación axilar adicional y, el de cuatro o más, irra-diación supraclavicular.
En el Istituto Europeo di Oncologia de Milán, la radioterapia se emplea en tumores mayores de 1 cm o cuando hay metástasis en más de un ganglio 31. La dosis de radiación en el hombre es similar a la de la mujer: 2 Gy por fracción en 25 sesiones. La radioterapia de refuerzo (boost) debe considerarse ante la presencia de márgenes quirúrgicos subóptimos.
La recaída local, con una frecuencia de 3 a 29 %, ocurre especialmente en la pared de tórax y el área supraclavicular. Los factores predictores de falla local y regional son: el estado de los márgenes, el tamaño tumoral y el número de ganglios comprometidos 6,8.
Tratamiento endocrinológico
Inicialmente se emplearon técnicas ablativas en el tratamiento del cáncer mamario en hombres, como la orquidectomía, la hipofisectomía y la suprarrenalecto-mía bilateral. Dichas técnicas han sido sustituidas por tratamientos hormonales aditivos, especialmente, por el tamoxifeno (antiestrógeno) 34.
Orquidectomía-antiandrógenos
La orquidectomía fue la primera modalidad empleada en el tratamiento del cáncer mamario en hombres, siendo efectiva en la enfermedad generalizada o recurrente, con una evolución favorable en 50 %. Dicha mejoría clínica fue más frecuente en tumores con receptores hormonales positivos. La orquidectomía se constituye en un tratamiento de salvación para pacientes con falla en la primera línea de tratamiento.
El cáncer metastásico mamario en hombres, en una pequeña serie de casos, mostró mejoría con ciertos antiandrógenos, como el acetato de ciproterona, los análogos de la luliberina (LH-RH) más antiandrógeno, o el análogo solo. No está claro si el efecto del antiandró-geno es favorecido por el antagonismo de los receptores de andrógenos o por la remoción de sustratos para la conversión de estrógenos.
Supresión de andrógenos suprarrenales
Anteriormente, se emplearon métodos quirúrgicos y medicamentosos para suprimir los andrógenos su-prarrenales y tratar el cáncer metastásico mamario en hombres con hipofisectomía, suprarrenalectomía bilateral y suprarrenalectomía medicamentosa con dosis altas de ketoconazol y glutetimida. La mejoría con la suprarre-nalectomía fue de 55 a 80 %. La ablación suprarrenal es efectiva sólo en pacientes con orquidectomía previa. La desventaja de lo anterior fue la morbilidad quirúrgica y la toxicidad medicamentosa.
Agentes estrógenos y gestágenos
Los estrógenos en bajas dosis estimulan la proli-feración de las células cancerosas. Sin embargo, en altas concentraciones pueden suprimir el crecimiento celular. Este tratamiento fue también efectivo en el cáncer mamario en hombres, con mejoría de 38 % en la enfermedad metastásica. Sus desventajas fueron los efectos colaterales de feminización, ginecomastia y enfermedad tromboembólica. La eficacia de los gestágenos para inducir regresión del cáncer mamario en hombres, fue limitada.
Tamoxifeno y otros antiestrógenos
El tamoxifeno es el tratamiento hormonal de elección, en hombres con cáncer mamario y receptores hormonales positivos. Su beneficio es claro si se considera el hecho de que 90 % de los tumores mamarios en hombres expresan dichos receptores. En las series retrospectivas en que se ha evaluado el tamoxifeno como tratamiento complementario, se ha encontrado disminución del ries-go de recurrencia y muerte con su uso. Ribeiro, et al., compararon 39 hombres con cáncer mamario (estadio II – III) que recibieron tamoxifeno, con un grupo con-trol sometido sólo a mastectomía. La supervivencia a cinco años fue de 61% y 44 %, y la supervivencia libre de enfermedad, de 56 % y 28 %, respectivamente. Este estudio demostró el beneficio del antiestrógeno; no obstante, los datos podrían estar subestimados, ya que el tamoxifeno sólo se usó por uno a dos años 35.
Se ha sugerido que los pacientes de sexo masculino con cáncer mamario operable y receptores hormonales positivos, sean tratados con tamoxifeno por cinco años 9.
La tolerancia al tamoxifeno es menor en hombres que en mujeres, debido a sus efectos colaterales: trombosis venosa profunda, disminución de la libido, ganancia de peso, alteraciones de ánimo, depresión y calores. La tasa de descontinuación del tratamiento en el hombre alcanza el 21 %, en comparación con 4 a 7 % en la mujer 2.
Se han reportado casos de cáncer de mama en hom-bres con respuesta al fulvestrant, un antagonista de los receptores de estrógenos. El efecto del antiestrógeno parece ser mayor en hombres con orquidectomía que en aquellos de control con función testicular normal.
Inhibidores de la Aromatasa
El papel de los inhibidores de la aromatasa en el tratamiento complementario posquirúrgico es cuestiona-ble, aunque el anastrozol y el letrozol son activos en la enfermedad metastásica. Algunos datos sugieren que, en hombres sanos, el anastrozol no produce una completa supresión de estrógenos como en las mujeres, ya que 20 % de los estrógenos circulantes en el hombre son independientes de la aromatasa, debido a la producción testicular. Los inhibidores de la aromatasa disminuyen en 50 % los niveles de estrógenos en el hombre, cifra inferior a la disminución de dichos niveles en mujeres posmenopáusicas (81 a 85 %). En el momento actual hay insuficiente información para recomendar un inhibidor de la aromatasa en la adyuvancia.
Quimioterapia Antineoplásica Posquirúrgica Adyuvante
En varios estudios retrospectivos se ha sugerido que la quimioterapia complementaria en pacientes masculinos está asociada con una reducción en el riesgo de recaída y un beneficio en la supervivencia.
En el estudio de Bagley, et al., se incluyeron 24 hom-bres (estadio II) con compromiso ganglionar, tratados con ciclofosfamida, metotrexato y fluoracilo (CMF), y se reportaron tasas de supervivencia a cinco años cercanas a 80 %, superiores a los controles de estadio similar 36. Yildrim, et al., demostraron, en 121 pacientes, que el uso de cualquier quimioterapia complementaria posquirúrgica se asociaba con mejoría en la supervivencia a los cinco años 37. En el MD Anderson Cancer Center se reportaron los resultados del tratamiento sistémico complementario en 51 hombres con cáncer mamario: 84 % en tratamien-to con quimioterapia adyuvante, 6 % con tratamiento antineoplásico prequirúrgico (neoadyuvante), 9 % con ambos, 81 % con esquemas basados en antraciclinas, 9 % con taxano adicional y 16 % con la combinación CMF. En 38 hombres se administró hormonoterapia. La supervivencia a 5 y 10 años para hombres con enferme-dad sin compromiso ganglionar fue de 86 % y 75 %, y para aquellos con afectación ganglionar, de 70 % y 43 %, respectivamente. Los mayores efectos benéficos en la supervivencia y la recurrencia se obtuvieron con el tratamiento hormonal (estadísticamente significativos). La quimioterapia en pacientes con compromiso ganglio-nar se asoció con un menor riesgo de muerte, aunque la diferencia no fue estadísticamente significativa 38.
Con base en los beneficios de la quimioterapia en mujeres y en los resultados positivos de las pequeñas series en hombres, se considera que la quimioterapia estaría indicada en individuos con cáncer mamario pri-mario de riesgo intermedio y alto, en hombres menores de 70 años con infiltración ganglionar y en la enferme-dad con receptores hormonales negativos. Los datos sugieren también, un beneficio de la quimioterapia en pacientes jóvenes. En el MD Anderson Cancer Center, la quimioterapia se indica en tumores que miden más de 1 cm y cuando existe compromiso ganglionar.
Los taxanos y antraciclinas se usan cuando hay com-promiso de los ganglios linfáticos y las antraciclinas, cuando no lo hay 8. En el pasado se empleaban más frecuentemente esquemas con la combinación CMF, mientras en la actualidad, el 75 % de los pacientes re-ciben antraciclinas.
El trastuzumab (terapia anti-HER) puede ser incluido tanto en el tratamiento adyuvante como en la terapia sistémica, y debe considerarse su uso en el tratamiento de hombres de alto riesgo, con tumores mamarios po-sitivos para HER2.
Tratamiento antineoplásico prequirúrgico (terapia neoadyuvante)
La principal indicación para este tipo de tratamiento es la presencia de una neoplasia ulcerada, su fijación al tejido y un compromiso ganglionar importante. Una de sus ventajas es poder observar la eficacia del tratamiento in vivo. La elección de la terapia debe ser muy acorde a los marcadores biológicos del tumor 6.
Tratamiento de la enfermedad metastásica
Anteriormente, se empleaban tratamientos ablati-vos para el control de la enfermedad metastásica, ya mencionados.
La hormonoterapia con tamoxifeno es el tratamiento de elección de primera línea en la enfermedad metastásica con receptores hormonales positivos, con una respuesta favorable en 25 a 58 %. El empleo de fulvestrant se reportó recientemente en una pequeña serie de casos 39.
La utilidad de los inhibidores de la aromatasa no es clara, aunque se han obtenido resultados en peque-ñas series 40. En el tratamiento del cáncer metastásico mamario en hombres, resistente al tamoxifeno, podría considerarse el uso de inhibidores de la aromatasa en combinación con orquidectomía médica (agonista de la luliberina (LH-RH)] o mediante orquidectomia 18.
El tratamiento de segunda línea cuando la enferme-dad avanza después del tamoxifeno, podría incluir la supresión de andrógenos mediante orquidectomía o el empleo de un análogo de la luliberina (LH-RH) más un antiandrógeno, un antagonista de receptores de estrógenos (faslodex) o un inhibidor de la aromatasa.
La quimioterapia sistémica se emplea como trata-miento de segunda o tercera línea, ya que la mayoría evoluciona favorablemente con la hormonoterapia. Entre sus indicaciones se encuentra la enfermedad resistente a la hormonoterapia, la rápidamente progresiva con receptores hormonales negativos, la visceral que com-promete la vida y la presentación de la enfermedad en hombres jóvenes. La quimioterapia también tiene un efecto paliativo. La eficacia del tratamiento varía entre tasas de 13 %, con un agente único, y de 67 %, con varios medicamentos. En la enfermedad avanzada, es preferible el uso secuencial del tratamiento endocrino y la quimio-terapia, a su uso simultáneo 5. Entre los medicamentos de elección, se incluyen taxanos, capecitabina, gemcitabina, navelbina y antraciclinas, solas o en combinación 34.
Se recomienda confirmar el estado de los receptores hormonales y del receptor 2 del factor de crecimiento epidérmico humano (HER2), al menos en una lesión me-tastásica (con guía ecográfica o tomográfica), para orientar la selección del tratamiento endocrino o la quimioterapia, con base en las características biológicas durante la recaída del tumor, en lugar de las del tumor primario 41.
Presentación del caso
Se trata de un paciente de 43 años de edad, de sexo masculino, casado y con un hijo, que consultó por una masa firme de cuatro meses de evolución, dolorosa, localizada en la región subareolar de la mama izquierda, sin otros síntomas asociados. No refirió antecedentes personales ni familiares de riesgo.
En la evaluación clínica se confirmó una masa in-durada subareolar de 3 cm de diámetro, sin cambios en el pezón ni en la piel. En el abordaje diagnóstico se le practicó mamografía, ecografía, resonancia magnética y biopsia con aguja gruesa bajo guía ecográfica.
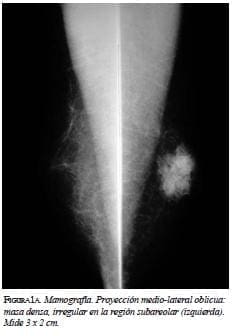
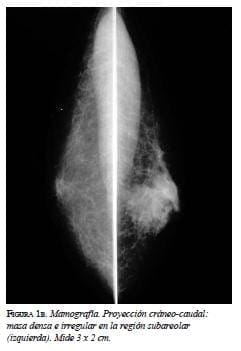
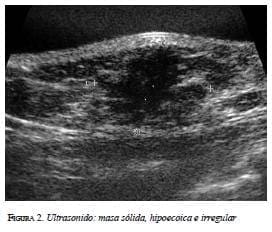
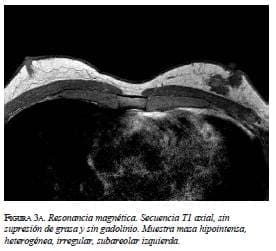
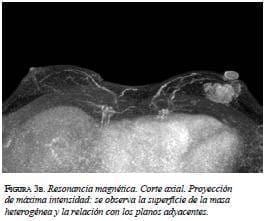
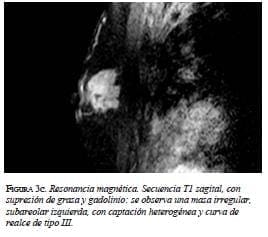
En la mamografía (figura 1a y 1b) se demostró una masa densa, irregular, de 3 x 2 cm en la región subareolar izquierda. Por ultrasonido (figura 2) se confirmó la pre-sencia de una masa sólida, hipoecoica e irregular. En la resonancia magnética (figura 3 a, b y c) se observó una masa hipercaptante, heterogénea, irregular, subareolar izquierda, de 3,5 x 2,5 cm, con curva de realce sospe-chosa tipo III. En todas las modalidades diagnósticas la lesión se clasificó según el sistema de datos y registro de imagen de mama (BI-RADS), como una lesión categoría V: altamente sospechosa de malignidad.
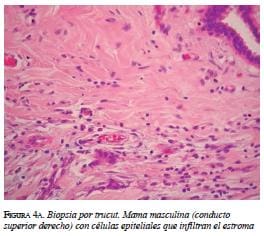
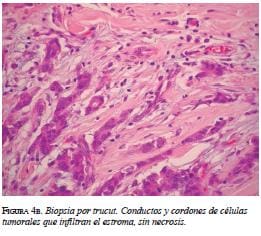
La biopsia con aguja gruesa confirmó dicho diagnóstico: carcinoma ductal infiltrante, grado II de Bloom Richardson; grado nuclear 2; con compo-nente in situ; patrón sólido y cribiforme (figura 4 a y b). La inmunohistoquímica demostró receptores de estrógenos y receptores de progesterona positivos, y HER2 negativo.
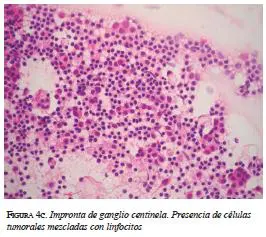
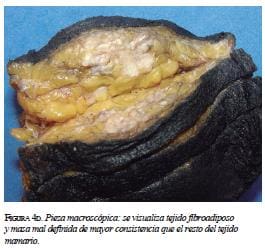
El paciente fue sometido a mastectomía radical mo-dificada, con resección del pezón y biopsia del ganglio centinela. Durante el acto quirúrgico se practicó la im-pronta del ganglio centinela, el cual fue positivo (figura 4c). Este resultado se confirmo posteriormente en los cortes de hematoxilina y eosina. El vaciamiento axilar se practicó en el mismo acto quirúrgico. Dos de cuatro ganglios centinela tenían compromiso metastásico, con focos de 2 mm y 0,6 cm. Del vaciamiento se aislaron 11 ganglios adicionales, libres de compromiso tumoral. En el espécimen macroscópico (figura 4d) se encontró una masa mal definida, de 2,8 x 2,5 cm, que respetaba los márgenes quirúrgicos.
Con base en los hallazgos, la enfermedad se clasificó en estadio II B (T2 N1 M0).
 |
 |
 |
 |
 |
 |
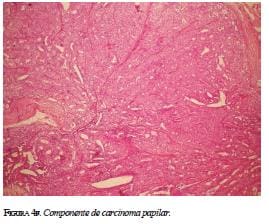
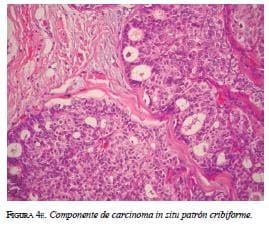
En el estudio histológico del resto del espécimen, se identificaron focos de carcinoma in situ con patrón cribiforme (figura 4e), áreas de infiltración por carcino-ma ductal de patrón usual y áreas de carcinoma papilar (figura 4f). El diagnóstico definitivo: carcinoma ductal infiltrante grado II, con componente in situ en 30 % de la muestra, compromiso linfático y microcalcificaciones. Los estudios de extensión fueron negativos.
El paciente recibió tratamiento complementario con quimioterapia (fluorouracilo, doxorrubicina y ciclofos-famida), radioterapia y hormonoterapia con tamoxifeno. La evolución clínica fue satisfactoria en un periodo de seguimiento de 14 meses. El estudio genético está en gestión.
 |
 |
 |
 |
Conclusiones El cáncer mamario en hombres es raro e infrecuente, y su diagnóstico amerita un alto índice de sospecha. Es fundamental el conocimiento de dicha condición para garantizar el diagnóstico temprano y el manejo oportu-no. Hay varios métodos diagnósticos disponibles para su valoración, siendo la mamografía el primer examen que se debe tener en cuenta, seguida de la ecografía y la biopsia guiada por ultrasonido. La biopsia con aguja gruesa permite diagnosticar el componente invasor y hacer estudios de inmunohistoquímica, de gran impor-tancia para establecer las características moleculares del tumor, y así, orientar el manejo.
El tratamiento de elección es la mastectomía radical modificada, con resección del ganglio centinela, vaciamiento axilar o ambos procedimientos. El manejo complementario con radioterapia, hormonoterapia o quimioterapia, se adapta de los protocolos de cáncer en la mujer y se orienta según la presentación clínica, el estadio y los exámenes de biología molecular.
Como en la mujer, el pronóstico se relaciona con el compromiso ganglionar y el tamaño tumoral. Además de la vigilancia clínica, a estos pacientes se les debe someter a consejería y pruebas genéticas, a mamografía anual y a protocolos de tamización de cáncer, especialmente de próstata.
Mammary Cancer in Men
Abstract
Male breast cancer is an infrequent disease representing only about 1% of all breast cancers responsible for 0.1 % cancer deaths in men. The incidence has increased over the past 25 years. Genetic, hormonal, and environmental risk factors have been implicated in its pathogenesis. Clinical presentation is a painless retroareolar lump, or nipple inversion with more than 40% of individuals having stage III or IV disease. In most cases diagnosis is established by clinical assessment, mammography, ultrasonography and core biopsy. About 90% of all tumors are invasive ductal carcinomas, expressing high levels of hormone receptors. Locoregional treatment includes surgery and radiotherapy, according to the clinical presentation, and systemic treatment (hormonal and/or chemotherapy) according to clinical and biological features. In this article we present the case of a patient with the disease and review the latest information on this subject.
Key words: breast neoplasms; carcinoma, ductal, breast; diagnosis; risk factors; male.
Referencias
1. Delgado B, Palacios L, Petit H, Barrios G, Tejada A, Pacheco C. Carcinoma de mama en el hombre: a propósito un caso. Revista Venezolana de Oncología. 2009;21:165-8.
2. Gómez RC, Zambrana F, Serreno M, López M, Casado E. Male breast cancer. Cancer Treatment Reviews. 2010;36:451-7.
3. Jernal A, Siegel K, Ward E. Cancer statistics. CA Cancer J Clin. 2009;59:225.
4. Gradishar W. Male breast cancer. In: Harris J, Lippman ME, Morrow M, Osborne C, editors. Diseases of the breast. Philadelphia: Lippincont Williams & Wilkins; 2009. p. 749-54.
5. Fentiman IS, Fourquet A, Hortobagyi G. Male breast cancer. Lancet. 2006;367:595-604.
6. Ottini L, Palli D, Rizzo S, Federico M, Bazan V, Russo A. Male breast cancer. Crit Rev Oncol Hematol. 2010;73:141-55.
7. Ying MW, Agrawal A, Cheung KL. The other half of breast cancer: A review of male breast cancer. J Mens Health Gend. 2005;2:406-13.
8. Giordano SH. A review of the diagnosis and management of male breast cancer. Oncologist. 2005;10:471-9.
9. Onami S, Ozaki M, Mortimer JE, Kumar S. Male breast cancer: An update in diagnosis, treatment and molecular profiling. Maturitas. 2010;65:308-14.
10. Dally MB, Axibund J, Buys S, Crawford B, Farrel C, Friedman S, et al. J Natl Compr Canc Netw. 2010;8:562-94.
11. Wernberg JA, Yap J, Murekeyisoni C, Mashtare T, Wilding G, Kulkarni SA. Multiple primary tumors in men with breast cancer diagnoses –A SEER database review. J Surg Oncol. 2009;99:16-9.
12. Bravo M, Adrada A, Bolaños H. Cáncer mamario en el hombre. Presentación de caso y revisión de literatura. Revista Colom-biana de Cirugía. 2004;19:246-53.
13. Morrogh M, King TA. The significance of nipple discharge of the male breast. Breast J. 2009;15:632-8.
14. Chen L, Chantra P, Larsen L, Barton P, Rohitopakarn M, Zhu EQ, et al. Imaging characteristics of malignant lesions of the male breast. Radiographics. 2006;26:993-1006.
15. Cooper R, Gunter B, Ramamurthy L. Mamography in men. Radiology. 1994;191:651-6.
16. Mathew J, Perkins GH, Stephens T, Middleton LP, Yang WT. Primary breast cancer in men: Clinical, imaging, and pathologic findings in 57 patients. AJR Am J Roentgenol. 2008;191:1631-9.
17. Taber KA, Morisy LR, Osbhar AJ, Dickinson BD. Male breast cancer: Risks factors, diagnosis, and management. Oncol Rep. 2010;24:1115-20.
18. Korde LA, Zujewski JA, Kamin L, Giordano S, Domchehek S, Anderson WF, et al. Multidisciplinary meeting on male breast cancer: Summary and research recommendations. J Clin Oncol . 2010;28:2114-22.
19. Yang WT, Whitman GJ, Yuhen EH, Tse GM, Stelling C. So-nographic features of primary breast cancer in men. AJR Am J Roentgenol. 2001;176:413-6.
20. Binda MC, Pineda D, Bozo C, Vidal R, Alfonsín L. Cáncer de mama masculino. Un diagnostico a considerar. RAR. 2007;71:65-72.
21. Rosasco M, Centurion D, Carzoglio J. Cáncer de mama mas-culino en Uruguay. Comunicación de 16 casos y revisión de la literatura. Revista Española de Patología. 2004;37:253-61.
22. Morakkabati N, Schild H, Leutner C, Falkenhausen M, Lutter-bey G, Kuhl C. Dynamic control enhanced breast MR imaging in men: Preliminary results. Radiology. 2006;238:438-45.
23. Burga A, Fadare O, Lininger RA, Tavassoli F. Invasive carcino-ma of the male breast : A morphologic study of the distribution of histologic subtypes and metastatic patterns in 778 cases. Virchows Arch. 2006;449:507-12.
24. Ge V, Sneige N, Eltorky MA, Wang Z, Lin E, Gong Y, et al. Immunohistochemical characterization of subtypes of male breast carcinoma. British Cancer Research. 2009;11:R28.
25. Chappuis KW, Burger SB, Hurlimann J. Comparison of prog-nostic markers detected by immunohistochemistry in male and female breast carcinoma. Eur J Cancer. 1996;32A:1686-92.
26. Cutuli B, Cohen SC, Kirova SY, Lemanski C, Lafontan B, Zoubir M, et al. Male breast cancer. Evolution of treatment and prognosis factors. Analysis of 489 cases. Crit Rev Oncol Hematol. 2010;73:246-54.
27. Guinee VE, Shallenberger RC, Moller T, Olson H, Blink JW, Peter Z, et al.The prognosis of breast cancer in male. A report of 335 cases. Cancer. 1993;71:154-61.
28. Hill AD, Borgen PL, Cody HS. Sentinel node biopsy in male breast cancer. Eur J Surg Oncol. 1999;25:442-3.
29. Flynn LW, Park J, Patil S, Cody H, Port ER. Sentinel lymph node biopsy is successful and accurate in male breast carcinoma. J Am Coll Surg. 2008;206:616-21.
30. Lyman G, Giuliano AE, Somerfield MR, Benson AL, Bodurka DC, Burstein HJ, et al. American Society of Clinical Oncology Guideline, recommendations for sentinel lymph node biopsy in early-stage breast cancer. J Clin Oncol . 2005;23:7703-20.
31. Gennari R, Curigliano G, Jereczec F. Male breast cancer: A special therapeutic problem. Anything new? Int J Oncol. 2004;24:663-70.
32. Cutuli B, Velten M, Dilhuydy JM. Male breast cancer: Results of the treatments and prognostic factors in 690 cases. Int J Radiat Oncol Biol Phys. 1998;42:2056.
33. Ribeiro G, Swindell R, Harris M, Banerjee S, Cramer A. A review of the management of the male breast carcinoma based on an analysis of 420 treated cases. Breast. 1996;5:141-6.
34. Hayes T. Pharmacologic treatment of male breast cancer. Expert Opin Pharmacother. 2009;10:2499-505.
35. Ribeiro G, Swindell R. Adjuvant tamoxifen for male breast cancer. Brit J Cancer. 1992;65:252-4.
36. Bagley CS, Wesley MN, Young RC, Lippman ME. Adjuvant chemotherapy in males with cancer of the breast. Am J Clin Oncol. 1987;10:55-60.
37. Yildrim E, Berberoglu U. Male breast cancer: A 22 year expe-rience. Eur J Surg Oncol. 1998;24:548-52.
38. Giordano S, Perkins GH, Broglio K, García SG, Middleton LP, Buzdar A, et al. Adjuvant systemic therapy for male breast carcinoma. Cancer. 2005;104:2359-64.
39. Masci G, Gandini C, Zuradelli M, Pedrazzoli P, Torrisi R, Lutman R, et al. Fulvestrant for advanced male breast cancer patients: A case series. Ann Oncol. 2011;22:985-93.
40. Doyen J, Italiano A, Largillier R, Ferrero JM, Fontana X, Thyss A. Aromatase inhibition in male breast cancer patients: Biolo-gical, and clinical implications. Ann Oncol. 2010;21:1243-5.
41. Czene K, Bergqvist J, Per H, Bergh J. How to treat male breast cancer. Breast. 2007;16:S147-54.
Correspondencia:
GLORIA MESA, MD
Correo electrónico: gmv005@yahoo.es Medellín,
Colombia
