Derivación Biliopancreática
Scopinaro reportó siete pacientes diabéticos de tipo 2, a quienes se les sometió a derivación biliopancreática. En cinco de ellos se diagnosticó diabetes mellitus tipo 2 de 4 a 10 años antes de la cirugía y estaban siendo tratados con hipoglucemiantes orales. En los dos restantes se hizo el diagnóstico durante la valoración prequirúrgica. El seguimiento fue de 13 años (rango de 10 a 18 años). La diabetes mellitus tipo 2 se resolvió en el 100% de los pacientes; todos se encontraban con dieta libre y sin medicación. El peso promedio de los pacientes bajó de 92 kg a 75 kg. Ninguno de ellos perdió peso en exceso y la pérdida de peso se correlacionó directamente con el IMC inicial (49).
Derivación Gastroyeyunal
Cohen, de Brasil, reportó un grupo de 37 pacientes con diagnóstico de diabetes mellitus tipo 2 tratados con, al menos, dos agentes hipoglucemiantes orales, ninguno con insulina, quienes fueron sometidos a derivación gastroyeyunal. La edad promedio fue de 34 años (28 a45), el IMC preoperatorio fue de 32,5±0,88 (32 a 34,9) y el tiempo de seguimiento fue de 6 a 48 meses. El tratamiento quirúrgico resolvió la diabetes mellitus tipo 2 en todos los pacientes y la pérdida promedio de peso excesivo fue de 81% (50).
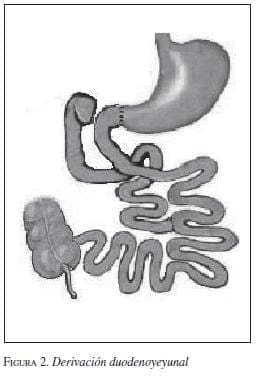
Derivación Duodenoyeyunal
En un interesante artículo, Cohen, Rubino et al. reportaron el seguimiento de 2 de 7 pacientes a quienes se les realizó derivación duodenoyeyunal por laparoscopia (figura 2). La técnica consistió en un abordaje estándar de cinco puertos, con sección del duodeno y una duodenoyeyunostomía término-terminal con anastomosis del asa biliopancreática a 50 cm de la anastomosis proximal. Los pacientes tenían un IMC de 27 y 29 kg/m2, diabetes mellitus tipo 2 de duración de 2 y 7 años, y fueron tratados con 22 IU de Humulin®, y 850 mg/día de metformina, el primero, y rosiglitazone 4 mg/día, el segundo paciente. A los 9 meses de seguimiento, se encontró resolución de la diabetes mellitus tipo 2 en ambos, sin medicamentos y con Hb1Ac de 5 y 5,7 (IMC de 27 y 29,5 kg/m2, respectivamente) (51).
Exclusión Duodenal
Ramos describió 20 pacientes con diabetes mellitus tipo 2 e IMC promedio de 27,1 (rango 25 a 30), quienes se sometieron a exclusión duodenoyeyunal por laparoscopia. La glucemia en ayunas, después de tres a seis meses de seguimiento, varió de 171,3 mg/dl (127 a 242) en el preoperatorio, a 107,1 mg/dl (82 a 145) en el tercer es posoperatorio y a 96,3 mg/dl al sexto mes. Sólo dos pacientes (10%) permanecieron con metformina seis meses después de la cirugía (52).
Interposición del Íleon Combinada con Gastrectomía Tipo Manga (II-DSG)
En una reciente publicación, DePaula et al. presentaron los resultados de 69 pacientes con diabetes mellitus tipo 2 con mínimo 3 años de duración e IMC de 25,7 (rango 41 a 63), a quienes se les realizó una II-DSG. En ésta se formó una manga gástrica con sección del duodeno y se dejó un segmento libre de íleon de 170 cm, cuya sección distal a 30 cm de la válvula ileocecal se anastomosó al duodeno en forma término-lateral. La continuidad del intestino delgado se estableció con una anastomosis término-terminal íleon-yeyuno, con un asa de yeyuno a 50 cm del ángulo de Treitz anastomosada al íleon distal interpuesto. En total, fueron siete líneas de sutura.
Después de un seguimiento promedio de 21,7 meses (rango, 7 a 42 meses), el 95,7% de los pacientes tuvo un control adecuado de la diabetes mellitus sin medicación con los siguientes resultados: HbA1c menor de 6 en el 65,2% de los pacientes, HbA1c de 6,1 a 7 en el 30,5% y HbA1c mayor de 7 en el 4,3% de los pacientes. El IMC preoperatorio disminuyó de 25,7±1,9 kg/m2 (rango, 21,8 a 29,2) a 21,8±4,1 kg/m2 (rango, 17,7 a 25,8) después del procedimiento. (53).
Modelo de Investigación Animal Propuesto en el Hospital Universitario Departamental de Nariño, Universidad de Nariño
En la fisiopatogenia de la diabetes mellitus tipo 2, básicamente, hay una alteración en cuatro variables: entrega de la glucosa, sensibilidad de la insulina, niveles de insulina y regulación de la relación glucagón/ incretinas (54).
Uno de los factores importantes en la resolución de la diabetes mellitus tipo 2 en los pacientes obesos (IMC>30 kg/m2) y con sobrepeso (IMC: 25-29,9 kg/ m2), es la disminución del aporte calórico y, por consiguiente, la oferta y la entrega de glucosa (55). Ambos, la disminución de peso y la restricción calórica, son unos de los principales factores en el control y mejoría de la diabetes mellitus tipo 2 (56,57).
Se ha visto que con el uso de los procedimientos restrictivos puros, como la banda gástrica, se lograntasas de curación entre el 45% y el 90%. Es así como un procedimiento restrictivo como la manga gástrica, en pacientes con sobrepeso y probable resistencia a la insulina, es la primera línea para la curación de la diabetes mellitus tipo 2 y, por esta razón, la proponemos en conjunto con una duodenoyeyunostomía en asa.
La disminución de peso con la gastrectomía en manga, en pacientes no obesos mórbidos, no es tan importante como en los obesos mórbidos. En el estudio de DePaula, los diabéticos sometidos a interposición de íleon más manga gástrica, disminuyeron su peso de un IMC preoperatorio medio de 25,7±1,9 a 21,8±4,1 después de la cirugía (51). Además, la ghrelina se ha visto implicada en la inhibición de la secreción de insulina en humanos, induciendo hiperglucemia. Los niveles de ghrelina disminuyen significativamente después de una gastrectomía tipo manga (58-60).
Técnica Quirúrgica
Estamos proponiendo una anastomosis duodenoyeyunal, preservando los primeros 3 cm del duodeno. Al conservar el píloro, probablemente se eviten la gastritis por reflujo biliar y las úlceras de la anastomosis. La anastomosis duodenoyeyunal debe ubicarse a 100 cm del ángulo de Treitz, suponiendo que a este nivel sea suficiente la exclusión del duodeno y que el reflujo sea mínimo o que, al menos, no alcance a estimular el duodeno.
De forma anecdótica, se comprobó que en lospacientes sometidos a la derivación yeyunoileal de Payne, el reflujo de nutrientes ocurre entre 7 y 10 cmproximalmente (61). Asimismo, con la anastomosis a estenivel, evitamos deficiencias nutricionales y pérdida exagerada de peso. Considerando que en la derivación minigástrica la anastomosis se realiza a 200 cm del ángulo de Treitz, la técnica propuesta cumpliría con los tres principios fundamentales para el control de la diabetes mellitus tipo 2:
1) disminución de peso y disminución del aporte calórico logrado con la manga;
2) adecuados niveles de anti-incretinas, mediante la exclusión duodenal, y
3) aumento de la producción de GLP-1 y otros factores implicados en la resolución de la diabetes mellitus tipo 2, por estimulación directa del intestino distal por medio de la duodenoyeyunostomía (figura 3).

Este es un procedimiento técnicamente fácil, que necesita una única anastomosis y sólo dos líneas de sutura (manga gástrica y muñón duodenal). Por lo tanto, podemos inferir que la tasa de complicaciones sería baja. Actualmente, se realiza la fase de experimentación metabólica en ratas Goto Kakizaki.
Is Diabetes Type 2 an Entity of Surgical Treatment?
Abstract
One of the most amazing findings in bariatric surgery is the resolution of most comorbidities associated with obesity, especially type 2 Diabetes mellitus (T2DM), with remission rates in 84 to 98.9% of the patients. The evidence shows that such remission could not be explained only by the weight loss. There are several theories for explaining the normalization of glycemia as an increase in incretins production (GLP-1) from the distal gut, phenomena related to the exclusion of the nutrients passing through duodenum, hormones like ghreline and other effects not yet descript. A field under crescent investigation is the development of surgical procedures in the management of T2DM in non obese patients.
Key words: diabetes mellitus, type 2; obesity; bariatric surgery; ghrelin.
Referencias
1. NARAYAN KM., BOYLE JP., GEISS LS., SAADINE JB., THOMPSON TJ. Impact of recent increase in incidence on future diabetes burden: U.S., 2005-2050. Diabetes Care. 2006;29: 2114-6.
2. ASCHNER P., KING H., TRIANA M., RODRÍGUEZ BM. Glucose intolerance in Colombia. A population-based survey in an urban community. Diabetes Care. 1993; 16:90-3.
3. LEIBSON CL., O´BRIEN PC., ATKINSON E., PALUMBO PJ., MELTON LJ. Relative contributions of incidence and survival to increasing prevalence of adult-onset diabetes mellitus: A population based study. Am J Epidemiol. 1997; 146: 12-22.
4. Center for Control Disease Morbidity and mortality Weekly Report. 2004; 53:1066-8.
5. BUCHWALD H., AVIDOR Y., BRAUNWALD E., JENSEN MD., PORIES W., FAHRBACH K., SCHOELLES, K. Bariatric surgery: a systematic review and meta-analysis. JAMA. 2004;292:1724-37
6. PORIES WJ., SWANSON MS., MACDONALD KG., LONG SB., MORRIS PG., BROWN BM. et al. Who would have thought it? An operation proves to be the most effective therapy for adult-onset diabetes mellitus. Ann Surg. 1995; 222:339-52.
7. DIXON JB., O´BRIEN PE., PLAYFAIR J., CHAPMAN L., SCHACHTER LM., SKINNER S., et al. Adjustable gastric banding and conventional therapy for type 2 diabetes. JAMA. 2008; 299:316-23.
8. American Diabetes Association. Prevention or delay of type 2 diabetes. Diabetes Care. 2004;27(Suppl.1):s47-53.
9. PATIÑO JF. Cirugía Bariátrica. Rev Colomb Cir. 2003;18:28-50.
10. BAYLISS WM., STARLING EH. On the causation of the so-called “peripheral reflex secretion” of the pancreas. Proc R Soc Lond Biol. 1902;69:352-3.
11. LA BARRE J. Sur les possibilities d’un traitement du diabete par l’incretine. Bull Acad R Med Belg. 1932;12:620-34.
12. MCINTYRE N., HOLSWORTH DC., TURNER DS. New Interpretation of oral glucose tolerance. Lancet. 1964; 2:20-1.
13. ELRICK H., STIMMLER L., HLAD CJ. JR., ARAI Y. Plasma insulin response to oral and intravenous glucose administration. J Clin Invest. 1964;24: 1076-82.
14. MOJSOV S., WEIR GC., HABENER JF. Insulinotropin: glucagon-like peptide I (7-37) co-encoded in the glucagon gene is a potent stimulator of insulin release in the perfused rat pancreas. J Clin Invest. 1987;79:616-9.
15. KREYMANN B., WILLIAMS G., CHATEI MA., BLOOM SR. Glucagonlike peptide 1 7-36: a physiological incretin in man. Lancet.1987; 2:1300-4.
16. HELLER RS., STOFFERS DA., LIU A., SCHEDL A., CRENSHAW EB. 3RD, MADSEN OD., et al. The role of BM4/Pou3f4 and Pax6 in forming the pancreatic glucagon cell identity. Dev Biol. 2004; 268:123-34.
17. HOLZ GG., KUHTREIBER WM., HABENER JF. Pancreatic beta-cells are rendered glucose–competent by the insulinotropic hormone glucagon- like peptide-1 (7-37). Nature. 1993; 361:362-5.
18. BUTEAU J., EL-ASSAD W., RHODES CJ., ROSEMBERG L., JOLY E., PRENTKI M. Glucagon-like peptide-1 prevents beta cell glucolipotoxicity. Diabetologia. 2004;47:806-15.
19. FARILLA L., BULOTTA A., HIRSHBERG B., LI CALZI S., KHOURY N., NOUSHMEHR H., et al. GLP-1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets. Endocrinology. 2003;144:5149-58.
20. YUSTA B., BAGGIO LL., ESTALL JL., KOEHLER JA., HOLLAND DP., LI H., et al. GLP-1 receptor activation improves beta cell function and survival following induction of endoplasmic reticulum stress. Cell Metab. 2006; 4:391-406.
21. WILLMS B., WERNER J., HOLST JJ., ORSKOV C., CREUTZFELD W., NAUCK MA. Gastric emptying, glucose responses and insulin secretion after a liquid test meal: effects of exogenous glucagonlike peptide-1 (GLP-1) amide in type 2 (noninsulin-dependent) diabetic patients. J Clin Endocrinol Metab. 1996; 81:327-32.
22. MEIER JJ., GALLWITZ B., SALMEN S., GOETZE O., HOLST JJ., SCHMIDT WE., et al. Normalization of glucose concentrations and deceleration of gastric emptying after solid meals during intravenous glucagon-like peptide 1 in patients with type 2 diabetes. J Clin Endocrinol Metab. 2003;88: 2719-25.
23. TSENG CC., KIEFFER TJ., JARBOE LA., USDIN TB., WOLFE MM. Postprandial stimulation of insulin release by glucose-dependent insulinotropic polypeptide (GLP). Effect of a specific glucosedependent insulinotropic polypeptide receptor antagonist in the rat. J Clin Invest. 1996; 98:2440-5.
24. MIYAWAKI K., YAMADA Y., YANO H., NIWA H., BAN N., IHARA Y., et al. Glucose intolerance caused by a defect in the entero-insular axis: a study in gastric inhibitory polypeptide receptor knockout mice. Proc Natl Acad Sci USA. 1999; 96:14843-7.
25. KIM SJ., WINTER K., NIAN C., TSUNEOKA M., KODA Y., MCINTOSH CH. GIP stimulation of pancreatic beta-cell survival is dependent upon phosphatidylinositol 3-kinase (PI3-K)/protein kinase B (PKB) signaling, inactivation of the forkhead transcription factor Foxo1 and down regulation of bax expression. J Biol Chem. 2005; 280:22297-307.
26. VILSBOLL T., KRARUP T., DEACON CF., MADSBAD S., HOLST JJ. Reduced postprandial concentrations of intact biologically active glucagon-like peptide 1 in type 2 diabetic patients. Diabetes. 2001; 50:609-13.
27. NAUCK MA., HEIMESAAT MM., ORSKOV C., HOLST JJ., EBERT R., CREUTZFELDT W. Preserved incretin activity of glucagon-like peptide 1 [7-36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus. J Clin Invest. 1993; 91:301-7.
28. TODD JF., EDWARDS CM., GHATEI MA., MATHER HM., BLOOM SR. Subcutaneous glucagon–like peptide-1 improves postprandial glycaemic control over a 3-week period in patients with early type 2 diabetes. Clin Sci (Lond) 1998;95:325 -9
29. YOUNG AA., GEDULIN BR., BHAVSAR S., BODKIN N., JODKA C., HANSEN B., et al. Glucose-lowering and insulin-sensitizing actions of exendin-4: studies in obese diabetic (ob/ob,db/db) mice, diabetic fatty Zucker rats, and diabetic rhesus monkeys (Macaca mulatta). Diabetes. 1999; 48:1026-34.
30. BUSE JB., HENRY RR., HAN J., KIM DD., FINEMAN MS., BARON AD. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea. Diabetes Care. 2005; 143:559-69.
31. AHREN B., SIMONSSON E., LARSSON H., LANDIN-OLSSON M., TORGEIRSSON H., JANSSON PA., et al. Inhibition of dipeptidyl peptidase IV improves metabolic control over a 4-week study period in type 2 diabetes. Diabetes Care. 2002; 25:869-75.
32. TROY S., SOTY M., RIBEIRO, LAVAL L., MIGRENNE S., FIORAMONTI X., et al .Intestinal gluconeogenesis is a key factor for early metabolic changes alter gastric bypass but not alter gastric lapband in mice. Cell Metab. 2008;8:201-11.
33. LAFERRÈRE B., TEXEIRA J., MCGINTY J., TRAN H., EGGER JR., COLARUSSO A. et al. Effect of weight loss by gastric bypass surgery versus hypocaloric diet on glucose and incretin levels in patient with type 2 diabetes. J Clin Endocrinol Metab. 2008; 93:2479-85.
34. PARIKH M., AYOUNG-CHEE P., ROMANOS E., LEWIS N., PACHTER HL., FIELDING G., et al. Comparison of rates of resolution of diabetes mellitus after gastric banding, gastric bypass and biliopancreatic diversion. J Am Coll Surg. 2007; 205:631-5.
35. DIXON JB., O’BRIEN PE. Health outcomes on severely obese type 2 diabetic subjects 1 year after laparoscopic adjustable gastric banding. Diabetes Care. 2002; 25:358-62.
36. DOLAN K., BRYANT R., FIELDING G. Treating diabetes in the morbidly obese by laparoscopic gastric banding. Obes Surg. 2003; 13:439-43.
37. PONCE J., HAYNES B., PAYNTER S., FROMM R., LINDSEY B., SHAFER A., et al. Effect of Lap-Band® induced weight loss on type 2 diabetes mellitus and hypertension. Obes Surg. 2004; 14:1335-42.
38. VIDAL J., IBARZABAL A., ROMERO F., DELGADO S., MOMBLÁN D., FLORES L., et al. Type 2 diabetes mellitus and the metabolic syndrome following sleeve gastrectomy in severely obese subjects. Obes Surg. 2008; 18:1077-82.
39. PONTIROLI AE., FOLLI F., PAGANELLI M., MICHELETTO G., PIZZOCRI P., VEDANI P., et al. Laparoscopic gastric banding prevents type 2 diabetes and arterial hypertension and induces their remission in morbid obesity. Diabetes Care. 2004; 28:2703-9.
40. MOO T., RUBINO F. Gastrointestinal surgery as treatment for type 2 diabetes. Curr Opin Endocrinol Diabetes Obes. 2008; 15:153-8.
41. SCOPINARO N., PAPADIA F., CAMERINI G., ADAMI GF., MARINARI G. A comparison of a personal series of biliopancreatic diversion and literature data on gastric bypass help to explain the mechanism of resolution of type 2 diabetes by the two operations. Obes Surg. 2008;18:1035-8.
42. NASLUND E., BACKMAN L., HOLST JJ., THEODORSSON E., HELLSTROM PM. Importance of small bowel peptides for the improved glucose metabolism 20 years after jejunoileal bypass for obesity. Obes Surg. 1998; 8:253-60.
43. DE PAULA AL., MACEDO A., PRUDENTE A., SILVA L., SCHRAIBMAN V., NETO JG, et al. Neuroendocrine brake for the treatment of morbid obesity: preliminary report. Einstein 2005; 3(2):110-114.
44. DE PAULA AL., MACEDO A., RASSI N., MACHADO CA., SCHRAIBMAN V, SILVA LQ. et al Laparoscopic treatment of type 2 diabetes mellitus for patients with a body mass index less than 35. Surg Endosc. 2008; 22:706-16.
45. MILTON K. Primate diets and gut morphology: implications for human evolution. In: Harris M, Ross EB, editors. Food andevolution. Toward a theory of human food habits. Philadelphia: Temple University Press; 1987.
46. SANTORO S. Adaptive and neuroendocrine procedures: A new pathway in bariatric and metabolic surgery. Obes Surg. 2008; 18:1343-5.
47. SANTORO S., MALZONI CE., VELHOTE MCP., MILLEO FQ., SANTO MA., KLAJNER S., et al. Digestive adaptation with intestinal reserve: A neuroendocrine-based procedure for morbid obesity. Obes Surg. 2006; 16:1371-9.
48. SANTORO S., MILLEO FQ., MALZONI CE., KLAJNER S., BORGES PCM., SANTO MA., et al. Enterohormonal changes after digestive adaptation: five-year results of a surgical proposal to treat obesity and associated diseases. Obes Surg. 2008; 18:17-26.
49. SCOPINARO N., PAPADIA F., MARINARI G., CAMERINI G., ADAMI G. Long –term control of type 2 diabetes mellitus and the other major components of the metabolic syndrome after biliopancreatic diversion in patients with BMI < 35 kg/m2. Obes Surg. 2007; 17:185-92.
50. COHEN RV., PINHEIRO JS., CORREA JL., SCHIAVON CA. Laparoscopic Roux-en-Y gastric bypass for BMI<35 kg/m2; a tailored approach. Surg Obes Relat Dis. 2006; 2:401-4.
51. COHEN RV., SCHIAVON CA., PINHEIRO JS., CORREA JL., RUBINO F. Duodenal-jejunal bypass for the treatment of type 2 diabetes in patients with body mass index of 22-34 kg/m2: a report of 2 cases. Surg Obes Relat Dis. 2007; 3:195-7.
52. RAMOS AC., GALVAO MP., DE SOUZA YM., GALVAO M., MURAKAMI A., SILVA AC., et al. Laparoscopic duodenal-jejunal exclusion in the treatment of type 2 diabetes mellitus in patients with BMI < 30 kg/m2 (LBMI). Obes Surg. 2009;19:307-12.
53. DE PAULA AL., MACEDO ALV., MOTA BR., SCHRAIBMAN V. Laparoscopic ileal interposition associated to a diverted sleeve gastrectomy is an effective operation for the treatment of type 2 diabetes mellitus patients with BMI 21-29. Surg Endosc 2009; 23:1313–1320.
54. ROTHKOPF MM., BILOF ML., HAVERSTICK LP., NUSBAUM MJ. Synergistic weight loss and diabetes resolution with exenatide administration after laparoscopic gastric banding. Case Report. Surg Obes Relat Dis. 2009;5:128-31
55. GUMBS AA., MODLIN IM., BALLANTYNE GH. Changes in insulin resistance following bariatric surgery: role of caloric restriction and weight loss. Obes Surg. 2005; 15:462-73.
56. WING RR., MARCUS MD., SALATA R., EPSTEIN LH., MIASKIEWICZ S., BLAIR EG. Effects of a very-low-calorie diet on long term glycemic control in obese type 2 diabetic subjects. Arch Intern Med. 1991; 151:1334-40.
57. HENRY RR., SCHEAFFER L., OLEFSKY JM. Glycemic effects of intensive caloric restriction and isocaloric refeeding in non-insulin-dependent diabetes mellitus. J Clin Endocrinol Metab. 1985; 61:917-25.
58. BROGLIO F., ARVAT E., BENSO A., GOTTERO C., MUCCIOLI G., PAPOTTI M. et al. Ghrelin, a natural GH secretagogue produced by the stomach, induces hyperglycemia and reduces insulin secretionin humans. J Clin Endocrinol Metab. 2001; 86: 5083-6.
59. BROGLIO F., GOTTERO C., PRODAM F., GAUNA C., MUCCIOLI G., PAPOTTI M. et al. Non-acylated ghrelin counteracts the metabolic but not the neuroendocrine response to acylated ghrelin in humans. J Clin Endocrinol Metab. 2004; 89:3062-5.
60. LANGER FB., REZA HODA MA., BOHDJALIAN A., FELBERBAUER FX.,ZACHERL J., WENZL E. et al. Sleeve gastrectomy and gastric banding: effects on plasma ghrelin levels. Obes Surg. 2005; 15:1024-9.
61. BALTHAZAR EJ, GOLDFINE S. Jejunoileal bypass. Roentgenographic observations. Am J Roentgenol. 1975; 125:138-42.[* No filter found for the requested operation. | In-line *]
Correspondencia:
GERMÁN ROSERO, MD, MACC
Correo electrónico: rosero@hotmail.com
Pasto, Nariño
