En la Obstrucción Maligna Esofágica y Gastroduodenal
RODRIGO CASTAÑO LLANO*, OSCAR ÁLVAREZ BARRERA*, JORGE LOPERA BONILLA*, MARIO H. RUIZ VÉLEZ*,FABIÁN JULIAO BAÑOS*, EUGENIO SANÍN FONNEGRA*, FARUK EREBRIE GRANADOS*, ANDRÉS CÁRDENAS VÁSQUEZ*
Palabras clave: prótesis, cáncer de esófago, cáncer de estomago, endoscopia gastrointestinal.
Resumen
El manejo de la obstrucción maligna gastrointestinal representa un gran reto. La mayoría de los pacientes se encuentran en un avanzado estado de descompensación por su tumoración de base y no son buenos candidatos para procedimientos quirúrgicos mayores. Recientemente, las prótesis metálicas autoexpandibles han emergido como una alternativa efectiva y segura, con menor invasión para el tratamiento de la obstrucción maligna esofágica y gastroduodenal. El presente estudio evalúa en forma prospectiva la experiencia con 99 stents esofágicos y 60 gastroduodenales en los últimos 4 años, con una revisión de la literatura.
El éxito técnico y clínico fue del 96 y 85% respectivamente. La mayoría de los pacientes toleraron la dieta oral a las 36 horas de la colocación del stent. No hubo complicaciones mayores como sangrado, perforación o muertes. En 13 pacientes hubo manifestaciones de obstrucción del stent que se manejaron endoscópicamente. Nuestro estudio confirma la eficacia de los stents en la paliación de la obstrucción maligna gastroduodenal y esofágica con unos índices de complicación bajo.
Introducción
El tratamiento paliativo en el cáncer gastrointestinal alto está dirigido principalmente al alivio de la obstrucción, causa frecuente de desnutrición y morbimortalidad; además, debe ser rápidamente efectivo, seguro y bien tolerado. El uso de endoprótesis metálicas autoexpandibles (EMA) ha revolucionado la paliación de las obstrucciones malignas del tracto gastrointestinal y biliar, que a menudo enfrenta el cirujano en pacientes con alto riesgo quirúrgico. En la actualidad hay varias opciones para la elección de la endoprótesis más adecuada, la cual se debe fundamentar en las propiedades biofísicas, interacción con los tejidos vecinos, características anatómicas de cada paciente y, por supuesto, costos y disponibilidad en el medio.
Una característica común de las EMA radica en su capacidad para ser colapsadas en un sistema introductor de diámetro pequeño, lo cual facilita su ubicación a través de las estenosis orgánicas. Las características del material de fabricación de las EMA, así como su diseño geométrico determinan la fuerza de expansión, como también el grado de acortamiento una vez colocada. Las ventajas de las EMA incluyen alta efectividad por su adecuado lumen interno, fácil colocación con bajo índice de complicaciones, utilización de sedación únicamente como un procedimiento ambulatorio y buena tolerancia por el paciente por lo pequeño de los sistemas introductores. A pesar de una amplia experiencia en el ámbito mundial, el uso de las prótesis en general en nuestro medio ha estado restringido por los altos costos de las mismas y de los sistemas introductores.
En esta revisión se evalúan las características de la interacción de las endoprótesis con los tejidos, las indicaciones para su uso, aspectos técnicos y los resultados con el uso de las EMA en la obstrucción maligna esofágica y gastroduodenal, también se destaca la experiencia con el uso de una prótesis de nitinol desarrollada localmente.
Biomateriales y Biodisponibilidad
Las características de la expansión o la elasticidad de las EMA dependen de la amalgama de los metales utilizados, lo que también influye en la fuerza de expansión una vez colocadas. Las EMA tejidas con un solo filamento tienen un mayor grado de acortamiento que las articuladas (figuras 1 y 2).
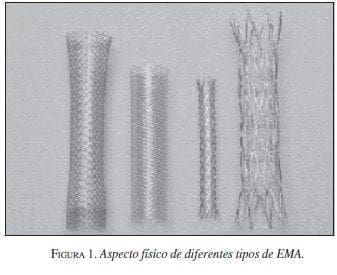 |
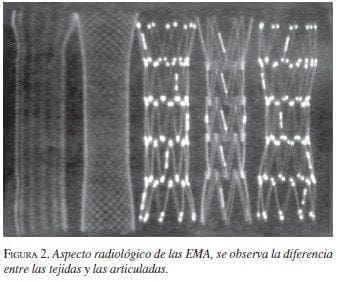 |
A partir de los años ochenta se han presentado modificaciones en las características del material utilizado; inicialmente se implementó el elgiloy (Wallstent, Boston Scientific, Natick, MA), una mezcla en la que predominaba el cobalto, y que fue remplazado por el acero (Z stent, Wilson Cook, Winston-Salen, NC) y más recientemente por el nitinol, mezcla de níquel y titanio (McIntee, 1999) (tabla 1).
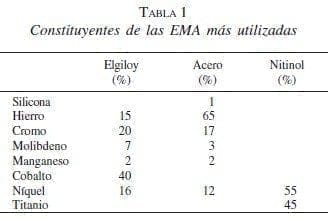
El nitinol es el elemento con el que se han construido las EMA localmente desde 1999 (Medellín, Tecnostent), fabricación que cuenta con el aval y el soporte técnico de la casa matriz en Corea (Stentech).
Otras EMA de nitinol son el Ultraflex (Boston Scientific), Diamond (Boston Scientific), Za (Wilson Cook Medical, Winston-Salen, NC) y el Memotherm (CR Bard, Inc, Billerica, MA). Las EMA de nitinol de Ultraflex como las de Tecnostent tienen una fabricación similar a partir de un monofilamento trenzado, con un porcentaje de acortamiento tras su liberación del 30-40%. En la variedad Diamond, con la construcción de las celdas en diamante y su distribución intercalada en la prótesis, se previene este acortamiento durante su liberación (Nelson, 2001).
Fuerza radial y flexibilidad axial
La fuerza radial de las EMA para obtener su máxima expansión debe sobrepasar las fuerzas compresivas de la causa de la estenosis. Aunque los estudios experimentales en el laboratorio se pretenden extrapolar a la práctica in vivo con las EMA, debe tenerse en cuenta que in vivo los puntos de presión son asimétricos y en condiciones de temperatura y movimiento no previstas. En dos estudios (Chan, 1999 y Moon, 2001) se demuestra que la fuerza de expansión del Wallstent es mayor al Z stent, el cual a su vez es superior al Ultraflex. La cifra óptima de la fuerza radial o expansiva no se conoce.
La flexibilidad axial también se ha evaluado y hace referencia a la capacidad de tolerar las angulaciones, permitiendo un radio interno apropiada sin colapsarse.
El estudio de Chan (1999) demostró al Wallstent como el más flexible, seguido por el Ultraflex y por último el Z stent. La flexibilidad axial es un factor importante para considerar cuando se pretende paliar una estenosis muy tortuosa o angulada.
Recubrimientos
Generalmente las EMA para el esófago tienen una cubierta externa, mientras que las usadas en la vía biliar y colon son descubiertas; las prótesis tipo Wallstent y la Ultraflex vienen en las dos presentaciones. Otra variación son las prótesis valvuladas para situaciones en que se franquea la unión gastroesofágica, para evitar el reflujo gastroesofágico: las de Wallstent tienen una prolongación de 8 cm del poliuretano que las recubre y la presión intraabdominal colapsa el mecanismo valvular impidiendo el reflujo.
En los casos de fístulas esofagorrespiratorias es mandatorio el uso de prótesis recubiertas, para ocluir la fístula. Las EMA recubiertas impiden la colonización tumoral, causa frecuente de oclusión tardía; sin embargo, interrumpen la incorporación del tejido a la prótesis, lo que facilita la migración, según Kosarek (1996). Para balancear estas opciones, la mayoría de las EMA tiene un segmento descubierto en cada extremo para prevenir las migraciones, con una significativa menor migración y colonización. Vakil (2001).
Los materiales usados para este recubrimiento son el poliuretano, teflón, silicona y polietileno. Nelson (2001).
Sistema introductor
Los sistemas introductores de las EMA incorporan un mecanismo para constreñir la prótesis dentro del mismo y dejar la prótesis en posición. Al remover este sistema introductor, la prótesis es liberada. El sistema más común es una cubierta externa que es retraída o removida, lo que le permite a la prótesis expandirse de distal a proximal. Otros sistemas son el Ultraflex que trae una sutura que cubre la prótesis y se retira al liberarla; viene en las dos formas, de distal a proximal o al contrario. El Z stent no viene premontado, y el usuario debe cargarlo manualmente en el catéter introductor.
En la prótesis producida en nuestro medio, el sistema introductor se fabrica con un tubo de politetrafluoroetileno con un diámetro externo de 6 mm y el “pusher” o empujador con teflón, con un diámetro de 4 mm. La punta del introductor es una pieza de nailon que semeja una bala con la punta aguzada suavemente. El sistema se debe avanzar sobre una guía de 0,038 pulgadas (figura 3).
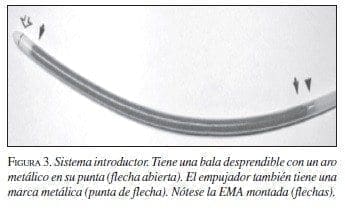
Respuesta tisular o biodisponibilidad
Bethge y Vakil (1996) postularon una secuencia de eventos una vez es liberada la EMA. Inicialmente, la EMA se expande ypresiona la estenosis y el tejido normal. Al continuarse la presión el tejido subyacente a la prótesis sufre necrosis secundaria a la presión y se produce migración de la prótesis a las capas más profundas del tumor o del tejido normal (figura 4).
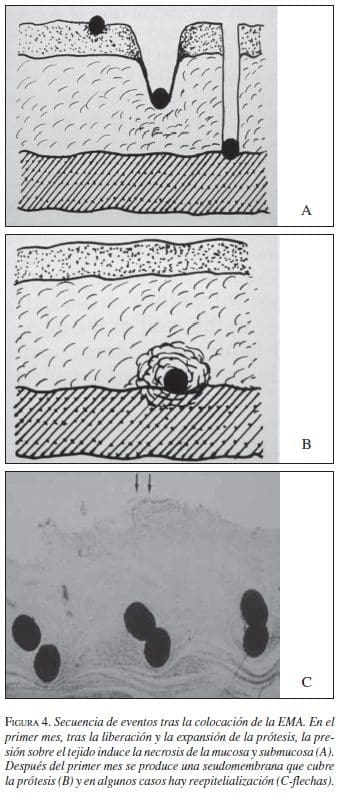
Después del primer mes se produce una seudomembrana que cubre la prótesis (B) y en algunos casos hay reepitelialización (C- lechas).
Una reacción inflamatoria crónica ocurre en la mucosa y submucosa, se produce colágeno y fibrosis y la EMA se involucra en medio de este tejido reactivo. La regeneración epitelial puede darse en algunos casos y cubrir la EMA; en otros, es cubierta por material colágeno evitando el contacto de la prótesis con la luz intestinal e incluso ocultándola a la visualización endoscópica.
Incorporación tisular
Silvis (1994) en estudios de prótesis metálicas no cubiertas en colédocos caninos demostró la penetración a mucosa y submucosa, y ocasionalmente proximidad a la serosa. Las prótesis cubiertas no muestran esta imbricación al tejido. Un estudio de Cwikiel (1993) con prótesis descubiertas en esófagos de cerdo inicialmente demostró necrosis por la presión a la mucosa, con penetración progresiva hasta incluso la muscular propia, esto se acompañó de la progresión de la fibrosis.
Una secuencia similar se presentó en una serie descrita por Hausegger (1992) en 15 pacientes estudiados post mortem, con paliación de la obstrucción biliar maligna con EMA descubiertas, por 5 días hasta 21 meses. Con la progresión del tiempo se incrementó la incorporación de la prótesis al tejido y la fibrosis local, lo cual sirve para fijar la prótesis y prevenir su migración (figura 5).

Hiperplasia mucosa benigna
Diferentes estudios del comportamiento de las EMA en la vía biliar (Maccioni, 1992 y Veis, 1994) demuestran una evolución diferente para las estenosis malignas con respecto a las benignas; en las últimas más frecuentemente hay obstrucción producida por hiperplasia benigna mucosa demostrada en estudios que confirman histológicamente la misma. Una explicación a esta diferencia es dada por el mayor tiempo de interacción de las prótesis con los tejidos vecinos en los casos de obstrucciones benignas, lo que no sucede en las malignas. (Cwikiel, 1993; Chen, 2000; Mayoral, 2000) (figuras 6 y 7).
 |
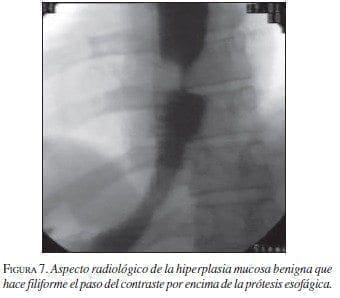 |
Los hallazgos histológicos muestran tejido de granulación, células gigantes de cuerpo extraño, fibrosis o hiperplasia reactiva. El desarrollo de esta obstrucción no maligna no parece relacionarse con el tipo de EMA, o al recibir quimiorradioterapia antes o después de su colocación.
Compatibilidad con la resonancia magnética nuclear
Según McIntee (1999), los Wallstent han sido evaluados en resonancia magnética y son considerados seguros y con mínima degradación de la imagen. Las EMA de nitinol también han sido estudiadas y se consideran no magnéticas. Según Taal (1997), sólo las prótesis con acero han mostrado artificios con la resonancia magnética.
Compatibilidad con la quimiorradioterapia
Kinsman (1996) y Siersma (1999) sugieren que las EMA colocadas después que el esófago ha recibido quimio y radioterapia tienen mayor índice de complicaciones, que las colocadas en un esófago normal. Estas complicaciones consisten en fístulas esófago- espiratorias, necrosis del esófago, y erosiones de la aorta. También se han descrito exclusivamente con la radioterapia. Raijman (1998) no ha demostrado esta mayor incidencia de complicaciones.
Bethge (1997) encontró que las dosis de radiación fueron similares para quienes presentaban o no complicaciones fatales con las EMA.
Chowhan (1990) describió detalladamente los efectos de la quimio y radioterapia sobre el esófago. En las etapas iniciales, la radioterapia induce ulceración y descamación de la mucosa, que se puede extender a capas más profundas. Con el tiempo suele aparecer fibrosis, la cual puede comprometer la capa muscular del órgano.
La ulceración y necrosis de un tumor esofágico que compromete la aorta puede precipitar una hemorragia mortal o el desarrollo de fístulas mediastinales. Vakil (1999) afirma que las fibras metálicas de una EMA en un tejido desvitalizado pueden migrar a través de la pared al mediastino. Sin embargo, estudios más recientes de seguimiento en pacientes con tumores de esófago sometidos a quimio y radioterapia antes (Sumiyoshi, 2003) y después (Yu, 2004) de la colocación de las EMA, no mencionan complicaciones.
* Grupo de Gastrohepatología y nutrición. Universidad de Antioquia.
