Eficacia y Seguridad de la PiperacilinalTazobactam en el Tratamiento de la Infección/Intraabdominal en Colombia
GUSTAVO A. QUINTERO, ROOSEVELT FAJARDO, MIRIA M SERRANO, ANDRÉS ÁLVAREZ, ALBERTO GARCíA, JORGE E. FRANCO, ANDRÉS MARTÍNEZ, GABRIEL GÓMEZ, CARLOS H. LERMA, JULIO ALBERTO NIETO.
Resumen
La infección intraabdominal (IIA) es un reto para el cirujano. El tratamiento consiste en la combinación de cirugía, antibióticos y cuidado intensivo. Los antibióticos b-lactámicos juegan un papel importante en el tratamiento. Las penicilinas tienen un gran potencial de acción y, en combinación con inhibidores de b-lactamasas, su poder se aumenta.
El presente estudio se diseñó multicéntrico y prospectivo para evaluar la eficacia de la Piperacilina/Tazobactam (Tazocin‚) en el tratamiento de la IIA; 40 pacientes fueron incluidos en el estudio y tratados con Piperacilina/Tazobactam (4 g/500 mg) cada 8 horas. Todos los pacientes tuvieron peritonitis, 85% de ellos por causa de apendicitis gangrenosa perforada.
La respuesta clínica favorable ocurrió en 91% de los casos después de tratamiento con duración entre 6 y 14 días. En 71 aislamientos microbiológicos realizados, prevaleció la flora polimicrobiana. Piperacilina/Tazobactam tuvo una sensibilidad de 93% para los gérmenes aislados aeróbicos Gram negativos y Gram positivos así como para anaerobios.
Hubo tres cepas resistentes in vitro en los 71 aislamientos: una cepa de Pseudomonas aeruginosa, una cepa de Klebsiella pneumoniae y otra de Citrobacter freundii. La medicación fue bien tolerada y sus efectos colaterales nulos.
Introducción
La IIA es un problema serio para el cirujano. El tratamiento se basa en la combinación de cirugía, tratamiento antimicrobiano y medidas de soporte en cuidado intensivo. Los antibióticos b-lactámicos juegan un papel principal en el tratamiento de la peritonitis y, en combinación con los inhibidores de b-lactamasas, las penicilinas tienen una importancia aún mayor que antes.
La IIA es causada por la microflora endógena intestinal y usualmente es polimicrobiana con presencia de bacteria aerobias y anaerobias Gram positivos y Gram negativos tales como Bacteroides fragilis, clostridia y cocos anaerobios que son los más comúnmente recuperados en los cultivos1.
Los antibióticos que se utilizan en este tipo de infección deben de ser activos contra los aerobios y anaerobios de origen intestinal. Por mucho tiempo la combinación de clindamicina o metronidazol con aminoglucósidos ha sido el régimen antimicrobiano más útil; sin embargo, también se utilizan otras combinaciones o monoterapia con antibióticos de amplio espectro2.
El tazobactam es un inhibidor de b-lactamasas del ácido penicilánico de la clase de las sulfonas. Su estructura es similar a la del sulbactam, pero es más activo que el sulbactam contra las bacterias productoras de b-lactamasas del tipo II y V mediada por plásmidos y es más activo que el ácido clavulánico contra las de clase I del tipo cromosomal3.
La piperacilina es una penicilina de amplio espectro que ha sido ampliamente utilizada para el tratamiento de infecciones serias. Es activa contra la mayoría de las enterobacterias y tiene también buena actividad contra enterococo y la mayoría de bacterias anaerobias4.
La diseminación de microorganismos productores de b-lactamasas, ha producido una gran preocupación sobre el uso de piperacilina sola y se ha sugerido que se combine con un inhibidor de b-lactamasas como lo es el tazobactam. Los estudios in vitro han demostrado que la Piperacilina/Tazobactam es una de las combinaciones más activas contra una enorme variedad de bacterias Gram negativas multirresistentes así como bacterias anaerobias y que tiene muy buena aplicabilidad en el tratamiento de la infección intraabdominal5.
En Colombia, la IIA es también un problema serio como en cualquier otro lugar del mundo. El tratamiento de la sepsis de origen abdominal se basa en nuestro medio en tres pilares: un adecuado y oportuno régimen antibiótico, una técnica quirúrgica depurada y un soporte hemodinámico y metabólico del paciente que evite la aparición de una segunda injuria biológica.
Desde el punto de vista antibiótico, las recomendaciones provenientes de la Sociedad de Infectologia Quirurgica (EE.UU.) incluyen antibiótico en monoterapia del tipo cefoxitin, ampicilina/sulbactam, imipenem/cilastatina o combinaciones como clindamicina + aminoglucósido.
Piperacilina/Tazobactam tiene, probablemente, el espectro antimicrobiano más extenso contra bacterias Gram negativas y en Colombia, por fortuna, no ha sido utilizada en gran forma, lo que permite tenerla aún como una herramienta más para ser usada en este tipo de pacientes; por lo anterior, en nuestro país, hay un vacío de información sobre su utilización en pacientes con peritonitis6.
Consideraciones Generales
El término infección intraabdominal (IIA) se utiliza para describir una amplia gama de procesos infecciosos en el abdomen. El común denominador de tales procesos es que todos tienen microorganismos que colonizan otros sitios a partir del tracto gastrointestinal, generalmente estériles, en el abdomen o sus anexos.
En el manejo de esas infecciones con agentes antimicrobianos se deben tomar otras medidas adicionales para asegurar el éxito en el tratamiento de esta patología.
La IIA se clasifica en: Complicada (aquella que necesita un procedimiento quirúrgico); No-complicada (aquella que se maneja médicamente sin intervención quirúrgica); e Infección del Sitio Operatorio (ISO), que puede ser superficial o profunda. Los casos de IIA que mencionaremos en este artículo corresponden todos a la del tipo complicada que requirieron tratamiento quirúrgico por definición.
Diagnóstico y Tratamiento Actual
Aproximadamente un 80% de la IIA se debe a microor-ganismos adquiridos en la comunidad. Los síntomas son de corta duración. La historia clínica y los hallazgos físicos en el examen, la radiografía simple del abdomen y el perfil hematológico estándar generalmente proveen suficiente evidencia para diagnosticar una IIA. La tomografía axial computadorizada (TAC) y la resonancia nuclear magnética (RNM), así como el lavado peritoneal o el ultrasonido (US), pueden ayudar en el diagnóstico.
La urgencia para la intervención quirúrgica está determinada por la presencia de peritonitis y/o de síndrome séptico. El síndrome séptico incluye hipotensión, taquicardia, fiebre y un intercambio gaseoso pulmonar alterado y se asocia con alta mortalidad7.
Frecuentemente es necesario instituir tratamiento antiinfeccioso y operar antes de que se pueda confirmar el origen de la infección. La tendencia en las últimas dos décadas ha sido empezar antibióticos inmediatamente, intervenir quirúrgicamente en forma temprana y utilizar procedimientos que extirpen el foco de inflamación y el tejido adyacente8.
En el caso específico de una cirugía de urgencia, la información microbiológica no se logra previamente a la cirugía ni antes de 24 a 48 horas. Los antimicrobianos se inician antes de la operación y en forma empírica, y su elección depende del conocimiento de las bacterias comúnmente encontradas en la IIA. Cuando no se conoce el sitio exacto de la infección, la terapéutica debe dirigirse hacia la flora mixta del intestino, que incluye Gram negativos facultativos y anaerobios comunes tales como Clostridium y Bacteroides spp9.
Un régimen antiinfeccioso común es la combinación de aminoglucósidos con un agente anaerobicida como el metronidazol o la clindamicina. Muchos cirujanos prefieren agregar ampicilina para cubrir enterococo. En cuanto a la terapia de avanzada con un solo agente, cefoxitin es el más comúnmente utilizado. Imipenem/Cilastatina es equivalente al uso de un régimen de combinación.10 11
Estudios in Vitro con Piperacilina/Tazobactam
Rangos de valores promedio del 90% de Concentración Inhibitoria Mínima (MIC90) se demuestran en diferentes estudios12, 13,14.
Piperacilina/Tazobactam tiene una buena actividad in vitro contra la mayoría de los Gram positivos, incluidos aquellos productores de b-lactamasas similar a la de la ampicilina/sulbactam y mucho más amplia que la del ácido clavulánico/ticarcilina15.
La combinación Piperacilina/Tazobactam tiene una excelente actividad in vitro contra las cepas de Staphylococcus aureus meticilino-resistentes y el Staphylococcus coagulasa-negativo16.
Piperacilina/Tazobactam como otros agentes combinados b-lactámicos/b-lactamasas, es inactivo contra S. aureus meticilino-resistentes y es generalmente inactivo contra otras cepas de Staphylococcus meticilino-resistente, incluyendo los coagulasa negativos.
S. pneumoniae penicilino-sensible es altamente susceptible a Piperacilina/Tazobactam. Piperacilina/Tazobactam, tiene mejor actividad que el ácido clavulánico/ticarcilina contra S. pneumoniae penicilino-susceptible, intermedio y penicilino-resistente17.
Piperacilina/Tazobactam fue también efectiva contra S. bovie, S. agalactie y Estreptococos del grupo C y G. Tiene actividad contra Enterococo faecalis incluidos aquellos gentamicino-resistentes que muestran una susceptibilidad intermedia18.
Es activo contra una gran variedad de bacterias Gram negativas productoras de b-lactamasa mediada por plásmidos (y de cepas no- b-lactamasas productoras). Algunos bacilos no fermentadores son también susceptibles a la combinación.
Enterobacteriáceas del tipo E. coli, S. marcescens, Proteus mirabilis, P. vulgaris, Klebsiella pneumoniae, K. oxytoca (y otras Klebsiella spp), Enterobacter aerogenes y Citrobacter spp. Fueron generalmente susceptibles o intermedio-susceptibles a Piperacilina/Tazobactam19.
Cepas de Morganella morganii son altamente susceptibles, así como cepas de Providencia stuartii, P. rettgeri y otras bacterias Gram negativas de ambos tipos b-lactamasa y no b-lactamasa productoras, de H. influenzae y Moraxella catarrhalis20.
Piperacilina/Tazobactam es activo contra cepas piperacilino-susceptibles de P. aeruginosa. Otras cepas de Pseudomonas incluyendo P. acidovorans, P. stutzeri y P. fluorescens, fueron generalmente susceptibles a Piperacilina/Tazobactam. Generalmente tiene buena actividad contra Acinetobacter spp21.
Piperacilina/Tazobactam es altamente activo contra Bacteroides fragilis (incluyendo cepas resistentes a cefoxitin y clindamicina), un patógeno muy comúnmente asociado a IIA. Otros miembros de la familia del B. fragilis, son también susceptibles a Piperacilina/Tazobactam22.
Otros anaerobios tales como Clostridium spp, Fusubacterium spp, Peptostreptococcus spp y Peptococcus spp son clínicamente importantes y se aíslan con frecuencia de pacientes con IIA. Piperacilina/Tazobactam ha demostrado consistentemente excelente actividad contra C. perfringes, y C. difficile23.
Piperacilina/Tazobactam Estudios in Vivo
Piperacilina/Tazobactam ha demostrado buena eficacia en modelos murinos de IIA o neumonía causados por un espectro extendido de cepas de K. pneumoniae productoras de b-lactamasas24.
Material y Métodos
Siete centros fueron invitados a participar en el estudio, seis lo hicieron: el Hospital Universitario del Valle (Cali), el Hospital Militar Central, La Clínica San Pedro Claver, La Fundación Santa Fe de Bogotá, El Hospital San Ignacio (todos en Bogotá) y el Hospital Ramón González Valencia (Bucaramanga). 40 pacientes con IIA fueron tratados con Piperacilina/Tazobactam 4 g/500 mg. Cada 8 horas. El diagnóstico más común fue peritonitis por causa de apendicitis gangrenosa perforada. Gráfica 1.

La duración del tratamiento con Piperacilina/Tazobactam varió entre seis a 14 días.
Características Demográficas de la Población
La población sujeto del estudio fue mayor de 12 años y de cualquier sexo.
Pacientes elegibles
1. Criterios de inclusión
a. Infecciones complicadas
El cuadro clínico debía ser compatible con IIA y los hallazgos al tiempo de la cirugía o del procedimiento radiológico intervencionista deberían confirmar la presencia de IIA. Los hallazgos intraoperatorios determinarían si un paciente podría permanecer o no elegible para participar en el estudio. Los elementos de juicio indispensables fueron la presencia de exudados purulentos y de tejido inflamado o necrótico. La evidencia confirmatoria podría obtenerse por imágenes que incluían TAC, RMN o US. Los pacientes con apendicitis deberían tener evidencia de perforación o absceso. Los pacientes con IIA que requerían mallas para el cierre de la pared abdominal fueron incluidos en el estudio.
1. Criterios de exclusión
Los pacientes no entraron a este estudio si tenían: (a) más de una indicación quirúrgica (b) si el APACHE II era mayor de 35 o (c) si se manejaban con abdomen abierto con posibilidad de introducir contaminantes patógenos exógenos a la herida.
Diseño y estratificación del estudio
El estudio fue abierto, multicéntrico y observacional. Los pacientes fueron estratificados antes de entrar en él utilizando el sistema APACHE II, las condiciones subyacentes, el tiempo de la cirugía y el tipo de infección. 40 pacientes fueron incluidos.
Definición de respuesta a la terapia
Para IIA complicada, sujeto de este estudio, los pacientes fueron evaluables así:
1. Se documentó un foco intraabdominal o una infección establecida por medio de una operación o intervencionismo radiológico para drenaje.
2. Los cultivos del sitio de la infección revelaron bacterias patógenas.
3. No hubo necesidad de administrar otros antibióticos diferentes a lo que establece el protocolo.
Para efectos del análisis, todo paciente que recibió la medicación se consideró potencialmente evaluable. El análisis subsiguiente excluyó a aquellos pacientes que no sobrevivieron por más de 48 horas, pues en ellos la eficacia de la medicación no era evaluable.
a. Clínica
Los pacientes se consideraron clínicamente curados si el tratamiento inicial y la cirugía inicial o el procedimiento inicial resolvieron la IIA y no ocurrió infección de la herida en forma tardía. La necesidad de más de un procedimiento quirúrgico (excepto lavados de laparostomía) para curar la infección se consideró falla en el tratamiento.
Si evaluadores independientes consideraban la IIA y el procedimiento inicial como no adecuado, el paciente fue considerado como no evaluable. El punto final de los pacientes que no respondieran al tratamiento luego de intervencionismo radiológico y que requerían cirugía, fue la cirugía.
La cirugía se consideró no adecuada si todas las comunicaciones entre el tracto gastrointestinal y la cavidad abdominal no se podían cerrar o si se dejaba necrosis intestinal.
b. Microbiológico
Los microorganismos etiológicos se definieron como aquellos que fueron aislados del sitio de la infección al momento de la intervención y/o de los hemocultivos. La ausencia de cultivos positivos hacía al paciente no evaluable. Los hallazgos bacteriológicos al tiempo de cualquier reintervención por IIA recurrente o persistente o de infección de la herida definieron al microorganismo responsable de la falla en el tratamiento.
Las muestras para cultivo fueron tomadas en forma estándar y colocadas en medio de cultivo para transporte provisto por el estudio y remitidas a la Fundación Santa Fe de Bogotá dentro de las siguientes 24-48 horas a su recolección. Los hemocultivos fueron procesados en cada institución con los estándares habituales.
Resultados microbiológicos y clínicos
Se recolectaron 71 aislamientos microbiológicos. La Tabla 1. muestra la incidencia del 50% de los aislamientos recolectados.

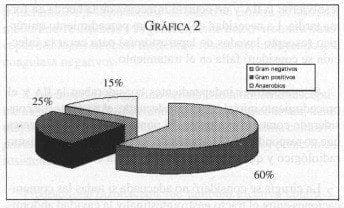
La gráfica 2 nos muestra la proporción de gérmenes aislados en la IIA en 71 aislamientos. Todos los casos de infección fueron polimicrobianos.
La Tabla 2 muestra los tipos de resistencia encontrados.

3 cepas resistentes en 71 aislamientos = 93% de sensibilidad de los gérmenes asilados en la infección intraabdominal a la Piperacilina/Tazobactam
La efectividad de la Piperacilina/Tazobactam fue de 91% en el tratamiento de la IIA. Sólo tres pacientes no respondieron al tratamiento y tres fallecieron en la serie por condiciones asociadas muy precarias y un largo tiempo de evolución antes de que el diagnóstico fuera establecido. En 50% de los casos el tiempo de evolución entre los síntomas, el diagnóstico y el tratamiento fue mayor de 72 horas, lo cual muestra una calidad muy pobre desde el punto de vista de oportunidad. Seis pacientes tuvieron infección nosocomial asociada: tres bacteremias por catéter y tres neumonías.
Discusión
El costo directo del tratamiento con Piperacilina/Tazobactam en la IIA es más bajo que el de la terapia comparable en estudios realizados en los EE.UU. El costo total (hospitalización) del tratamiento de los pacientes con IIA conduce a un ahorro cuando se utiliza Piperacilina/Tazobactam de cerca de US$284 por paciente comparado con clindamicina+aminoglucósido26. Existen múltiples estudios que muestran menor costo de Piperacilina/Tazobactam en comparación con otros regímenes como ceftazidime, imipenem/cilastatina, etc.
Un modelo de decisión basado en dos estudios clínicos mostraron que Piperacilina/Tazobactam era más costo-efectivo en tratamiento que ceftazidime + aminoglucósido en pacientes neutropénicos. Datos de un estudio realizado en Alemania comparando Piperacilina/Tazobactam + amikacina con ceftazidime + amikacina en el tratamiento de pacientes con episodios febriles y neutropénicos, produjo los fundamentos para otro estudio de costo-efectividad. Las evaluaciones de farmacoeconomía revelan entonces que el costo de Piperacilina/Tazobactam + amikacina por cada paciente exitosamente tratado fue menor que cuando se utilizó ceftazidime + amikacina (DM16.616 vs. DM 20.820)27.
Para nuestro medio estas consideraciones, así como la poca utilización que se ha hecho de la Piperacilina/Tazobactam, asociada a un índice de efectividad de 93% de con tan sólo tres pacientes sin respuesta al tratamiento en la serie que se relacionan con las cepas aisladas resistentes, comprueban la efectividad de este producto en el tratamiento de la infección intraabdominal en nuestro medio. Esto hace muy recomendable esta combinación en el tratamiento de esta patología.
Además, Piperacilina/Tazobactam tiene buena acción anaerobicida haciendo posible evitar las combinaciones antibióticas que incluyen metronidazol. Este producto tiene una efectividad en el tratamiento de la infección intraabdominal similar a la de la utilización de carbapenems y la de los regímenes usuales (Clindamicina/Aminoglucósidos o Cefalosporinas/Metronidazol).
Sabemos también que las Pseudomonas desarrollan rápidamente resistencia28 a los carbapenems, en particular al imipenem, y que otras enterobacterias desarrollan también resistencia a las cefalosporinas por producción de b-lactamasas de espectro extendido, en particular Klebsiellas.
El soporte de cuidado intensivo y la cirugía, continúan siendo dos de los tres pilares importantes en el manejo de esta patología, pero la selección del antibiótico es la tercera columna del tratamiento, y muy seguramente el contar con Piperacilina/Tazobactam, mejorará aún más la mortalidad de esta entidad.
La combinación de un b-lactámico/inhibidor de b-lactamasas como la combinación Piperacilina/Tazobactam, es entonces, un agente antimicrobiano muy eficaz y seguro para ser usado como monoterapia en la infección intraabdominal29.
Referencias
1. Brismar B, Malmborg AS, Tunevall G, Wretlinds B, et al. Piperacillin-Tazobactam versus Imipenen-Cilastatin for treatment of intra-abdominal infections. Antimicrob. Agents Chemother 1992; 36: 12, 2766-73.
2. Solomkin JS, Fant WK, Rivera JO and Alexander JW. Randomised trial of Imipenem/cilastatin versus gentamicin and clindamycin in mixed flora infections. Am J. Med 1985; 78: 85-91.
3. Aronoff SC, Jacobs MR, Johenning S and Yamabe S. Comparative activities of the ß-lactamases inhibitors YTR 830, sodium clavulanate and sulbactam combined with amoxacillin or ampicillin. Antimicrob. Agents Chemother 1984; 26:580-2.
4. Fortner CL, Finley RS, Schimpff SC. Piperacillin sodium: Antibacterial spectrum, pharmacokinetics, clinical efficacy, and adverse reactions. Pharmacotherapy 1982; 2: 287-99.
5. Jacobs MR, Aronoff SC, Johenning S, Shlaes DM, Yamabe S. Comparative activities of the ß-lactamase inhibitors YTR 830, clavulanate, and sulbactam combined with ampicillin and broad spectrum penicillins against defined ß-lactamase-producing aerobic Gram-negative bacilli. Antimicrob. Agents Chemother 1986; 9: 980-5.
6. Nieto JA. Sepsis Abdominal. In Quintero GA, Nieto JA, Lerma CH. Infección en Cirugía. Ed. Médica Panamericana, Buenos Aires, 2001.
7. Bone RC, Fisher CJ Jr, Clemmer TP, Slotman GJ, Metz CA, Balk RA. Sepsis syndrome: a valid clinical entity. Methylprednisolone Severe Sepsis Study Group. Crit Care Med 1989; 17: 389-93.
8. Pilcher WD, Musher DM. Critical importance of early diagnosis and treatment of intraabdominal infection. Arch Surg 1982; 117: 328-33.
9. Lorber B, Swenson RM. The bacteriology of intraabdominal infections. Surg Clin North Am 1975; 55: 1349-54.
10. Boey J, Wong J, Ong G. Bacteria and sepsis complication in patients with perforated duodenal ulcer. Am J Surg 1982; 143:635-9.
11. Muller EL, Pitt HA, Thompsom JE Jr, Doty JE, Mann LL, Manchester B. Antibiotics in infections of the biliary tract. Surg Gynecol Obstet 1987; 165: 285-92.
12. Coleman K, Griffin DRJ, Page JWJ, et al. In vitro evaluation of BRL 42715, a novel ß-lactamase inhibitor. Antimicrob Agents Chemother 1989; 33: 1580-7.
13. Gould IM, Milne K. In-vitro pharmacodinamic studies of piperacillin/tazobactam with gentamicin and ciprofloxacin. J Antimicrob Chemother 1997; 39: 53-61.
14. Stobberingh EE, Maclaren DM, Schmitz PIM. Comparative In vitro activity of piperacillin/tazobactam against recent clinical isolates, a Dutch national multicentric study. J Antimicrob Chemother 1994; 34: 773-83.
15. Sanders JR Jr, Sanders CC. Piperacillin/Tazobactam: a critical review of the involving clinical literature. Clin Infect Dis 1996; 22: 107-23.
16. Baron EJ, Jones RN. National survey of the in vitro spectrum of piperacillin-tazobactam tested against more that 40,000 aerobic clinical isolates from 236 medical centres. Diagn Microbiol Infect Dis 1995; 21: 145-51.
17. Pankuch GA, Visalli MA, Jacobs MR, et al. Activities of oral and parenteral agents against penicillin-susceptible and resistant pneumococci. Antimicrob Agent Chemother 1995 Jul; 39: 1499-504.
18. Stefani S, Bonfiglio G, Bianchi C, et al. Susceptibility survey of piperacillin/tazobactam and some ß-lactam compators in Italy. Drugs Exp Clin Res 1998; XXIV (2): 105-13.
19. Gobernado M, Bouza E, Perea E, et al. National multicenter study of the in vitro activity of piperacillin/tazobactam. Rev Esp Quimioter 1998; 11(2): 139-46.
20. Fung-Tome J, Bush K, Minassian B, et al. Antibacterial activity of BMS-180680, a new cathecol-containing monobactam. Antimicrob Agents Chemother 1997; 41: 1010-6.
21. Forward KR, Franks PA, Low DE, et al. Cross-Canada survey of resistance of 2747 aerobic blood culture isolates to piperacillin/tazobactam and others antibiotics. Can J Infect Dis 1998; 9: 33-44.
22. Pierard D, DeMeyer A, Rosseel P, et al. In vitro activity of amoxycillin/clavulanate and ticarcillin/clavulanate compared with that of other antibiotics against anaerobic bacteria: comparison with the results of 1987 survey. Acta Clin Belg 1996; 51: 70-9.
23. Namavar F, Severein WPJ, Stobberingh E, et al. The sensitivity of clinical isolates of anaerobic species to piperacillin/tazobactam and other antimicrobial agents. J Antimicrob Chemother 1994; 34: 415-9.
Correspondencia: Dr. Gustavo A. Quintero H.
Departamento de Cirugía • Fundación Santa Fe de Bogotá
E-mail: gquinter@cable.net.co
Sociedad Colombiana de Cirugía.
