R. MESA-CASTILLO, MD; V.P. CASTAÑO, MD.; R. ALBIS, MD. SCC.
Palabras clave: Ascitis quilosa, Quiloperitoneo, Cisterna de Pecquet, Conductos linfáticos.
Introducción
La ascitis quilosa (AQ) es un signo y no una enfermedad; constituye una infrecuente entidad clínica secundaria a la interrupción o extravasación del quilo de los linfáticos abdominales, con una incidencia reportada de 1 caso por 11.584 (1) Y 1 por 187.000 admisiones (2); se presenta asociada a neoplasias y a procedimientos quirúrgicos sobre la base del mesenterio o retroperitoneo, y constituye una inesperada complicación, reto al manejo terapéutico del grupo tratante y, ante todo, al espíritu intervencionista del cirujano.
Anatomía
La linfa es una sustancia líquida, acuosa, clara y transparente o amarilla clara, ligeramente opalescente recogida de los espacios intersticiales del organismo (excepto sistema nervioso y corazón) por el sistema linfático y que contiene los mismos elementos del plasma sanguíneo; la proveniente del tracto gastrointestinal contiene gran cantidad de grasas, ácidos grasos, glicerol, aminoácidos, glucosa, etc. extraídos de la ingesta del paciente que le dan un aspecto cremoso, el quilo, del griego chylos, jugo.
El quilo captado por los vasos quilíferos o lácteos durante la digestión, es drenado a la cisterna del quilo 6 de Pecqet, una dilatación sacular de los conductos linfáticos ubicada en posición antera-derecha de L I-L2, en estrecho contacto con el pedículo renal, a la cual drenan los canales linfáticos intestinales, paravertebrales lumbares y los de las extremidades inferiores que corren adyacentes a la aorta abdominal, constituyendo la principal estación colectora; la confluencia de éstos, forma el conducto torácico el cual drena al sistema venoso en la unión de las venas yugular interna y subclavia izquierda. Se considera que entre 50 y 90% de la linfa que transporta el conducto linfático deriva del hígado y los intestinos (3); así, el conducto torácico transporta linfa de todo el organismo, excepto del lado derecho de la cabeza y el cuello, miembro superior derecho y mitad superior derecha de la cavidad torácica, drenados por el conducto linfático derecho el cual desemboca en la intersección de las venas yugular interna y subclavia ipsilaterales.
Fisiología
La fisiología del sistema linfático abdominal se resume así:
Los quilomicrones de la dieta son absorbidos en el intestino y pasan en forma lenta y progresiva a través de los linfáticos mesentéricos a la cisterna de Pecquet, donde se suman al resto de linfa que a través del conducto torácico y con un flujo promedio de 1 mL/kg/h, atraviesa el mediastino posterior para retornar en forma de nutrientes al sistema circulatorio. Este flujo puede llegar a elevarse hasta 200 mL/kg/h después de una ingesta rica en grasas (4). Igual vía siguen los triglicéridos de cadena larga; los de cadena media se van directamente al sistema venoso portal, evitando los linfáticos intestinales y la cisterna de Pecquet. Así, las dietas ricas en triglicéridos de cadena media presentan una producción de quilo inferior a la generada por las dietas ricas en triglicéridos de cadena larga, lo que es fundamental como principio terapéutico en esta entidad (5).
Caso Clínico
Mujer de 32 años con sensación de masa en el hemiabdomen derecho, quien acude a un médico extrainstitucional para control de embarazo; se le ordenó ultrasonografía abdominal que reporta masa sólido-quística en el lóbulo derecho del hígado con características de malignidad; a pesar de lo anterior la paciente rechaza cualquier tratamiento antitumoral antes del parto.
Al ingreso, durante el puerperio inmediato, la paciente refiere sensación de masa de 2 años de evolución en el hemiabdomen derecho; presenta buen estado general, mucosas rosadas, abdomen flácido, ligeramente asimétrico por una masa fija de aproximadamente 15 cm de diámetro, lisa, de contornos regulares, no dolorosa que da la impresión clínica de tumor retroperitoneal. Los estudios diagnósticos reportaron:
Ultras ano grafía abdominal: “Masa heterogénea de contornos irregulares; existe plano de clivaje con el hígado, el cual, junto con la vesícula biliar y el riñón derecho, están rechazados por una masa de 15 x 10 x 10 cm, de ecogenicidad similar a la grasa. Hacia la parte posterior del segmento 7 hepático, dos lesiones de aspecto quístico independientes del hígado. Impresión diagnóstica: “Masa retroperitoneal.”
TAC abdominal: “Ocupando el espacio subhepático derecho y extendiéndose hacia el mesenterio se observa gran masa sólida, de contornos irregulares y contenido graso, con diámetro aproximado de 19 x 20 x 12 cm. Esta masa rechaza el colon y las asas intestinales a la izquierda y no permite dar definición al mesenterio. Compatible con liposarcoma.”
Colon por enema. Normal.
Endoscopia superior. Normal.
BACAF. Inadecuado para diagnóstico.
Con la impresión clínica de tumor retroperitoneal (1iposarcoma), es intervenida quirúrgicamente el 20 de mayo de 1997. Se encontró lo siguiente:
1. Escaso líquido ascítico.
2. Tumor hipervascularizado de 20 cm de diámetro, bien encapsulado, que involucraba el riñón derecho, adherido por adherencias laxas a la vena cava inferior.
3. Segundo tumor retroperitoneal de aproximadamente 15 cm de diámetro localizado detrás de la base del mesenterio.
Se realizó citología del líquido ascítico que informó PAP 11, células mesoteliales ++; bloque celular: material fibrinohemorrágico con células mesoteliales hiperplásicas. Infiltrado inflamatorio linfohistiocitario y escasos polimorfonucleares, negativa para tumor; biopsia por congelación de una adenopatía de la curvatura mayor del estómago que informa: ganglio negativo para malignidad, además, biopsia por trucut de la masa retroperitoneal descrita, con el siguiente resultado: “el cuadro morfológico es sugestivo de lesión mesenquimal, posiblemente liposarcoma; para diagnóstico debe esperarse parafina.”
Se realizó resección local amplia del tumor retroperitoneal que incluyó nefrectornía derecha (Figura 1). Informe de patología: angiomiolipoma renal multifocal.
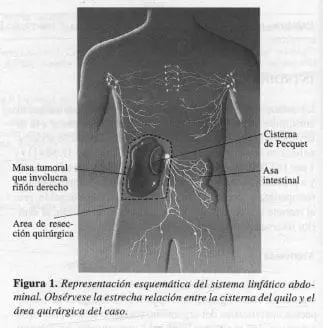
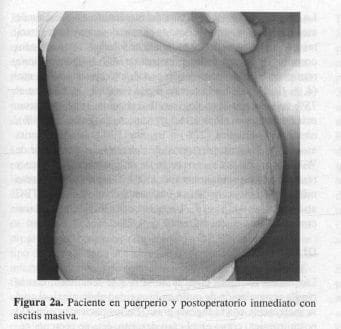
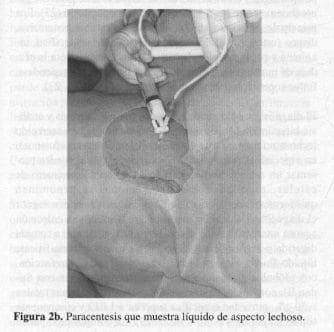
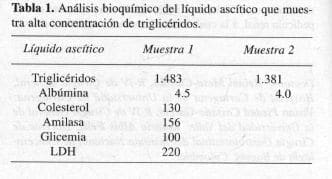
La paciente evoluciona en forma satisfactoria y se le da de alta. Reingresa 20 días después por un cuadro clínico de distensión abdominal (Figura 2a) y ortopnea progresiva; se tuvo la impresión clínica de ascitis postoperatoria en estudio, y se realizó la primera de dos paracentesis que permitió el diagnóstico de ascitis quilosa (Figura 2b), y el estudio del líquido ascítico, con alto contenido de triglicéridos (Tabla 1).
 |
 |
Ante este diagnóstico poco usual se realizó linfangiografía, cuya imagen sólo revela una extravasación irregular del radiofármaco en el área operatoria, lo que no aportó información adicional. En junta médica se decidió realizar tratamiento médico basado en manipulación nutricional con triglicéridos de cadena media vía enteral (“si el tracto digestivo funciona, úselo”), obteniéndose después de 17 días, mejoría clínicamente
significativa de la ascitis, dándose de alta con soporte nutricional ambulatorio. Por dificultades económicas, la paciente no cumplió las recomendaciones dietéticas y reingresó a la institución 1 mes más tarde por reaparición de la ascitis, lo que obligó a replantear el enfoque terapéutico. Se decidió la reintervención quirúrgica con el objetivo de ligar el conducto linfático lesionado, el cual, por el área quirúrgica inicial
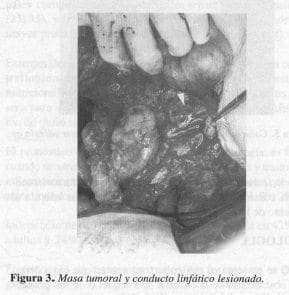
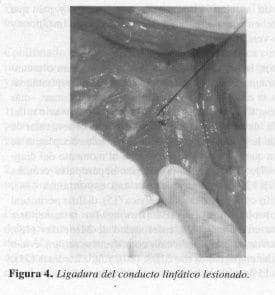
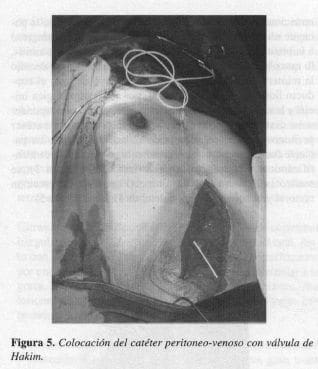
y la magnitud de la ascitis resultante, podría corresponder a la cisterna de Pecquet; y además, colocar catéter peritoneoyugular con válvula de Hakim de 10 mm. La paciente fue intervenida quirúrgicamente por segunda vez identificándose el conducto linfático lesionado (Figura 3); se realizó la ligadura de este último (Figura 4), la resección tumoral y la colocación del catéter de Hakim (Figura 5).
 |
 |
Hasta la fecha, la paciente ha evolucionado satisfactoriamente, con control dietético, debiendo comprimir la válvula al momento de la ingesta.
Etiología
La AQ se presenta en cualquier trastorno en que haya derrame u obstrucción de la cisterna de Pecquet o de los grandes vasos linfáticos del abdomen (6); es infrecuente que aparezca después de la oclusión de un gran vaso linfático y para que suceda deben estar comprometidos los colaterales linfáticos y linfático-venosos regionales (7).
En adultos, la AQ se presenta en forma espontánea o secundaria al trauma quirúrgico (1,8); entre las causas espontáneas descritas se encuentran: neoplasias malignas (linfomas –más frecuente-, Ca. del páncreas, del estómago, del ovario o del colon; Ca. de células renales, de próstata; tumor testicular de células de la granulosa, etc.) (1, 9-12) de tales neoplasias se considera que hasta el 60% son ocultas al momento del diagnóstico (7); hipertensión portal por hepatopatía crónica (cirrosis)(l3), peritonitis bacteriana espontánea (14), pancreatitis crónica, irradiación pélvica (15), diálisis peritoneal (16), poscolocación de TIPS (tranjugular intrahepatic portosistemie shunt) (17), enfermedad de Menetrier (18), miopatía visceral (19), infección con Myeobaeterium avium intracelular en pacientes con SIDA (20), Yfalla cardíaca (21); hasta un 15% se considera de causa idiopática (7).
La cirugía abdominal en la base del mesenterio, la resección de aneurismas de la aorta y, como en el caso descrito y la de tumores que incluyan disecciones linfáticas sobre el retroperitoneo, constituyen la otra causa principal de AQ: linfadenectornía retroperitoneal, descompresión portal, trauma abdominal, etc. (4, 8, 10, 22-24). En lactantes, según Howard (7), hasta en el 75% de los casos la etiología es desconocida; entre las causas más frecuentes en niños se incluyen anomalías linfáticas (54%), obstrucción linfática (27%) y trauma (19%), siendo descrita asociada a los postoperatorios: de nefrectornías por tumor de Wilms; orquiectmnía, corrección de reflujo gastroesofágico y resección de neuroblastoma abdominal. Tanto en adultos como niños puede ser secundaria a procesos infecciosos como TBC abdominal o filariasis (4). La AQ puede también presentarse concomitante con quilotórax (2, 5, 9, 21, 23).
Diagnóstico
Las manifestaciones clínicas de la AQ se relacionan con la rápida acumulación de quilo en la cavidad abdominal, el cual se incrementa con la ingesta grasa. En los pacientes con AQ posquirúrgica, como en el caso descrito, ésta se presenta generalmente entre los 5 y 21 días del postoperatorio (23). Los principales síntomas son, distensión abdominal progresiva, disnea (ortopnea), dolor abdominal vago e inespecífico, inanición y pérdida rápida de peso (la cual se agrava por la pérdida de nutrientes exacerbada por las paracentesis repetidas); linfocitopenia, hipoalbuminemia y anemia (1,2,4,23).
El diagnóstico sólo puede realizarse por paracentesis y análisis bioquímico (4). El solo reconocimiento de una secreción lechosa no permite este diagnóstico ya que ciertas efusiones, en especial las relacionadas con carcinomatosis, pueden presentar un aspecto similar debido a un elevado número de células exfoliadas; estas secreciones se denominan quiliforrnes. La ecografía y la TAC abdominal pueden sugerir el diagnóstico al revelar una capa grasa sobre una colección acuosa intraperitoneal. La verdadera AQ puede oler a comida digerida o ser inodora y tiene las siguientes características: líquido fluido, alcalino, estéril, resistente a la putrefacción, con glóbulos grasos evaluables microscópica mente con Sudan III; contenido graso entre 0.4 y 40 giL, proteínas totales > 30 gIL, gravedad específica superior a 1.012 y componente sólido mayor de 4% (1, 4, 6, 25, 27). La composición puede presentar variaciones secuenciales en un mismo paciente, dependiendo de la evolución de la enfermedad y del manejo nutricional (5, 25).
Tratamiento
Esta patología y su tratamiento, representan un interesante problema clínico. En este artículo se hará énfasis en el manejo de la AQ posquirúrgica.
El tratamiento puede ser quirúrgico y, a través de la historia médica, ha consistido en paracentesis a repetición, reinfusión i.v. de quilo, shunt peritoneo-venoso de LeeVen, uso de fibrina sintética y ligadura del linfático afectado; o médico, basado en la manipulación nutricional, el cual ha comprendido: restricción de sal y uso de diuréticos, dieta baja en grasa, hiperalimentación oral o parenteral, dieta rica en triglicéridos de cadena media y análogos de la somatostatina (l, 2, 4, 5, 22, 24-27).
La decisión de reintervenir quirúrgicamente en forma temprana a un paciente con AQ tiene como objetivo ligar el linfático afectado y se basa en el conocimiento anatómico del área involucrada en la disección previa, sitio en el cual debe estar localizado el linfático lesionado, y cuya ligadura, en caso de ser identificado, podría resolver el problema evitando el progreso de trastornos nutricionales (4). Sin embargo, este tipo de cirugía tiene una alta tasa de malos resultados (1). La intervención precoz se complica por un campo quirúrgico inflamado, fibrinoide que dificulta la disección; y la tardía tiene como agravantes un peor estado nutricional y un campo quirúrgico fibroadherencial, en especial si la primera cirugía requirió disección retroperitoneal extensa (l). Carones (26) ha propuesto la aplicación directa de fibrina sintética sobre el linfático lesionado, como una forma rápida y permanente de solucionar el problema. La localización del sitio de escape en forma preoperatoria se ha intentado con Iinfangiografía convencional con medio de contraste de base lipídica, la que puede agravar la AQ por obstrucción linfática (5, 28), administración preoperatoria por vía oral de Sudan lIJ, infiltración linfática preoperatoria de los pies con Isosulfan azul (Limphazurin 1%) o en forma intraoperatoria con infiltración del mesenterio intestinal con negro Sudan (24, 29-31). Una Iinfangiografía negativa no contraindica el intento de reparación quirúrgica (32).
Si la reintervención quirúrgica no da resultados satisfactorios o si el paciente por cualquier motivo no puede ser llevado a cirugía, la manipulación nutricional enteral a través de dietas bajas en grasas y ricas en triglicéridos de cadena media, (que como se comentó al inicio, pasan del intestino al sistema venoso portal evitando los linfáticos abdominales) se hace obligatoria (1,4,5,22,23); como alternativa contraria al concepto anterior, están quienes, al igual que los autores, consideran que la manipulación nutricional debe ser el enfoque terapéutico de primera línea en la AQ postoperatoria (32). Si el paciente continúa deteriorándose, es refractario a la dieta o requiere paracentesis terapéuticas, debe suspenderse la vía enteral, dejar el intestino en reposo e iniciar nutrición parenteral (1, 4, 5, 22, 23), la que se ha asociado al uso de análogos de la somatostatina -Octreótida- 100 microgramos, 3 veces al día (27). El cierre del linfático afectado puede requerir varios meses y el mantenimiento del soporte nutricional es la clave para que ocurra la curación (22).
El cortocircuito peritoneo venoso sólo se indica cuando fallan las anteriores medidas, es decir, en pacientes que no soportan una cirugía, que no toleran o son refractarios a la manipu~ación nutricional enteral o parenteral o cuando por la patología de base requieren múltiples paracentesis (1, 22, 24, 32) y cuando no se garantice el tratamiento nutricional enteral o parenteral necesario. Está indicado en linfangiomatosis o desórdenes crónicos que no responden a otros tratamientos. En el caso descrito se decidió combinar la ligadura del conducto linfáfico con la derivación peritoneo-yugular, por el alto índice de fracasos con la sola ligadura y por dificultades para un adecuado control nutricional, tal como se había comentado. Puede ser realizada con anestesia local (33) y sus principales complicaciones son, oclusión, sepsis y embolia gaseosa (23, 33), y si la AQ es secundaria a aneurismectomía aórtica, mayor predisposición a la infección de los injertos (24). Vea también: El Índice Antinflamatorio Dietético
Estamos de acuerdo en que las paracentesis a repetición como tratamiento deben evitarse ya que agravan el estado nutricional; su uso debe limitarse al paciente con ascitis masiva para disminuir la dificultad respiratoria. La reinfusión i.v. de quilo hace parte de la historia (34).
El pronóstico depende principalmente de la etiología; es malo cuando se asocia a neoplasias, anomalías congénitas y trastornos inflamatorios crónicos; en contraste al buen pronóstico que presenta cuando es de etiología postoperatoria (3, 4, 21, 23, 25).
Independiente de la causa, la mortalidad se calcula en 43% en adultos y 24% en niños (24).
El protocolo de manejo propuesto por los autores es el Siguiente:
Paciente con aSCItis: paracentesis diagnóstica y análisis bioquímico del líquido peritoneal.
Confirmado el diagnóstico, el paciente se clasifica con criterio curativo, según el estado nutricional, el riesgo quirúrgico y el pronóstico de la patología de base:
1. Buen estado nutricional, patología de buen pronóstico y poco riesgo quirúrgico: nutrición enteral elemental, baja en grasas y rica en triglicéridos de cadena media (TCM).
2. Mal estado nutricional, patología de buen pronóstico y poco riesgo quirúrgico: nutrición parenteral total o mixta.
En ambos grupos es fundamental evitar el deterioro nutricional del paciente; si no hay respuesta satisfactoria en la magnitud de la AQ el paciente debe ser llevado a cirugía con las consideraciones antes anotadas, con o sin Iinfangiografía previa, con el objetivo de cerrar la fístula; el uso de fibrina sintética y análogos de la somatostatina como coadyuvantes, constituyen una alternativa interesante. El soporte nutricional debe continuar en el postoperatorio.
3. Pacientes de los grupos 1 y 2 refractarios a la manipulación nutricional y/o que no mejoraron con la intervención quirúrgica: cortocircuito peritoneo-venoso.
4. Mal estado nutricional, patología de mal pronóstico y alto riesgo quirúrgico: cortocircuito peritoneo-venoso acompañado de soporte nutricional paliativo. Asimilamos a este grupo a aquellos pacientes que por causas institucionales no puedan recibir la terapéutica nutricional adecuada.
Hasta la fecha no se ha definido el momento en el cual se debe considerar que no hay respuesta a la manipulación nutricional o que está no es satisfactoria, como pauta para definir cambios en el plan terapéutico de cada paciente; por lo tanto, corresponde al grupo tratante la toma de esta decisión, basándose en la morbimortalidad, los parámetros nutricionales, el pronóstico de la enfermedad de base, la disponibilidad de recursos de la respectiva institución y la relación costo!beneficio, así como un gran sentido clínico.
Agradecimientos
Nuestros sinceros agradecimientos al servicio de Gastroenterología del Instituto Nacional de Cancerología de Colombia por sus interesantes comentarios en la revisión de este artículo y al doctor David Scott Jervis Jalabe por su valioso aporte en la búsqueda y recolección bibliográfica.
Referencias
1. Press OW, Press NO, Kaufman SD: Evaluation and management of chylous ascites. Ann Intern Med 1982; 96:358-64
2. Nix JT, Albert M, Dugas JE, Wenodt DL: Chylothorax and chylous ascites: a study of 302 selected cases. Am J Gastrenterol 1957; 28:40-55
3. Lesser GT, Bruno MS, Enselberg K: Chylous ascites. Arch Intern Med 1970; 125: 1074
4. Meinke AH, Estes NC, Ernst CB. Chylous ascites following abdominal aortic aneurysm repair. Ann Surg 1979; 190: 631-3
5. Hashim SA, Roholt HB, Babayan VK, Van ltallie TB: Treatment of chyluria and chylothorax with medium chain triglycerides.N Engl J Med 1964;240:756-61
6. Blalock A, Robin CS, Cunningham RS, et al: Experimental studies on Iymphatic blockage. Arch Surg. 1937;34:1049-71
7. Howard PH, Knudsen KB, White RR: Ascites quilosa por linfadenitis tuberculosa retroperitoneal. En: “Formas inesperadas de enfermedad quirúrgica” Clín Quirúrg Norte Am. Phyladelphia. Interamericana. W.B. Saunders Comp. 1972 Abr. p. 493-6
8. Kelley ML Jr, Butt HR: Chylous ascites: An analysis of its etiology. Gastroenterology 1960; 39:161-70
9. Segal R, Warron M, ReifR, ZeclerE: Chylous aseites and chylothorax as presenting manifestations of stomach carcinoma. J Med Sci 1988;22:897-9
10. Allen W, Parrot TS, Saripkin L,Allan C: Chylous ascites following retroperitoneal Iymphadeneetomy for granulosa cell tumorof the testis. J Urol 1986; 135:797-8
11. Ferrigni RG, Novicki DE: Chylous ascites complicating genitourinary oncologic surgery. J UroI1985;134:774-6
12. Varma JS: Acute chylous ascites with carcinoid of the pancreas. Scott Med J 1985;30: 11I
13. Rector WG: Spontaneus chylous ascites of the cirrhosis. J Clin Gastroenterol 1984; 6:369-72
14. Leport J, Devars Du Maine JF, Hay JM, Cerf M: Chylous ascites and encapsulating peritonitis: unusual complications of spontaneus bacterial peritonitis. Am J Gastroenterol 1987 ;82:463-6
15. Sipes SL,Newton M, Lurain JR: Chylous ascites: a sequel of pelvic radiation therapy. Obstet Gynecol 1985;66:832-5
16. Humayan HM,Daugirdas JT, Ing TS, Leehey DJ, et al: Chylous ascites in a patient treated with intermitent peritoneal dialysis. Artif Organs 1984;8:358-60
17. Rovira E, Moles JR, Hinojosa J,Primo J, et al: Dysfunction 01′ a T1PS (transjugular intrahepatic portosistemic shunt) and chylous ascites. Rev Esp Enf Dig 1997 jun; 89(6):475-7
18. Soetikno RM. Tantibhedhyangkul W. Binion D, Rouse RV: Menetrier”s disease: report of a transient case associated with chylous ascites. Am J Gastroenterol. 1997 Aug: 92(8):1364-7
19. Jatzko G, Lisborg P, Siebert F,Denk H, Klimpfinger M: A firts report of familial visceral myopathaty with additional chylous ascites in two siblings. Scand J Gastroenterol 1997 Feb: 32(2) 187-90
20. Rollhauser C, Borum M: Case report: arare case of chylous ascites from Mycobacterium avium intracellulare in a patient with AIDS: review of the literature. Dig Dis Sci 1996 Dec; 41(12):2499-501
21. ViIlena V, de Pablo A, Martin-Escribano P. Chylothorax and ehylous ascites due to heart failure. Eur Resp J 1995 Jul; 8(7): 1235-6
22. Ablan CJ, Littooy FN, Freeark RJ: Postoperative chylous ascites: Diagnosis and treatment. A series report and literature review. Arch Surg 1990;125:270-3
23. Jayabose S, Kogan S, Berenzin S. et al: Combined concurrence of chyloperitoneum and chylothorax after surgery and chemotherapy for Wilms’ tumor. Cancer. 1989; 64: 1790-5
24. Sarazin WG. Sauter KE: Chylous ascitcs following resection of a ruptured abdominal aneurysm. Treatment with a peritoneovenous Shunt. Arch Surg 1986; 121 :246-7
25. Vasko JS. Tapper IR: Surgical significance of chylous ascites. Arch Surg 1967; 95:355
26. Carones S. Caporossi M. Di Paola S, Pagano G. et al: Postoperative chylous ascites: its etiology and treatment. G Chir 1996 Nov; 17(11-12):586-8
27. ShapiroAM, Bain VG, SigaletDL, Kneteman NM: Rapid resolution of chylous ascites after liver transplantation using somatostatin analog and total parenteral nutrition. Transplantation 1996 May 15; 61(9):1410-1
28. Weinstein LD, Scanlon GT, Hersh T: Chylous ascites, management with medium-chain triglycerides and exacerbation by limphangiography. Am J Dig Dis 1969; 14: 500
29. Pearl n, Collins DL: Chylous ascites: the first reported surgical cure by direct ligation.J Ped Surg 1977; 12:687-91
30. Malagelada JR, Iber FL, Linscheer WG. Origin on fat in chylous ascites in patients with liver cirrhosis. Gastroenterology 1974;67:878-86
31. Rubis PJ, Tisnado J, Kirsch JI, Capehard J: Intraoperative identification of chylous fistula using isosulphan blue dye. Am J Rad 1982;139:186-7
32. WiIliamson C, Provan JL: Chylous ascites following aortic surgery. Br J Surg 1987 Jan; 74:71-2
33. LeVeen HH, Christoudias G, Moon IP, Luft R, Falk G, Grosberg S: Peritoneo-Venous Shunting for ascites. Ann Surg 1974; 180:580-91
34. Little JM, Harrison (:, Blalock A: Chylothorax and chyloperitoneum: effect of reintroduction of aspirated chyle. Surgery 1942; 11:392-401.
Correspondencia:
Doctor Reinel Mesa Castillo. Hospital Universitario de Cartagena, piso 8 01 Anir, Tel. 6620251.
Cartagena de indias – Colombia.
Doctores, Reinel Mesa-Castillo, R-IV de Cirugía General, Hospital de Cartagena de la Universidad de Cartagena; Vivian Piedad Castaño-Garda, R-IV de Cirugía General de la Universidad del Valle; Rosario Albis Féliz, Docente de Cirugía Gastrointestinal del Instituto Nacional de Cancerología de Bogotá, Colombia.
