(Carcinoma Intraepitelial o Carcinoma In Silu)
J. F. P…tTIÑo, MD, FACS (Ron), SCC (Ron).
Los carcinomas no invasivos de la glándula mamaria, que hacen parte importante de los llamados “cánceres mínimos’:, según el planteamiento original de Gallager y Martin de 1971 (14), fueron definidos por primera vez por A. C. Brodérs en 1932 (7): “una condición en la cual las células malignas y su progenie se encuentran en ubicaciones ocupadas por sus antepasados, o cerca de ellas, antes de que tales antepasados hubieran desarrollado transformación maligna. Por lo menos no han migrado más allá de la unión del epitelio con el tejido conectivo, o sea, la membrana basal”.
En general, los carcinomas in situ son considerados como condiciones patológicas precancerosas. En el texto clásico de Anderson (2) se definen así: ” …..un área de epitelio que exhibe los cambios citológicos de malignidad, pero sin invasión del tejido conectivo subyacente. Tales cambios son: variaciones en el tamaño y forma de los núcleos, hipercromatismo, pérdida de polaridad y desorden de las células, fIguras mitóticas, y demás”. .
Por ello también son designados carcinomas intraepiteliales y carcinomas preinvasivos (2).
Los carcinomas intraepiteliales de la glándula mamaria son de dos tipos (32):
a) carcinoma lobulillar in situ;
b) carcinoma ductal in situ, o carcinoma intraductal.
Evolución y desarrollo del cáncer mamario invasivo
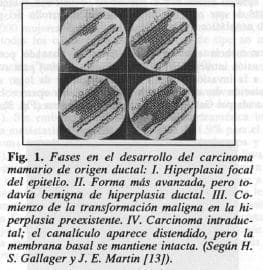
H. S. Gallager y J. E. Martin plantearon hace 20 años una hipótesis que ha merecido aceptación por muchos patólogos, sobre la historia natural del cáncer mamario y las fases de su desarrollo a partir del epitelio ductal o canalicular (13), la cual ha sido reafirmada por Gallager en un reciente ltrtículo claro y. conciso (15).
El cáncer del seno es una enfermedad del epitelio de la glándula mamaria, que es de origen ectodérmico. El epitelio glandular exhibe un crecimiento dinámico en respuesta a los estímulos y ambientes hormonales: se desarrolla rápidamente con la menarquia, fluctúa con los ciclos menstruales, exhibe hiperplasia durante el embarazo y la lactancia y sufre atrofia progresiva con la menopausia. “En tan activa población celular, las oportunidades de mutación genética que producen células capaces de proliferación neoplásica, deben ser abundantes” (15).
Según la hipótesis de Gallager y Martin (13, 15), la hiperplasia celular es una forma preneoplásica, pero no obligatoria de convertirse en carcinoma. Como se ilustra en las Figuras 1 y 2, tomadas de estos autores (13), la secuencia de alteraciones que dan lugar al carcinoma invasivo se inicia con un simple foco de hiperplasia en el epitelio ductal; la hiperplasia progresa y desarrolla alteraciones citológicas de malignidad: la fase de carcinoma in situ, la lesión que se mantiene intraductal sin penetración de la membrana basal, es un carcinoma intraepitelial. Las fases siguientes son la del carcinoma de invasión mínima que ya viola la membrana basal, y luego la del carcinoma invasivo plenamente desarrollado, ilustradas en la Figura 2 (13).
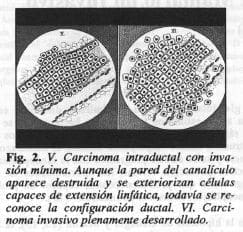
El carcinoma mamario se acompaña de alteraciones en todos los tejidos del seno, y algunas, particularmente:
Aquellas que ocurren en el tejido conectivo, pueden preceder al carcinoma mismo. Así se explica la colagenosis pericanalicular (o periductal) que se manifiesta por signos bien definidos en la mamografia (13).
Las diversas alteraciones no ocurren de manera uniforme en un seno: las anormalidades del epitelio pueden ser predominantes en un área, mientras las lubulillares y del tejido conectivo lo son en otra.
Tampoco es uniforme el grado de alteración del epitelio: se encuentran focos de carcinoma francamente invasivo intercalados en áreas donde el epitelio es carcinoma toso pero no invasivo (carcinoma intraepitelial o in situ), o hiperplásico o totalmente normal. Dentro de este panorama histológico, la asociación casi constante de la hiperplasia del epitelio ductal con el carcinoma, constituye evidencia fuerte de que está relacionada con el desarrollo del proceso neoplásico (13).
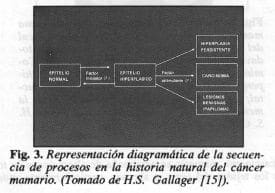
La secuencia entre el origen epitelial, pasando por la extensión intraepitelial (o de carcinoma in situ) para avanzar a la invasión mínima que al progresar da lugar a la formación de una masa tumoral, también aparece bien ilustrada por Gallager en el siguiente diagrama (Fig. 3).
Enfermedad fibroquística versus enfermedad proliferativa
Las enfermedades benignas del seno, mal agrupadas bajo la denominación genérica de “enfermedad fibroquística”, constituyen un grupo de entidades de elevada predominancia en la población femenina; el médico debe poseer una conciencia clara sobre sus implicaciones patológicas y clínicas a fin de poder enfrentarla en forma lógica y racional (1).
Con justicia se critica lo inadecuado de incluir bajo la popular denominación de “enfermedad fibroquística” a una amplia variedad de alteraciones histológicas benignas (26), especialmente en lo relativo a identificar un aumento de riesgo de desarrollar carcinoma. El término “enfermedad proliferativa” resulta más preciso, por cuanto es indicativo de alteraciones de tipo proliferativo en el epitelio, una característica histológica que está asociada con aumento del riesgo. Page y Dupont (26) han clasificado las lesiones benignas según su riesgo relativo, así:
Riesgo no aumentado (enfermedad no proliferativa)
Adenoma
Alteración apocrina
Ectasia leve
Hiperplasia ductalleve no atípica
Riesgo ligeramente aumentado (enfermedad proliferativa sin atipia)
Hiperplasia sin atipia, moderada o florida
Papiloma
Adenosis esclerosante
Riesgo moderadamente aumentado (4-5 x) hiperplasia atípica o lesiones limítrofes.
Hiperplasia ductal atípica
Hiperplasia lobulillar atípica
Alto riesgo (8-10 x) (carcinoma in silu)
Carcinoma lobulillar in situ y Carcinoma ductal in situ (no comedo)
Son las lesiones hiperplásicas atípicas las que se asocian con riesgo elevado, lo cual implica un programa cuidadoso de vigilancia clínica y mamográfica en pacientes con este tipo de alteración. Se especula si disminuir los ácidos grasos saturados de la dieta puede inhibir el riesgo de cáncer mamario, o si el antiestrógeno tamoxifén y las preparaciones que reducen los niveles de estrógeno pueden resultar útiles en la prevención del cáncer en mujeres de alto riesgo, una posibilidad atractiva que vale la pena probar en estudios prospectivos (26).
Las hiperplasias atípicas
La hipótesis de la alteración secuencial del epitelio normal para llegar al carcinoma invasivo, a partir de la hiperplasia y pasando por el carcinoma in situ, con grados variables y heterogéneos de afección epitelial, aparece lógica y atractiva.
Dentro de este esquema de evolución histológica las lesiones que anteceden al carcinoma in situ pueden exhibir muchas de las características celulares del cáncer intraepitelial, pero no la totalidad de su patrón histológico, y en tal caso se denominan hiperplasias atípicas. Estas pueden ser de tipo ductal o de tipo lobulillar.
La hiperplasia atípica representa una posición intermedia, limítrofe, entre la hiperplasia y el carcinoma in situ (25), con algunas, pero no todas, las características de este último. En la polémica que suscita el planteamiento, se ha llegado a decir que tal vez la manera más fácil de caracterizarlas es por su capacidad de producir diferencia de opinión entre los expertos (25).
Su importancia radica en el mayor riesgo de desarrollar carcinoma, del orden de 4 a 5 veces, que se observa en las mujeres con hiperplasia atípica, bien sea de tipo ductal o lobulillar, grado de riesgo que se dobla cuando la paciente tiene, además, historia familiar de cáncer mamario (25).
En un estudio del Memorial-Sloan Kettering (3) sobre 296 lesiones atípicas del seno, se encontraron 24 cánceres asociados, tres de ellos con metástasis axilares; los autores estiman que las mujeres con lesiones atípicas tienen un riesgo 18 veces mayor que el de la población general.
Con motivo de una investigación de la Universidad de Vanderbilt:
Recientemente publicada (9), Hutter escribió un excelente editorial en el cual da el adiós a la teminología genérica de la enfermedad fibroquística y plantea el real riesgo de cáncer sólo alrededor de las lesiones proliferativas de hiperplasia atípica (19). En las mujeres con carcinoma in situ, lobulillar o ductal, tal riesgo es aún más elevado: 11 veces en el estudio de la Universidad de Vanderbilt (25).
En resumen, se puede afirmar que la presencia de hiperplasia atípica coloca a la mujer en una condición de mayór riesgo de desarrollar cáncer invasivo (26), tal vez del orden de 4-5 veces sobre la población general, riesgo que se aumenta a unas 11 veces cuando coexiste historia familiar de cáncer mamario (25,9, 19).
La detección de este tipo de lesión, sin embargo, no justifica de por sí emprender tratamiento quirúrgico, sino un seguimiento cuidadoso (32).
Epidemiología y comportamiento del cáncer intraepitelial
En cuanto al carcinoma intraepitelial, se dispone de numerosos estudios que indican una incidencia significativa de cáncer invasivo asociado.
Según la hipótesis de Gallager (15), la lesión más precoz del cáncer mamario es el carcinoma in situ, en su variedad de carcinoma intraductal no invasivo y carcinoma lobulillar in situ. Tales neoplasias microscópicas son histológicamente difíciles de diferenciar en las hiperplasias atípicas.
Una vez que se produce la transformación neoplásica del epitelio ductal, el crecimiento de la lesión ocurre dentro del epitelio que le dio origen, sin que todavía haya invasión; esta es una característica común para todos los epitelios planos (cervix, vagina, mucosa oral) pero que también
se observa en los más complejos tejidos de la glándula mamaria, donde el carcinoma indraductal puede extenderse en el sentido proximal o en el distal y llegar a afectar los lobulillos. En forma similar, el carcinoma lobulillar in situ puede extenderse para afectar los canalículos (15).
La lesión del carcinoma intraductal puede ser de tipo continuo o interrumpido (o segmentario), dentro de uno o más ductos o canalículos. Gallager anota que tal fenómeno tiene dos implicaciones: la primera, que la extensión intraductal es el resultado de una transformación neoplásica progresiva de las células del epitelio, y la segunda que existen subpoblaciones de células incapaces de responder al estímulo carcinogénico (15).
Esta última implicación talvez explique el por qué algunos carcinomas intraductales, y muchos carcinomas lobulillares in situ, se presentan en forma multicéntrica y con frecuencia bilaterales.
Por muchos años se pensó que los carcinomas intraepiteliales que no son clínicamente detectables, eran de baja incidencia general:
0.84% en la investigación del Colegio Americano de Cirujanos para el carcinoma intraductal (31), Y se citan tasas de incidencia para los carcinomas intraepiteliales que oscilan entre el 1.4 y el 12.0% de todos los cánceres mamarios (32).
Pero con el advenimiento de la mamografía y su creciente empleo en estudios de tamizaje en pacientes individuales o en grupos de población (27, 28), esta incidencia ha demostrado ser bastante más elevada. El resultado es que se ha pasado de la detección clínica de una masa, al hallazgo radiográfico de áreas de tejido anormal, no de microcalcificaciones.
En el estudio de tamizaje masivo realizado en 27 diferentes proyectos bajo el patrocinio del National Cancer Institute y de la American Cancer Society, que cubrió a 10.000 mujeres de edades entre los 35 y los 74 años, 26% de todos los cánceres detectados fueron de tipo no invasivo, y de los invasivos 40% fueron de menos de 1 cm de diámetro (“carcinomas mínimos”) (32, 5, 30).
En los carcinomas intraepiteliales, o no invasivos, teóricamente la tasa de invasión ganglionar axilar debería ser O (33). Sin embargo, publicaciones de Norteamérica informan metástasis ganglionares con tasas de 1.9% para el carcinoma intraductal, como en el estudio de Lagios y col. (20), o de 6-9% (estimadas) según Gallager (15). Swain y Lippman, en el texto publicado en 1988 (32), afirman que “la tasa de ganglios positivos no debe ser superior a 2% cuando se ha realizado una cuidadosa sección de la lesión primaria con el objeto de excluir la presencia de invasión”. Con base en esta cifra, Swain y Lippman no aconsejan emprender la disección axilar para efectos de pronóstico. Una tasa de 2% de invasión axilar fue informada por Brown y col. en 1976 (8).
¿Qué quiere decir esta tasa de invasión axilar?
Evidentemente podría explicarse por la presencia concomitante de focos no detectados de carcinoma invasivo.
La coexistencia de carcinoma invasivo es un fenómeno de reconocida frecuencia, siendo ésta directamente proporcional al tamaño de la lesión no invasiva, y al grado de multifocalidad de la misma.
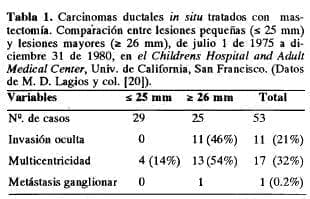
En el estudio de Lagios y col. (20) sobre carcinoma intraductal se informan los hallazgos según el tamaño del tumor sea mayor o menor de 25 mm.
La Tabla 1 (20) revela que las tasas de carcinoma invasivo oculto y de multicentricidad del carcinoma intraductal aparecieron significativamente más altas en los tumores intraductales mayores de 26 mm; el único caso de metástasis ganglionar axilar ocurrió también en este grupo.
Gallager y Martin han planteado que se dispone de evidencia, en algunos estudios, de metástasis ganglionares en casos aparentemente libres de tumor invasivo (13, 15). Su conclusión obvia es que hay carcinomas que realmente son invasivos aunque mantengan la configuración de un carcinoma intraductal, y refieren el trabajo de Ozello y Sanpitak (23), quienes demostraron mediante microscopia electrónica que existen brechas en la membrana basal del epitelio ductal mamario, a través de las cuales se insinúan prolongaciones ameboides de las células neoplásicas para alcanzar los tejidos adyacentes.
Por el contrario, Barsky y col., utilizando técnicas de inmunofluorescencia y de coloración con inmunoperoxidasa:
Han encontrado intacta la membrana basal en los carcinomas ductales in situ (4), y sostienen que los casos observados por Ozello realmente representan carcinomas ductales con microinvasión.
Por lo anterior, y a diferencia del carcinoma lobulillar in situ, el carcinoma intraductal es considerado por algunos autores como una enfermedad maligna capaz, si no es tratada, de generar metástasis (24). De todos modos, maligno o premaligno, universalmente se lo considera dentro del grupo de los “carcinomas mínimos”. Por ello, y con base en la hipótesis de la transformación secuencial del epitelio ductal, se justifica plenamente el interés corriente por lograr la detección temprana y el tratamiento precoz del cáncer mamario.
El carcinoma lobulillar in silu
El carcinoma lobulillar in silU, descrito hace apenas 50 años por Foote y Stewart (12), es una lesión palpable pero que generalmente se descubre por las alteraciones mamográficas presentes en la vecindad de áreas de enfermedad benigna, o incidentalmente en biopsias mamarias; se caracteriza por ser multifocal y frecuentemente bilateral. La tasa de multicentricidad es superior al 50%, y puede alcanzar hasta el 93% (32).
El carcinoma lobulillar in SiIU, tradicionalmente considerado como un estadio en el desarrollo del cáncer lobulillar invasivo, hoy se lo ve más bien como un marcador de .riesgo aumentado (16). Haagensen, quien ha propuesto la denominación de “neoplasia lobulillar” para esta lesión, afirma que es “una enfermedad multicéntrica que afecta tanto a los lobulillos como a los ductos, generalmente en varios focos, y con frecuencia en ambos senos” (17), un concepto que no es universalmente aceptado.
En la reciente revisión de 13 series por Swain y Lippman (32) se presentan las tasas de incidencia bilateral y multicéntrica, que se resumen en la Tabla 2.

Los mismos autores (32) presentan las siguientes tasas de desarrollo de cáncer invasivo en mujeres con carcinoma lobulillar in SiIU, en una revisión de 10 series (Tabla 3).

En el conocido estudio del Columbia-Presbyterian Medical Center, Haagensen y col. (17) encontraron que la incidencia acumulativa de cáncer invasivo ascendía con el período de seguimiento, y que era similar para el seno ipsilateral que para el contra lateral, 10% y 9% respectivamente, a los 15 años, y 22% y 15%, respectivamente, entre los 16 y 25 años. Su recomendación en cuanto al manejo es el seguimiento periódico y cuidadoso.
La mayoría de los cirujanos en la actualidad coinciden con esta conducta, y consideran que el carcinoma lobulillar in silu es una lesión multicéntrica y frecuentemente bilateral que tiende a “estar mal acompañada”, pero que no es una lesión preinvasiva con alto potencial para convertirse en cáncer invasivo, como sí lo plantean Hutter y Foote del Memorwl-Sloan Keuering, por lo cual recomiendan mastectomía radical 1 modificada como la modalidad preferencial de tratamiento (18).
En conclusión, según Swain y Lippman (32), se puede afmnar que la incidencia de cáncer invasivo subsecuente al diagnóstico de carcinoma lobulillar in situ oscila entre 2% y 38%, que tal incidencia es similar para los dos senos y que, considerando las altas tasas de multicentricidad y bilateralidad, en pacientes con carcinoma lobulillar in situ los dos senos deben ser considerados como un solo órgano en cuanto al incrementado riesgo de desarrollar cáncer invasivo. La presencia de metástasis axilares ha sido informada como hallazgo excepcional en unas pocas series (32).
El carcinoma intraductal (ductal in situ)
El carcinoma ductal in SilU, o carcinoma intraductal, ha llegado a convertirse en una lesión de importancia clínica desde el advenimiento de la mamografia y su popularización como examen primario y premier en el estudio de la patología mamaria. Según Lagios (21), en la actualidad representa el 20% de los carcinomas mamarios detectados, la mayoría con apariencia de microca1cificaciones. Su morfología citológica es la del carcinoma invasivo común, pero por definición no aparece invasivo, o sea que no traspasa la membrana basal. Se origina en ductos, o canalículos, y no en lobulillos, como el carcinoma lobulillar in siru.
El carcinoma intraductal es universalmente reconocido como “de mayor peligro” que el carcinoma lobulillar in situ, y en opinión de algunos autores debe ser considerado como verdaderamente maligno y con potencial metastásico (23, 24). En todo caso, es reconocido que existe una elevada frecuencia de transición hacia el estado invasivo cuando el carcinoma intraductal no es tratado (32).
Las tasas de multicentricidad y de bilateralidad han sido infonnadlls en 19-76% y 0-30%, respectivamente; 35% es un promedio usual para multicentricidad, en tanto que no se puede establecer un promedio certero para bilateralidad, aunque se reconoce el mayor riesgo del seno contralateral (32).
También Swain y Lippman (32):
En una revisión de 5 series y 191 pacientes, señalan una tasa de coexistencia de carcinoma intraductal del 14% en promedio en especímenes de mastectomía con oscilación entre el 6 y 21 %, y llegan a la conclusión de que cuando el carcinoma intraductal es tratado mediante biopsia excisional solamente, parece existir un riesgo del 25% de desarrollo subsiguiente de cáncer invasivo en el seno ipsilaterral. En cuanto al seno contralateral, no se dispone de suficiente información para llegar a conclusiones definitivas; sin embargo, se cree que pueda existir un mayor riesgo de desarrollar cáncer invasivo contra lateral en las pacientes con carcinoma intraductal (32).
Los mismos autores (32), revisando 13 series con un total de 875 pacientes con carcinoma intraductal, encuentran una tasa de metástasis ganglionares que oscila entre O y 9.0%, con un promedio de 2.1 %.
Lagios ha planteado recientemente (21) que el carcinoma intraductal representa una variedad de diferentes procesos biológicos con variables frecuencias de invasión oculta y de recurrencia local, según factores tales como el subtipo histológico, la extensión de la enfermedad y la amplitud de los márgenes de la resección local.
Tratamiento
Carcinoma lobulillar in silu
Las modalidades de tratamiento varían, según diversos autores, entre resección local con márgenes libres y seguimiento cuidadoso, y mastectomía total.
Ciertamente la mastectomía ipsilateral no parece lógica frente a una lesión que tiende a ser bilateral. En la paciente de alto riesgo, con historia de cáncer mamario en la madre, hermanas o hijas, se podría justificar una mastectomía bilateral con disección limitada de axila (32).
El Departamento de Cirugía de la Fundación Santa Fe de Bogotá recomienda una conducta conservadora, con re-resección local cuando la biopsia original haya mostrado márgenes comprometidos, sin radioterapia ni quimioterapia adyuvantes, pero con un cuidadoso programa de. control y seguimiento basado en examen clínico cada 4 meses y mamografias secuenciales cuya frecuencia depende del grado de la lesión, la edad y el riesgo estimado de la paciente.
Carcinoma intraductal
Aquí la gama de modalidades de terapia quirúrgica incluye una resección amplia con márgenes libres, resección amplia combinada con radioterapia, y mastectomía total ipsilateral con o sin disección ganglionar.
Ante la característica de multicentricidad del carcinoma in siru y la posible coexistencia de un cáncer invasivo oculto, la mastectomía total sería el tratamiento de elección; la mayoría de los autores consideran que no se justifica la disección axilar frente a tan baja incidencia de metástasis ganglionares, O a 2%. Pero la significación clínica de los múltiples focos aún no está definida. La tasa de recurrencia después de mastectomía total oscila entre 1 y 10%, en tanto que después de resección local oscila entre 56.7 y 25%.
Cuando la resección local se combina con radioterapia, la tasa de recurrencia oscila entre 1 y 14%, no muy diferente a la de la mastectomía (32).
Frente a la tendencia actual de tratar el cáncer invasivo temprano con resecciones segmentarias (tumorectomía) combinadas con radioterapia, la modalidad de cirugía conservadora aparece lógica frente a un carcinoma ductal no invasivo.
Los estudios del Colegio Americano de Cirujanos no hallaron diferencia entre los resultados del tratamiento del carcinoma intraductal (supervivencia a 5 años) con resección local o mastectomÍa (31,6).
En una serie de Boston (33), aunque la modalidad de tratamiento preferida en 53 mujeres y dos hombres, fue la mastectomÍa total con disección axilar, 3 pacientes fueron tratados con resección local y 3 con radioterapia primaria.
Ningún paciente de la serie desarrolló carcinoma recurrente o metástasis clínicamente aparentes y ninguno presentó ganglios axilares afectados.
Sin embargo, en una de las pacientes que murió 14 años después de la mastectomía radical para carcinoma intraductal, en la autopsia se encontró un pequeño foco de adenocarcinoma metastásico, compatible con un tumor primario del seno, en la serosa del colon.
Los autores sostienen que aunque la mastectomía parece ser la modalidad preferida en la fecha de su publicación (1983), aquella no puede ser recomendada sin algunas reservas, y que parece irrazonable que una mujer que se presenta con un carcinoma temprano preinvasivo, pueda quedar satisfecha cuando se premia su diligencia con la posibilidad de la amputación de un seno (33).
Montagne ha tratado este tipo de cáncer no invasivo con resección simple y radioterapia, con resultados comparables a los de la mastectomÍa (22). Similares experiencias han sido informadas por otros autores en publicaciones recientes (10-29, 21).
Finalmente, debe mencionarse el nuevo protocolo B-17 del NSABP, implantado en 1985 (11), el cual compara dos modalidades de tratamiento quirúrgico conservador: mastectomía segmentaria con márgenes libres de tumor y disección axilar de niveles 1 y TI, versus mastectofuía segmentaria con disección axilar y radioterapia, del cual se esperan importantes resultados.
El Departamento de Cirugía de la Fundación Santa Fe de Bogotá recomienda mastectomÍa segmentaria (tumorectomía) con bordes libres, y radioterapia coadyuvante al seno, para pacientes con carcinoma intraductal de tipo focal o localizado. Se recomienda realizar la disección axilar, de niveles 1 y 11, solamente en aquellas pacientes que presenten ganglios axilares palpables.
En pacientes con carcinoma intraductal difuso se recomienda mastectomía total.
Referencias
- 1. Abaúnza H, Márquez G: Patología mamaria benigna. Trib. Médica (C.olombia) 1991; 83: 65
- 2. Anderson W: Boyd’s Pathology for the Surgeon. 8th 00, Philadelphia W. B. Saunders C.ompany, 1967, pp.ll8-444
- 3. Ashikary R, Huvos Snyder R E et al: A c1inicopathologic study of atypical lesions of the breast Cancer 1974; 33: 310
- 4. Barsky S H, Siegal G P, Jannotta F et al: Loss of basement membrane components by invasive tumors but not by their benign counterparts. Lab. Invest. 1983; 49: 140
- 5. Bealirs O, Smart C R: The Breast Cancer Demostration Projects as Viewed by the Clinician. In: Breast Carcinoma: Current Diagnosis and Treatment. S A Feig, R. McLelland,edilors, New York, Maso n Publishing USA, Inc, 1983
- 6. Bedwani R, Vana J, Rosner D et al: Management and survival of female patients with “minimal” breast cancer: As observed in the long-term and short-term surveys of the American C.ollege of Surgeons. Cancer 1981; 47: 2769
- 7. Broders A C: Carcinoma in situ contrasted with benign penetrating epithelium. JAMA 1932; 99: 1670
- 8. Brown P W, Silverman J, Owens E et al: Intraductal “noninfiltrating” carcinoma of the breast. Arch Surgl976; 111: 1063
- 9. Dupont W D, Page D L: Risk factors for breast cancer in women with proliferative brea st disease. N Engl J MOO 1985; 312: 140, 1985
- 10. Findlay P A, Goodman R: Radiation therapy for treatment of intraductal carcinoma of the breast. Am J Clin Oncol 1983; 6: 281
- 11. Fisher B: NSABP Prolocol B-17. Twenty- eight Semiannual Meeting of the National Surgical Adyuvant Project for Breast and Bowel Cancers (NSABP). February 17-19, 1986
- 12. Foote F W, Stewart F E: Lo bu lar carcinoma in situ. Am J Pathol 1951; 17: 491, 1951
Bibliografía
- 13. Gallager H S, Martin J E: The pathology of early breast cancer. In: Early and Late. Year Book Medical Publishers, Inc. Chicago, 1970
- 14. Gallager H S, Martin J E: An orientation to the concept of minimal breast cancer. Cancer 1971; 28: 1505
- 15. Gallager H s: The developmental pathology of breast cancer. Cancer 46: 90S, 1980
- 16. Gump F E: Lobular carcinoma in situ. Surg C1in North Am 1990; 70: 873
- 17. Haagensen C D, Lane N, Lattes R et al: Lobular neoplasia (so-called lobular carcinoma in situ) of the breast. Cancer 197842: 737
- 18. Hutter R V P, Foote F W: Lobular carcinoma in situ: Long-term follow-up. Cancer 1969; 24: 1081
- 19. Hutter R V P Goodbye lo “fibrocystic disease”. N Engl J Med 1985; 312: 179
- 20. Lagios M D, Westdalil P R, Margolin F R, Rose M R: Duct carcinoma in situ. Relationship of extent of noninvasive disease lo the frequency of occult invasion, multicentricity, Iymph node metastases and short-term failures. Cancer 1982; 50: 1309
- 21. Lagios M: Duct carcinomá in si tu. Surg Clin North Am 1990; 70: 853
- 22. Montague E D: C.onservative surgery and radiation therapy in the treatment of operable breast cancer. Cancer 1981; 53: 700
- 23. Ozello L, Sanpitak P: Epithelial stromal junction of intraductal carcinoma of the breast. Cancer 1970; 26: 1186
- 24. Ozello L: Intraepithelial carcinoma of the breast. En: New Frontiers in Mammary Pathology. K H Hollman, J M Verley, editors, New York, Plenun Press, 1983
- 25. Page D L, Dupont W D, Rogers L W, Radas M S: Atypical hyperplastic lesions of the female breast. A long-terrn followup study. Cancer 1985;’55: 2698
Fuentes
- 26. Page D L, Dupont W D: Premalignant conditions and markers oC elevated risk in the breasl and their management. Surg Clin North Am 1990; 70: 831
- 27. Patiño J F: Guía para el uso de mamografía. Protocolos del Departamento de Cirugía del la Fundación Santa Fe de Bogotá. Bogotá, julio de 1988
- 28. Peña P M, Montoya J, Patiño J F: Lesiones no palpables del seno. Su localización mamográfica. Rev Col. Cirug 1990; 5: 123
- 29. Recht A, DanoCC B, Solin L J et al: Intraductal carcinoma oC the breast: Results oC treatment with excisionaI biopsy and irradiation. J Clin Oncol 1986; 4: 716
- 30. Report oC the working group to review the NCI/ACS Breast Cancer Detection Demostration Projects. J Natl Cancer Inst 1979; 62: 641
- 31. Rosner D, Bedwani R N, Vana J et al: Noninvasive breast carcinoma: Results oC a National survey by the American CoIlege oC Surgeons. Ano Surg 1980; 192: 139
- 32. Swain S M, Lippman M E: Intraepitbelial carcinoma oC tbe breast: LobuIar carcinoma in situ and ductal carcinoma in situ. In: Diagnosis and Management oC Breast Cancer. M E Lippman. A S Licbter, D N DanCortb Jr. editors, Pbiladelpbia, W B Saunders Company, 1988
- 33. von Rueden D G, Wilson R E: Intraductal carcinoma oC tbe breast. Surg Gynecol Obstet 1984; 158: 105
- 34. Zafrani B. Fourguet A, Villoq J R et al: Conservative management oC intraductal breast carcinoma witb tumorectomy and radiation tberapy. Int J Radiat Oncol Biol 1984; 10: 140
Doctor José Félix Patiño, Jefe del Dpto. de Cirugía, Centro Médico de los Andes, Bogotá, D.C., Colombia.