Antiarrhythmic Behavior of Hypoxia in Cardiac Transmural Wall Simulations in Presence of Sub-Epicardic Ischemia
Oscar Henao Gallo1, Eduardo Ramírez Vallejo2,
José Maria Ferrero Jr.3, Jorge Reynolds Pombo4
Resumen
El papel preponderante de la corriente de potasio sensitiva a Adenosin Trifosfato y su contribución a cambios electrofisiológicos que ocurren durante heterogeneidades y alteraciones fisicoquímicas debido a isquemia en la pared transmural cardíaca son aún debatidos.
El objetivo de este trabajo fue estudiar la infl uencia de la activación de la hipoxia en la desestabilización del frente de onda eléctrico en pared transmural heterogénea en presencia de isquemia subepicárdica en un modelo computacional de tejido virtual.
La taquicardia polimórfi ca obtenida de las simulaciones muestra que la activación de la hipoxia presenta un comportamiento antiarrítmico. La hiperkalemia es el principal agente capaz de generar bloqueo de conducción y alteraciones del segmento TQ y el segmento ST en los electrogramas obtenidos.
Palabras clave: Electrogramas, hipoxia, isquemia, modelo Luo-Rudy, pared transmural heterogénea, reentrada espiral, taquicardia ventricular polimórfica.
Abstract
The role of potassium adenosine triphosphate sensitive fl ow and its contributions to electrophysiological changes that occur during chemical-physical alterations and heterogeneities due to ischemia in cardiac transmural wall is still debated.
The aim of this work was to study hypoxia activation influence in wavefront electric disturbance in heterogeneous transmural wall subjected to sub-epicardial ischemia, using a virtual tissue computational model. Polymorphic tachycardia obtained of simulations show hypoxic activation anti-arrhythmic behavior. Hiperkalemia is the main agent able to block heart conduction, TQ segment and ST segment alterations of calculated electrograms.
Keywords: Electrograms, heterogeneous transmural wall, hypoxia, ischemia, Luo-Rudy model, polymorphic ventricular tachycardia, spiral reentry
Introducción
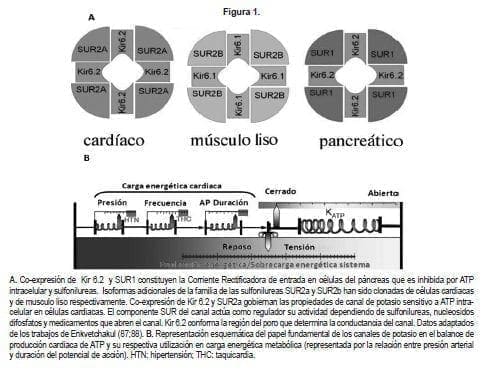
Los canales de potasio sensitivos a Adenosin Trifosfato (KATP) fueros descubiertos por Noma (1) en miocitos ventriculares. Desde entonces dichos canales se han encontrado en células b del páncreas y músculo liso.
Una distribución de sus subunidades componentes es mostrada en la figura 1 para los tres diferentes tipos de tejido. Su función contribuye en diversas respuestas celulares debido a su enlazamiento con estados bioenergéticos de la célula con el potencial de membrana (2).
En células cardiacas, la acción de los canales KATP es disyunta, debido a que se cree que en condiciones normales en miocitos, dichos canales están cerrados (3); sin embargo en eventos hipóxicos u isquémicos juegan un papel preponderante en dichos estados fisiopatológicos del corazón (4;5).
La reducción en la concentración de [ATP]i evoca corrientes a través de los canales regulados por ATP (KATP) en mayor magnitud en porciones de células epicárdicas que en porciones endocárdicas (6). La rápida activación de los canales de potasio activado por ATP en epicardio aparece como responsable del acortamiento del potencial en epicardio durante isquemia en felinos (7).
En caninos, la activación de los canales de potasio activados por ATP aparece involucrada en el acortamiento de la duración del potencial de acción en isquemia y la elevación de potasio extracelular.
Una respuesta diferenciada de la capa epicárdica respecto de la endocárdica ante una menor reducción del ATP intracelular, sugiere una un bajo umbral para activación y/o una densa distribución de los canales de KATP en la capa epicárdica (8).
El bajo umbral de activación de los canales de KATP en epicardio pueden explicar, al menos en parte, la supervivencia preferencial de la capa frente a necrosis durante prolongada isquemia regional (9;10).
La modulación de los canales dependientes de ATP por la duración diferencial del potencial, permite sincronizar la producción y el consumo de energía de forma acorde con el gasto celular preservando el balance energético ante diferentes sobrecargas en procesos metabólicos agudos (ver diagrama en la parte B de la figura 1) (11;12). (Lea: Editorial, La Reforma del Sistema General de Seguridad Social en Salud)
El cuadro de la Figura 2 muestra un resumen de los cambios fisiológicos y bioquímicos generados en isquemia del miocardio por estenosis parcial o total de las arterias mayores del ventrículo izquierdo.
Una distinción entre eventos isquémicos fisiológicos (estenosis parcial que genera una condición donde el flujo coronario es inadecuado para que el órgano responda de manera suficiente para soportar el cuerpo en rango completo de actividad fisiológica) o bioquímicos (estenosis mayor o total que genera una condición en la cual el flujo coronario es incapaz de permitir el mantenimiento de un metabolismo de estado estacionario) (13;14).
En isquemia aguda la falta de flujo coronario disminuye la función contráctil en la región isquémica. Tan pronto como el estado estacionario se ha instaurado (2-3 minutos desde el comienzo de la oclusión), aparece una relación consistente entre flujo sanguíneo y la reducción regional de la función contráctil. Mientras normal mente el flujo de sangre subendocárdica es más grande que el flujo subepicárdico (15).
Gallagher encontró una relación aproximadamente lineal entre el grosor de la pared en sístole y el flujo de sangre subendocárdico o transmural dependiendo de la situación hemodinámica (16).
Lo sensitivo del epicardio a cambios en isquemia podría ser explicado por el fenómeno de la hibernación miocárdica (reducción adaptativa del gasto de energía en la función contráctil no como consecuencia de su falta sino como un elemento regulador para evitar un déficit de energía y mantener la viabilidad miocárdica) cuya fisiopatología es caracterizada por su reversibilidad si la estenosis arterial es removida (17).
El fenómeno se ha estudiado en eventos isquémicos donde existen cero flujo de sangre en modelos de corazones de cerdo, durante el cual el pH intracelular e intersticial decreció y produjo un rápido deterioro en la función contráctil del ventrículo, facilitando la restauración del balance, de gran debate en la literatura, entre suministro y demanda de energía.
El inicio de este mecanismo de protección por isquemia o por el contrario, el convertirse en sustrato fisiológico es un arma de doble filo en la generación de arritmias (18).
En este trabajo se presenta un modelo detallado de pared transmural cardiaca sujeta a una lesión isquémica subepicárdica, en la cual se ha modelado una estructura conformacional de los tres tipos de células del ventrículo, para estudiar la influencia de los parámetros de la isquemia en la formación de rupturas de frentes de onda de potencial y su influencia en reentradas espirales dentro de la pared cardiaca.

1 PhD, Doctor en Bioingeniería Instituto de Investigación Interuniversitario en Bioingeniería y Tecnología Orientada al Ser Humano, Universidad Politécnica de Valencia, Valencia. España. Pertenece al grupo de Fisiología Celular de la Universidad Tecnológica de Pereira.
2 MD, MSc, Profesor Asociado, Facultad de Medicina, Universidad Tecnológica de Pereira. Grupo de Fisiología Celular de la Universidad Tecnológica de Pereira. Unidad de Cardiología y Medicina Interna, Hospital Universitario San Jorge. Pereira. Colombia.
3 PhD. Doctor en Ingeniería Industrial. Departamento de Electrónica, Universidad Politécnica de Valencia, España.
4 Doctor Ad Honorem en Ingeniería Biomédica, Director Grupo de Seguimiento al Corazón Vía Satélite.

