Climaterio Masculino
Contribuciones Originales
Enrique Herrera*, Fabio Sánchez**, Ana María Villaquirán***
* Jefe Dpto. Ginecología y Obstetricia Universidad del Valle, Sección Endocrinología e Infertilidad. Cali
** Profesor U. De Antioquia, ex presidente Asociación Colombiana de Menopausia. Medellín.
*** Residente Rotante (USCO) 3º Año de Ginecología y Obstetricia Universidad del Valle. Cali.
Resumen
Es establecido que los niveles de andrógenos declinan con edad del hombre. Las concentraciones de testosterona disminuyen a partir de los 45 a 50 años. La pregunta que se establece inmediatamente es si la disminución de los niveles de testosterona relacionados con la edad, causa andropausia o también llamado climaterio masculino y si su sintomatología mejora con el reemplazo hormonal como sucede en la mujer.
El término de andropausia no es el adecuado para explicar la disminución progresiva de la secreción fisiológica de andrógenos fisiológica ya que el término implica cese absoluto y no disminución progresiva como sucede en el hombre. Muchos autores refieren usar el acrónimo de PADAM (deficiencia parcial o progresiva de andrógenos en el hombre senil). Otros lo identifican con el nombre de PEDAM indicando deficiencia parcial endocrina debido a que existen otras hormonas que paralelamente también declinan con la edad como sucede con la hormona de crecimiento.
Palabras clave: Andropausia, climaterio masculino, PEDAM.
Abstract
It is now well established that androgen levels decline in ageing men. This becomes evident from the age of 45-50 years on as far as the concentration of total testosterone is concerned. The major questions are whether the age-related decline of testosterone cause andropause. Also called male climateric, and what the simptoms of this condition are. Furthermore, one can wonder whether restoration of the hormonal situation by means of hormone replacement therapy (HRT) can be applied in the male with as much success as it has been done over several decades in postmenopausal women.
The term andropause is not adequate for the physiological decline of androgen secretion, which does not stop but decreased rather gradually with time. Several authors prefer to use the acronym PADAM (Partial or Progresive Androgen Deficiency of the Ageing Male). Others favor the name PEDAM indicating partial endocrine deficiency, since other hormones also decrease with age, in particular growth hormone.
Key words: Andropause, male climateric, PADAM.
Introducción
Con el aislamiento y síntesis de testosterona desde el año 1930, varios informes fueron publicados, sobre el diagnóstico y tratamiento del climaterio masculino. En 1944 los Doctores Car Séller y Gordon Mayers en Estados Unidos describieron el primer reporte sobre menopausia masculina y en donde se compararon los síntomas y signos del climaterio masculino con la menopausia femenina, además demostraron efectividad en el tratamiento de la insuficiencia testicular con la administración de testosterona1.
Definición
La andropausia es un nuevo concepto establecido por muchas especialidades y cuya definición no está universalmente aceptada y se refiere a la disminución progresiva de la producción de andrógenos en el hombre, asociada a la senectud (PADAM)5.
El término andropausia es biológicamente incorrecto y clínicamente inapropiado, sin embargo se utiliza para describir los cambios físicos y emocionales que se presentan secundariamente en el hombre de edad avanzada, asociados a las alteraciones hormonales2.
El síndrome se caracteriza por alteraciones en los dominios físico e intelectual y los cuales pueden ser corregidos con la manipulación de los niveles circulantes de andrógenos.
El proceso de declinación hormonal no es igual en todos los hombres, a diferencia de lo que ocurre en la mujer en donde la menopausia se presenta con cierta similitud y universalmente para el sexo femenino, como una manifestación secundaria a la falla ovárica.
Epidemiología
El estudio y manejo del climaterio masculino no ha tenido ningún interés para los clínicos y mucho menos para la salud pública, sin embargo el proceso de envejecimiento también compromete al hombre, es por ello que debe ser un objetivo de enfoque de la medicina del siglo XXl.
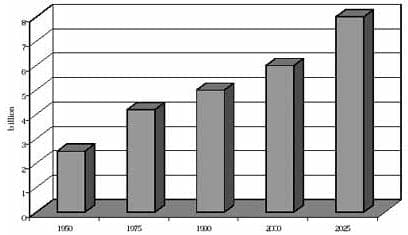
Figura 1. Proyección promedio de vida, según la ONU
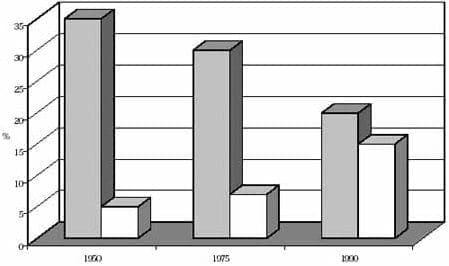
Figura 2. Población masculina productiva
La magnitud del problema no ha sido claramente definida, pero el incremento de las personas de mayor edad, predicen que las enfermedades asociadas se incrementarán significativamente en la mitad del presente siglo. Según la ONU el promedio de vida de la población mundial, será de aproximadamente 75 años y el porcentaje de personas mayores se triplicará, mientras que el número de niños disminuirá del 35 al 20% (figuras 1 y 2)2.
La edad de inicio del climaterio masculino es variable, presentándose con más frecuencia entre los 51 y 60 años, seguido por los hombres de 61 a 70 años de edad. El hipogonadismo bioquímico es detectado solamente en el 7% de los hombres menores de 60 años pero se incrementa al 20% en mayores de 60 años. (A mayor edad mayor hipogonadismo).
Endocrinología
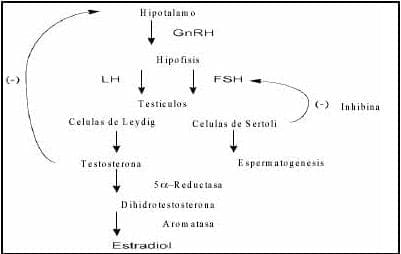
La función reproductiva del hombre normal depende de la secreción intermitente por la hipófisis de la LH y FSH, bajo la influencia de la hormona liberadora de gonadotropinas (GnRh), hormona secretada en forma pulsátil por el hipotálamo. La LH estimula las células de Leydig para secretar testosterona de manera pulsátil, y a un ritmo diurno donde su pico de secreción ocurre en las horas de la mañana y el nadir en las horas de la tarde. La LH es modulada por el hipotálamo mediante retroalimentación negativa.
Los testículos producen 0.24 µmol/día de testosterona, secreción que se inicia desde la vida fetal, con un pico alrededor de las 12 semanas de gestación; después del nacimiento ocurre un segundo pico; al inicio de la pubertad los niveles de T se encuentran bajos y sólo retornan a la normalidad con la maduración del eje hipotálamo-hipófisis-gónada que conllevan a la maduración de las células de Leydig.
En el testículo la FSH estimula a las células de Sertolli para iniciar la espermatogénesis, y a la vez esta célula sintetiza la inhibina, compuesto no esteroideo que regula los niveles de FSH por un feedback inhibitorio hacia la hipófisis y posiblemente en el hipotálamo (figura 3)3.
Figura 3. Producción y regulación de la testosterona
La testosterona es secretada por las células de Leydig de los testículos y su producción es regulada por un mecanismo de retroalimentación negativa, en donde participa la hormona liberadora de gonadotropinas GnRh en el hipotálamo y la hormona luteinizante (LH) de la hipófisis (figura 3).
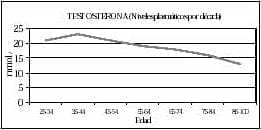
En el hombre joven hay una variación diurna de la concentración sérica de testosterona con mayores valores alrededor de las 8 a. m. y el nadir al finalizar la tarde; en tanto en el hombre mayor se pierde este ritmo circadiano. El porcentaje de disminución de los niveles de testosterona total es aproximadamente 110 ng/dl por década. Los niveles plasmáticos y urinarios del 3 alfa androstanodiol glucurónido, metabólito que mide la secreción de los andrógenos, también disminuyen con la edad (figura 4)3.
Figura 4. Niveles de testosterona-edad
En el hombre normal, aproximadamente el 98% de la testosterona total se encuentra unida a la globulina transportadora de hormonas sexuales (SHBG) y sólo una mínima parte se encuentra unida a la albúmina y a la globulina fijadora a cortisol o transcortina, mientras que 2% se encuentra en forma libre (no unida a proteínas). El término de testosterona bioactiva o biodisponible se refiere al total de la testosterona libre más la unida a la albúmina
La testosterona es metabolizada por la acción de la 5-alfa reductasa a dihidrotestosterona (DHT) siendo este andrógeno el más potente y la verdadera hormona que actúa en el órgano blanco. Parte de la T se metaboliza a estradiol por acción de las aromatasas.
Aunque la evidencia de una anormalidad testicular primaria es clara, se ha sugerido un defecto secundario a la alteración del eje hipotálamo-hipofisiario, basado en las observaciones cuando las concentraciones de testosterona sérica permanecen normal _ bajas y el testículo conserva la habilidad de respuesta a un estimulo exógeno de gonadotropinas con incremento de secreción de testosterona.
La disminución de la testosterona y el porcentaje de depuración con la edad es multifactorial como respuesta a los numerosos cambios anatómicos que ocurren en el testículo, esto incluye el tamaño testicular y el peso, disminución en las células de Leydig, vacuolización y lipofución de éstas, defectos en los túbulos seminíferos con degeneración posterior y disminución en la producción de inhibina (INH).
Se han propuesto muchas teorías para explicar el deterioro de la función hipofisiaria con la edad, es así como Kley y colaboradores sugirieron un incremento en los niveles de estrógenos y de otros esteroides circulantes que inhiben la secreción de gonadotropinas y disminuyen secundariamente los niveles de testosterona.
Finalmente se postula que hay una disminución en la sensibilidad de los gonadotropos hipofisiarios, secundarios a cambios en el número de receptores GnRh con la edad.
Otros estudios muestran una falla a nivel hipotalámico generando una inapropiada amplitud en la producción de pulsos de GnRh. Dos factores pueden estar implicados en este papel:
a) La unidad hipotálamo-hipófisis es más sensible a los efectos supresores de la testosterona en la gente senil (mayores de 60 años) que en la gente joven (menores de 40 años).
b) La supresión de las beta-endorfinas por el incremento de la LH. Esta teoría está soportada por el incremento de la LH y testosterona en hombres hipogonadales tratados con antagonistas opioides (Nalmefene).
Un incremento de la FSH ocurre en la senectud y parece estar relacionada con la disminución en la concentración de inhibina y el incremento en los niveles de activina A.
Los niveles séricos de testosterona disminuyen con la edad, sin embargo al inicio, la velocidad y la declinación son variables e individuales; a partir de los 50 años disminuye aproximadamente 1% por año, sin embargo existen diferencias de un individuo a otro, acompañado de un incremento de la concentración de globulinas transportadoras de hormonas sexuales (SHBG) como consecuencia de la mayor síntesis de estradiol por las aromatasas a nivel de la grasa, por lo tanto los niveles de testosterona libre son menores que los de testosterona total.
La disminución de los niveles de andrógenos relacionados con la edad, es el resultado de una falla gonadal primaria asociada a falla del eje hipotálamo-hipofisiario. Se describen algunos cambios morfológicos en el testículo tales como disminución en el volumen y número de las células de Leydig, alteración en la biosíntesis de hormonas esteroideas, alteración del flujo sanguíneo en las gónadas y disminución de la síntesis de esteroides después de la administración de HCG.
Las alteraciones en el eje hipotálamo-hipofisiario incluyen disminución de la variación diurna en los niveles de gonadotropinas, respuesta plana de la hormona luteinizante (LH) a la GnRh, disminución o ausencia de respuesta de los niveles de LH a la naloxona o tamoxifeno, e incremento de la sensibilidad de las gonadotropinas al “feedback” de la testosterona.
Los hombres en andropausia permanecen fértiles; sin embargo hay disminución en la espermatogénesis y en la motilidad espermática, fenómeno que es explicado por la disminución en el número y función de las células de Sertoli llevando a incremento en los niveles de FSH y como consecuencia disminución de los niveles de INH; también en hombres maduros puede haber una respuesta variable de los órganos blancos (cerebro, hueso, próstata, músculo) a los niveles de andrógenos.
Otros cambios Hormonales Asociados a la edad. Corrección
Además de los cambios en el eje hipotálamo-hipófisis-gónada, otros cambios importantes tienen lugar en la actividad endocrina. Lamberts y col describieron dos cambios clínicos importantes ocurridos en el páncreas y en la tiroides; deterioro en la tolerancia a la glucosa o diabetes mellitus, afecta al 40% de la gente entre los 65 años y los 74 años de edad, en donde cerca de la mitad de estos no son diagnosticados. Hay deterioro en la tolerancia a la glucosa que se atribuye a varios factores incluyendo: la disminución de la secreción de insulina por las células beta del páncreas, resistencia periférica a la insulina, una dieta rica en carbohidratos, aumento en la masa corporal lipídica e inactividad física. La dieta, los hipoglicemiantes, la insulina y el ejercicio son todos los manejos para la intolerancia a la glucosa. Así como una disminución de la secreción de hormona estimulante de la tiroides, tirotropina (TSH) por la hipófisis y disminución en la conversión periférica de T4 a T3, con disminución de T3 total.
Mientras el testículo produce 0.24 µmol/dia de testosterona, la corteza adrenal produce 0.002 µmol/día de andrógenos, de predominio delta 5 o prehormonas, principalmente dehidroepialdosterona (DHEA), dehidroepialdosterona sulfato (DHEAS), androstenodiona y cortisol, que son los principales esteroides adrenales. Re cientemente la DHEA y DHEAS han recibido mucha atención desde que se ha reportado que tienen una relación inversa con la edad.
La disminución de DHEA y DHEAS con el incremento de la edad es una característica mucho más constante que en el hipogonadismo, y a partir de la quinta década de la vida sus niveles decrecen a menos del 30% con respecto a los valores observados en hombres menores de 30 años2.
La DHEA y la DHEAS son andrógenos débiles secretados por la glándula adrenal primariamente. Con la edad hay una disminución de estas hormonas, tienen efectos antiaterogénicos, inmunoestimulatorios y efectos anticancerogénicos. Los efectos en el hombre senil son cuestionables; se han reportado estudios donde hombres con bajos niveles de DHEAS tienen más alto riesgo de mortalidad cardiovascular dentro de los dos primeros años, pero no han sido confirmados. Como también se le atribuye la sensación de bienestar después de la administración de DHEAS.
La disminución de la DHEA y DHEAS es más constante en hombres seniles que en hombres hipogonadales. A partir de la quinta década de la vida los niveles disminuyen en menos del 30% de todos los hombres menores de 30 años.
Adicionalmente ocurren cambios endocrinos con la hormona de crecimiento (GH)/ factor de crecimiento a la insulina (IGF-I), se presenta disminución en la amplitud de pulsos, duración y disminución en la fracción GH secretada. Esta disminución ha sido denominada Somatopausia. La producción de GH después de alcanzar la máxima producción entre 20 y 30 años, disminuye 14% por década. La disminución de IGF-I está asociada con cambios en la masa muscular, en la densidad del hueso y la distribución del patrón de obesidad descritos también en los estados hipogonadales. Más recientemente la IGF-I ha sido identificada como un agente de apoptosis neuronal, hallazgos que tienen implicaciones en la enfermedad de Alzheimer.
La secreción de melatonina por la glándula pineal también disminuye con la edad a pesar de ser estimulada por estados de hipoglicemias y oscuridad. Además, la glándula pineal está involucrada con la regulación de los biorritmos.
Finalmente, se ha sugerido que ocurren cambios importantes en la sensibilidad de los receptores de testosterona con el incremento de edad, asociado con una regulación en menos de los receptores de andrógenos en la próstata y hepatocitos de ratas llevando a una resistencia a los andrógenos durante la senescencia.
Lo nuevo del Climaterio Masculino
Los efectos en un individuo mayor saludable giran entorno al ambiente que le brinda seguridad, tanto en el campo socioeconómico, emocional, como en su determinante genético para mantener un estilo de vida exitoso y se manifiesta en una senectud placentera.
A medida que declinan las funciones fisiológicas paralelamente se presentan cambios en la actividad de los diferentes sistemas hormonales durante la senectud, lo que hace suponer que parte del proceso de envejecimiento es multifactorial y compromete órganos y sistemas especialmente en lo relacionado con el sistema endocrino. Varios estudios6 mostraron en el varón, que los niveles de testosterona sérica están directamente relacionados con la habilidad funcional, fuerza muscular y densidad mineral ósea, mientras que los niveles séricos de estradiol están directamente relacionados con la densidad mineral ósea y el estilo de vida, así como los niveles séricos bajos de la proteína unidora del factor de crecimiento de insulina son fuertes indicadores de buen estado físico del individuo, como un alto nivel de esta proteína es un predictor de mortalidad.
Hipótesis de neuroregulación en la senectud
Tres puntos de discusión en esta hipótesis:
Diferenciación del cerebro senil del cerebro patológico por enfermedad degenerativa: en el cerebro senil la pérdida neuronal afecta principalmente la región subcortical como el locus cerúleo y los núcleos de la base y se proyectan hacia la corteza.
La neurogénesis se conoce actualmente que también se presenta en el cerebro adulto esto ha obligado a revisar el dogma de que la neurona alcanza un envejecimiento mitótico y la pérdida neuronal es inevitable en la senectud.
El efecto adverso que ejerce el estrés psicológico en el hombre, desencadena patología secundaria tal como la depresión que actúa indirectamente sobre la mortalidad y el efecto es acumulativo con el tiempo.
El concepto de Allostasis de McEwen se refiere a la existencia de un deterioro cerebral como resultado de las demandas ejercidas sobre el cuerpo por un estrés excesivo o continuo. Se representa en el cerebro como una atrofia en el hipocampo, deterioro de la neurogénesis hipocampal y disturbios neuroendocrinos manifestados en la actividad del eje Hipotálamo-Hipófisis-Adrenal (HHA) estimulando una actividad exagerada de HHA como respuesta al estrés. Estas alteraciones neuroendocrinas a su vez están asociadas en últimas a daño de órgano blanco, alteraciones de la glucosa, reducción de la densidad mineral ósea, arteriosclerosis, mortalidad prematura y deterioro cognitivo exagerado en la senectud7.
Alteraciones del eje corticotropico como respuesta al estrés
El fenómeno que ocurre en el proceso de involución neuroendocrino-endocrino en la senectud, es similar a lo que se sucede con el estrés prolongado. El estrés activa el eje HHA. Después de un estrés repetido o prolongado o crónico la reactividad del eje HHA cambia y se presenta un retraso en la respuesta del cortisol y más tarde una disminución de éste que se evidencia con una disminución de los valores de cortisol matutinos. Los andrógenos adrenales se elevan y las hormonas esteroideas disminuyen.
Esta cascada de eventos se asocia e incrementa con los problemas generados por el deterioro psicosocial, económico, y noxas como el consumo de cigarrillo y alcohol. Estos cambios asociados a los eventos que ocurren con la senectud y el deterioro orgánico, se acelerará con el transcurso del envejecimiento8.
la administración diaria de hormona LH, sugiriendo un defecto testicular primario. Sin embargo, algunos autores encontraron que en ratas seniles se observaba una disminución en la amplitud de pulso de la LH, una disminución de la GnRh y una disminución de GnRH mRNA y péptidos en el hipotálamo, y una disminución de las gonadotropinas secundaria a la acción de los aminoácidos exitatorios. También se encontró en el estudio, que una disminución de la concentración de estos aminoácidos conducía a un aumento de la actividad de la ÓXIDO NÍTRICO sintetasa (ONS) producido después de un aumento en la apoptosis de la célula neuronal. Se concluyó en el estudio que un incremento en los niveles hipotalámicos de NOS inducible puede llevar a neurotoxicidad en el hipotálamo y esto conducir a un deterioro en la secreción de pulsos de la GnRh que conlleva a una disfunción de la célula de Leydi10.
Senectud y eje somatotrópico IGF1
Hay una contribución endocrina significativa con la reducción de la hormona de crecimiento, GH, del factor de crecimiento similar a la insulina IGF1 y del eje de hormonas esteroideas.
Los múltiples signos y síntomas que acompañan al proceso de senectud son muy similares a los que se presentan en los adultos con deficiencia de la GH y ciertamente la administración de GH puede aminorar mucho los déficits psicofisiológicos asociados al hiposomatotropismo. La disminución fisiológica de la secreción de GH en la senectud puede llegar a ser severa.
Insuficiencia de GH en la senectud refleja deficiencia de GHRH hipotalámica y un exceso de somatostatina. Reducción en la secreción de la producción del péptido liberador de la GH puede también contribuir a una disminución de GH en la edad adulta y en el hombre senil.
Los neurotransmisores primarios en el SNC pueden reducir la GHRH y acentuar la libera ción de la Somatostatina, estimular la producción de colinérgicos alfa 2 adrenérgicos, dopaminérgicos y serotoninérgicos y la inhibición de los beta 2 adrenérgicos11.
El papel de la IGF1 y la insulina con la edad y la arteriosclerosis
Con la edad avanzada los niveles séricos de IGF1 disminuyen continuamente pero muestran una gran diferencia entre cada individuo. Existe una relación entre el resultado de IGF1 sérica y es un determinante para el individuo del sentirse bien y sobrevivir en la senectud. Por otro lado, la secreción de insulina parcialmente está relacionada con la obesidad y la senectud propiamente dicha. La insulina estimula In Vitro la proliferación, migración y secreción del colágeno de las células del músculo liso del tejido vascular. El mecanismo se basa en la acción de los receptores de IGF1 sobre la insulina.
En la senectud el porcentaje de proliferación de las células del músculo liso vascular SMCs, y su habilidad de migración disminuye, este mecanismo esta basado en el uso de los receptores IGF1 por la insulina. Con los avances en la edad el porcentaje de proliferación de migración de las SMCs disminuye y si se la administra IGF1 no hay recuperación ni las SMCs adquieren sus mismas propiedades.
Los bloqueadores del calcio como el diltiazen inhiben in vitro la estimulación de las SMCs por el factor de crecimiento similar a la insulina 1 e inhibe la proliferación de las SMCs y su migración por acción de la insulina.
Se concluyó que en la senectud hay una disminución del IGF1 al igual que la secreción de hormona de crecimiento. El papel de la insulina en la aterogénesis está relacionado con la hiperinsulinemia, pero el incremento en la producción de insulina es parte del proceso de senectud; sin embargo el papel de la insulina en las SMCs son la producción de cambios de aterogénesis y el diltiazen podría actuar como antiaterogénesis. En edades avanzadas el riesgo de aterogénesis disminuye por la baja propensión de que las SMCs proliferen y migren, lo cual es posible debido a la gran cantidad de células seniles12.
Eje tiroideo en la edad
Dentro de los cambios que se presentan en la senectud, la glándula tiroides también juega un papel importante. Estudios reportan una disminución de los niveles séricos de triyodotironina mientras que los niveles de tiroxina libre no presentan cambios y los niveles de triyodotironina reverso ligeramente se incrementan. El mecanismo regulatorio es controversial y estos cambios son discutidos.
Estudios en ratas masculinas seniles sugieren una disminución de TSH debido a una síntesis limitada de beta-TSH por la glándula hipófisis, así como una disminución de la actividad del hipotálamo. Sin embargo múltiples factores pueden influir en la regulación normal del eje hipotálamo-hipófisis-tiroides13.
Secreción de insulina y resistencia
La senectud también está asociada a un incremento en la incidencia de hipertensión, enfermedad macro vascular y diabetes tipo II (insulino no dependiente). Se ha sugerido que debe existir un mecanismo en común que sea el responsable de estos estados patológicos que se presentan a menudo en un mismo individuo. Datos epidemiológicos y clínicos consistentemente han demostrado una asociación entre la resistencia a la insulina y/o hiperinsulinemia y la intolerancia a la glucosa, dislipidemia e hipertensión sistólica.
Las personas seniles son más intolerantes a la glucosa e insulino-resistencia, pero es controversial que esta disminución sea debido al inevitable deterioro fisiológico normal o debido a variables del ambiente o al estilo de vida y de un notable incremento en la alteración de la distribución de las grasas y de la inactividad física. La intolerancia a la glucosa en la senectud puede ser debida en parte a la disminución de la sensibilidad de la insulina de las células beta al estimulo insulinotrópico hormonal intestinal (GLP-1/GIP) y en parte a las alteraciones de la producción de la glucosa hepática14.
Causas endocrinas relacionadas con la senectud _ pérdida ósea y osteoporosis
Mientras en la mujer postmenopáusica se presenta una fase rápida de pérdida ósea en los 6-10 años posteriores a la menopausia, en el hombre se presenta una fase de pérdida ósea lenta y continua que perdura indefinidamente. En el hombre senil hay niveles séricos bajos de estrógenos y testosterona y recientes estudios sugieren que los estrógenos son las principales hormonas sexuales esteroideas que regulan el metabolismo óseo en el hombre. La deficiencia de estrógenos también puede ser la principal causa de pérdida ósea en el hombre senil, como la disminución de la producción de hormona de crecimiento y IGF1 14.
Todos estos cambios en las concentraciones hormonales conllevarían a alteración en los órganos blancos tales como:
Próstata: El producto de la conversión periférica de la testosterona, la dihidrotestosterona, es el principal andrógeno en la glándula prostática produciendo desarrollo y crecimiento de la misma. La duda de si los andrógenos causan cáncer de próstata aún no ha sido aclarada y muchos estudios no han encontrado asociación entre niveles de testosterona y riesgo de cáncer de próstata, observándose diferencias no significativas en los niveles séricos de LH, testosterona total y libre y la globulina transportadora de hormona sexual, SHBG, entre hombres que desarrollaron cáncer de próstata y aquellos que permanecieron libres de la enfermedad. Además en un estudio de pacientes con cáncer de próstata se encontró que los niveles séricos de testosterona por debajo de la línea de base estaban relacionados con peor pronóstico.
Hueso: El hipogonadismo es causa establecida de osteoporosis masculina. Los andrógenos inhiben la expresión de la interleuquina-6, también conocida como factor de activación de los osteoclástos. Los receptores de andrógenos están presentes en los osteoblastos, y los andrógenos estimulan la diferenciación de osteoblastos in útero. Los efectos benéficos de los andrógenos sobre el hueso pueden ser secundarios a su aromatización a estrógenos o a través de los efectos anabólicos de la dihidrotestosterona. Tanto la deficiencia de aromatasas como la mutación del receptor de estrógenos están asociados con osteoporosis en el hombre a pesar de tener niveles normales de andrógenos; además la dihidrotestosterona incrementa la mitogénesis en las células óseas por inducción del mRNA del factor transformante del crecimiento-beta y por aumento de la unión del factor 2 unido a la insulina a los osteoblastos3.
Masa corporal: Los andrógenos son hormonas anabólicas que estimulan la mitosis en los mioblástos por estimulación de la actividad ribosomal y síntesis de RNA polimerasa; la administración de testosterona también produce aumento de la síntesis de proteínas musculares contráctiles y no contráctiles, incremento de las concentraciones musculares de mRNA, IGF-1, y disminución de la grasa abdominal por lipólisis y disminución de la concentración de leptina (hormona de los adipositos) que bloquea la entrada de lípidos a los depósitos de grasa abdominal. La madurez en el hombre se acompaña de disminución en la masa y fuerza muscular e incremento en la grasa corporal asociado con bajos niveles séricos de testosterona. A partir de la cuarta década hay disminución de fuerza muscular de un 8-10% por década y la síntesis de proteínas decrece un 55% con incremento de los depósitos de tejido conectivo y grasa en el músculo, lo cual ocurre paralelamente a la disminución de las concentraciones de testosterona.
Lípidos: Los niveles de colesterol HDL son más bajos en el hombre que en la mujer premenopáusica. La enzima triglicérido-lipasa endotelial hepática, responsable de la aclaración de HDL, es mayor en hombres y estimulada por los andrógenos y suprimida por los estrógenos. Sin embargo, no hay diferencia en los niveles de lipoproteínas y triglicéridos entre niños y niñas prepuberes. En el varón durante la pubertad se disminuyen los niveles de colesterol HDL y se incrementan los de LDL.
Los efectos de la testosterona en la enfermedad arterial coronaria y los lípidos permanece incierta. Los niveles de testosterona se encontraron más bajos en ancianos con enfermedad arterial coronaria que en el grupo control. Además los niveles de testosterona se asocian negativamente con los niveles de triglicéridos y lipoproteínas y positivamente con los niveles de HDL. Los estudios angiográficos han mostrado poca relación entre los niveles de esteroides sexuales y enfermedad arterial coronaria en hombres, la razón para esta discrepancia puede ser que los efectos de la testosterona exógena sobre los lípidos difieren de los de la testosterona endógena o que los andrógenos pueden tener efectos adversos sobre otros factores de riesgo cardiovasculares como las endotelinas3.
Tono vascular: La testosterona puede tener efectos benéficos sobre el tono vascular. Hace más de 50 años Walker mostró que la administración de propionato de testosterona resultaba en reducción de la presión sanguínea, incremento de la circulación cerebral y coronaria, y disminución de los síntomas isquémicos en pacientes con enfermedad vascular periférica. Similarmente, otro estudio mostró que la administración de testosterona disminuye el grado de derivación del segmento ST en hombres con enfermedad cardiaca isquemia. Recientemente se ha demostrado que la testosterona incrementa el diámetro de la arteria coronaria y el flujo sanguíneo coronario. El mecanismo de vasodilatación coronaria todavía no ha sido establecido.
Sistema fibrinolítico: En hombres con enfermedad vascular periférica y baja actividad fibrinolítica la testosterona exógena incrementa la actividad fibrinolítica llevando a la mejoría clínica. El hipogonadismo es también asociado con altos niveles de inhibidor-1 del activador de plasminógeno, inhibiendo el proceso fibrinolítico. La administración de testosterona incrementa la actividad del activador del plasminógeno tisular y disminuyen los niveles de fibrinógeno3.
Hematopoyesis: Los andrógenos estimulan la eritropoyesis por aumento en la producción de eritropoyetina por medio de la transcripción mediada por receptores y por un efecto directo sobre la médula ósea, con incremento en los valores de hemoglobina y hematocrito, proceso que se invierte con la vejez.
Función sexual: La testosterona es necesaria para la libido, función eréctil y eyaculación normal. Los niveles de testosterona bioactiva se correlacionan fuertemente con la tumescencia peneal nocturna, especialmente en hombres de 55 a 64 años de edad, la madurez en el hombre está asociada con disminución en la función eréctil, frecuencia de orgasmos, y un aumento en el período refractario, disminución de la tumescencia y de la respuesta vasocongestiva y en el deseo y placer sexual. Sin embargo hay que recordar que la disfunción eréctil puede tener muchas otras causas.
Función cognoscitiva: Los niveles altos de testosterona están asociados con un mejor control mental y una memoria verbal más duradera, tiene propiedades antidepresivas en hombres hipogonadales. El reemplazo de testosterona mejoró el estado de animo y sensación de bienestar, redujo la ansiedad y mejoró la habilidad de concentración. Además, los niveles de testosterona bioactiva fueron inversamente relacionados con depresión.
Sistema inmune: Algunos han hipotetizado que las enfermedades inmunes son menos comunes en hombres que en mujeres por un efecto protector de los andrógenos. Esto es sustentado por la observación que el hombre con síndrome de Klinefelter tiene una mayor incidencia de enfermedades autoinmunes. El efecto benéfico de los andrógenos parece ser las células supresoras, mientras que el hombre sano tiene una relación alta CD8/CD4 (supresor / ayudador) con respecto a la mujer sana.
La interleuquina-6 es una citoquina que está elevada en el hombre con andropausia y se cree que está relacionada con alguna de las facetas de los síntomas de andropausia; también puede estar asociada con otras enfermedades como osteoporosis y neoplasias. La interleuquina-6 tiene un amplio rango de actividades, especialmente en la fase aguda de la respuesta inflamatoria, inducción de la diferenciación de células B activadas, actividad osteoclástica, proliferación epidérmica, homeostasis, diferenciación y proliferación de células nerviosas y de otras importantes funciones celulares. Normalmente no se detecta interleuquina-6 en un hombre joven sano, los esteroides sexuales parecen controlar el gen de interleuquina-6; los andrógenos inhiben la proteína de expresión de la interleuquina-6. La dihidrotestosterona controla el gen de expresión de la interleuquina-6 por acción dependiente de los receptores de andrógenos. El incremento de los niveles de interleuquina-6 puede llevar además a disminución de la masa corporal, anemia, disminución de la densidad mineral ósea, disminución de la albúmina y demencia (estos cambios han sido moderados por la administración de interleuquina-63).
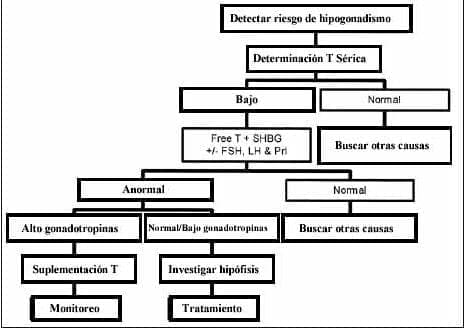
Figura 5. Algoritmo de diagnóstico del Síndrome PADAM.
Factores de riesgo
• Estrés psicosocial (59%)
• Alcohol (35%)
• Agresión u operaciones particularmente vasectomías (32%)
• Medicaciones (31%)
• Cigarrillo (26%)
• Obesidad (35%)
• Infecciones tales como orquitis, paperas y fiebre glandular, prostatitis (11%) y
• Falta de descenso de testículos (5%)
Manifestaciones Clínicas
Signos y Síntomas
Se han clasificados en tres grupos:
Síntomas psicológicos _ Síntomas somatovegetativos y problemas sexuales.
1. Síntomas psicológicos: Desaliento, depresión, irritabilidad, ansiedad y tensión nerviosa. Los pacientes presentan pérdida de la vitalidad y fatiga que esta relacionada con factores sicológicos, así como también disminución de la masa corporal, fuerza muscular y disminución de la orientación espacial.
2. Síntomas somatovegetativos: alteraciones articulares y musculares, oleadas de calor, sudoración, trastornos del sueño, somnolencia e insomnio, alteraciones en el bienestar, disminución en la memoria y capacidad de la concentración, cansancio físico con menores esfuerzos.
3. Problemas sexuales: incluye disminución de la potencia con disfunción eréctil dada por erecciones débiles y de corta duración, disminución de la sensación orgásmica y bajo volumen de eyaculación y disminución de la líbido, también son menos comunes y menos rígidas las erecciones nocturnas y matutinas.
Hay incremento en la grasa corporal y visceral que inducen altamente a riesgos de enfermedad cardiovascular y resistencia a la insulina. El relativo hipoandrogenismo está asociado con pérdida progresiva de la masa ósea que conlleva a osteoporosis y riesgo incrementado de fracturas vertebrales y de cadera. Estas últimas tienen resultados letales en hombres y mujeres.
Diagnóstico
El hipogonadismo bioquímico es detectado solamente en el 7% de los hombres menores de 60% pero se incrementa en el 20% en aquellos mayores de 60 años. Todavía no se ha aceptado que los niveles de testosterona definan la deficiencia hormonal en un hombre maduro aunque, generalmente, es aceptado que dos desviaciones estándar por debajo de los niveles normales para un hombre joven es anormal y también en los hombres maduros pueda haber respuesta variable de los órganos blancos a los niveles de andrógenos. El mejor parámetro para determinar el hipogonadismo es la medición de la testosterona bioactiva la cual incluye las fracciones libres y unida a albúmina. La determinación de testosterona total puede ser errónea por las alteraciones en los niveles de SHBG y del ritmo circadiano mencionado previamente. Si la testosterona está por debajo o en el límite inferior de los niveles normales aceptados, es prudente confirmar los niveles con una segunda determinación acompañada de LH, FSH y prolactina. En el hombre joven los niveles de testosterona menores de 12nmol/ml o 350ng/dl y una elevación crónica de las gonadotropinas marcan un claro diagnóstico de hipogonadismo primario o falla testicular. En el hombre maduro los lineamientos diagnósticos no están claramente definidas y puede ser necesaria una información adicional. Así, en estos hombres como en los obesos, la determinación de SHBG puede ser útil para establecer el verdadero significado clínico de los niveles de testosterona.
Se hace necesario también la realización de exámenes complementarios como medición de la densidad ósea y de la concentración sérica de lípidos, el examen completo de la próstata incluyendo palpación rectal, antígeno prostático específico (PSA) en suero y ultrasonido de próstata.
Si el paciente es hipotiroideo, la L-tiroxina deberá ser reemplazada. Bajos niveles de gonadotropinas indican un hipogonadismo central y una elevación de la prolactina puede indicar la presencia de un tumor hipofisiario3.
Referencias
1. Sternbach Harvey MD Age-Associated Testosterone Decline in Men: Clinical Issues for Psychiatry. The Americam Journal Of Psychiatry 1998; 155: 147.
2. Morales Alvaro Heaton, Jeremy P.W.; Carson, Culley C. III. Andropause: a Misnomer for a True clinical Entity. The Journal of Urology 2000; 163: 325.
3. Basaria Shedzad MD; Dobs, Adrian S MD, MHS, Hipogonadism and Androgen Replacement Therapy in elderly Men, The American Journal of Medicine 2001; 110: 750.
4. Heaton Jeremy P. W. Andropause: coming of age for an old concept? Current Opinión Urology. 2001; 11: 46.
5. Comhaire F: H, Andropause: Hormone Remplacement Therapy in the ageing male. European Urology. 2000; 38: 355-362.
6. Beld Annewieke Van den & Lamberts, S. W. J. Healthy ageing. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
7. Carroll Bernard J. Neuroregulatory hypothesis of ageing. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
8. Björntorp, Per. Alterations in the corticotropic stress response axis. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
9. Handelsman David. J. Male reproductive ageing: human fertility, androgens and hormone dependent disease. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
10. Wang C.; Amiya P., S. H.; Ferrini, M.; et al. Male reproductive ageing: using the Brown Norway rat as a model for human. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
11. Veldhuis J. Ageing of the growth hormone (somatotropic) IGF1 axis. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
12. Effect of growth hormone and IGF1 deficiency on ageing and longevity. Endocrinology & Diabetes Research Unit, Shneider Children’s Medical Center of Israel. Endocrine facets of ageing in the human and experimental animal Simposium 2001; 242, 30 january _ 1 february.
13. Torres-Ruiz A. The role of IGF1 and insulin in ageing and atherosclerosis. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
14. Brabant G. Thyroidal axis in ageing. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
15. Elahi D. Insulin secretion and resistance. Endocrine facets of ageing in the human and experimental animal. Simposium 2001; 242, 30 january _ 1 february.
16. Vermeulen A. Adrogen Replacement Therapy in the Aging Male-A Critical Evaluation The Journal of Clinical Endocrinology & Metabolosm 2001; 80: 1342.
17. Morley John E.; Horace M III. Androgen deficiency in aging men: Role of Testosterone Replacement Therapy. The Journal of Laboratory and Clinical Medicine 2000; 191: 105.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO