Efecto SERM sobre el Hueso
Tamoxifeno (a y b)
El tamoxifeno ha sido usado desde 1972 para el tratamiento de cáncer avanzado de mama14 y más recientemente fue aprobado para la profilaxis de este tumor en pacientes de alto riesgo para la enfermedad.
Durante la última década se ha conocido el efecto benéfico del tamoxifeno sobre el hueso, tanto en pacientes con cáncer de mama15, como en mujeres voluntarias sanas16. El efecto benéfico sobre la columna lumbar fue observado a los 6 meses de terapia, alcanzó el máximo nivel al año y permaneció estable durante 5 años de seguimiento.
Este efecto óseo agonista del tamoxifeno en mujeres posmenopáusicas, contrasta con el efecto antagonista sobre la DMO en el radio, la columna y la cadera en mujeres premenopáusicas17. Se confirma, así, el efecto modulador selectivo del tamoxifeno: agonista en presencia de niveles bajos de estrógenos y antagonista cuando los niveles de estrógeno son altos.
Raloxifeno:
A su vez, el estudio multicéntrico de Pierre Delmas y col.18, realizado en 601 mujeres posmenopáusicas sanas quienes recibieron raloxifeno en dosis diarias de 30, 60 y 150 mg/día durante 24 meses, encontró aumento de la DMO, disminución del recambio óseo y disminución del colesterol sérico total y LDL, sin estímulo sobre el crecimiento endometrial. (Fig. 5)
Figura 5. Promedio de variación porcentual en la DMO en columna lumbar y cuello femoral, en mujeres posmenopáusicas tratadas con raloxifeno durante dos años. Delmas PD y cols. N Engl J Med 1997; 337: 164-7
El raloxifeno también redujo las concentraciones de colesterol total y de LDL en estas pacientes.
El estudio MORE (Múltiple Outcome of Raloxifene Evaluation)
El estudio MORE es un ensayo clínico doble-ciego, placebo-controlado, diseñado para evaluar el efecto de raloxifeno en dosis de 60 y 120 mg/día y de placebo, sobre las fracturas vertebrales. Incluye más de 7000 mujeres con osteoporosis posmenopáusica.
En el estudio MORE se encontró que el riesgo relativo de fracturas vertebrales para las usuarias de raloxifeno, comparado con el del grupo con placebo, fue de 0.48.
Se observó una reducción similar (0.38) para las mujeres quienes habían sufrido fracturas vertebrales múltiples. Después de 24 meses, la DMO en la columna lumbar, aumentó en 2 a 3% y en 1 a 2% en el cuello femoral, en las usuarias de raloxifeno, comparadas con quienes recibían placebo.
Los investigadores concluyen que, en mujeres con osteoporosis, el raloxifeno redujo el riesgo de fracturas vertebrales radiológicas en cerca del 50%. El estudio MORE aún está en desarrollo y evaluará, finalmente, el efecto del raloxifeno después de 36 meses de terapia.
10. Efecto SERM Raloxifeno sobre la mama y el Endometrio
Raloxifeno
La actividad estrógeno-antagonista del raloxifeno sobre la mama y el endometrio, representa una importante fortaleza para su aplicación clínica. En efecto, la inhibición de la actividad celular en ambos tejidos, disminuye el riesgo de cáncer del endometrio y de la masa y minimiza el sangrado vaginal, causas muy importantes para el abandono de la THS.
El efecto antagonista total del raloxifeno sobre el endometrio ha sido descrito en ratas, por Fuchs-Young y col.19 y en humanos por Delmas y col, en el estudio previamente citado.18 (Fig. 6)
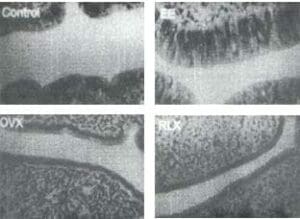
Figura 6. Aspecto del endometrio en ratas ovariectomizadas (OVX) bajo tratamiento con estradiol (EE) o raloxifeno (RLX), comparado con el grupo control.
Tomados de: Fuchs-Young R y cols. Acad Sci, 1995;761:355-60
En el estudio MORE, una dosis de 60 mg/día de raloxifeno, no produjo estimulación ni engrosamiento del endometrio. Igualmente, el estudio MORE mostró una disminución significante (70%) de los casos nuevos de cáncer de mama en usuarias de raloxifeno, razón por la cual el Instituto Nacional del Cáncer de los Estados Unidos, está evaluando actualmente la efectividad comparativa del raloxifeno y del tamoxifeno para disminuir tal patología. Estudio STAR. (Study of Tamoxifen and Raloxifen).
Tamoxifeno
En un estudio clínico realizado en 1996, Fisher20 demostró que el tamoxifeno es eficaz para prevenir el cáncer de mama. En ese trabajo, la disminución de cáncer de mama fue, en total, del 45% y aún mayor en las usuarias de más de 60 años. El aumento de la incidencia en el grupo placebo, fue del 100%. El tamoxifeno fue eficaz sólo en mujeres portadoras de tumores RE-positivos. En contraste con estos efectos benéficos sobre la mama, el riesgo de cáncer de endometrio fue dos veces mayor.
El estímulo endometrial por tamoxifeno fue descrito en la segunda mitad de la década de los 80 en diversos trabajos. Neven y col.21, siguieron 16 pacientes durante 36 meses con histeroscopia. Sólo 8 conservaron el endometrio atrófico. Hubo una incidencia de carcinoma de 6% y 25% de formación de pólipos. Gal y col.22, encontraron 18% de hiperplasia en 38 pacientes quienes tomaron tamoxifeno durante 12 meses. Más recientemente, Schwartz y col.23, encontraron una incidencia de 30% de pólipos, 4% de carcinoma y 13% de proliferación o hiperplasia.
Actualmente se realizan ensayos clínicos para contrarrestar el efecto estimulante del tamoxifeno sobre el endometrio mediante el empleo simultáneo de progestágenos.24.
11. Efecto serm sobre el Sistema Nervioso Central
Estudios recientes demuestran el efecto protector cerebral de la terapia de reemplazo hormonal y la posibilidad de que los estrógenos actúen favorablemente sobre la función cognoscitiva y prevengan la enfermedad de Alzheimer, hasta en el 69% de los casos25- 27.
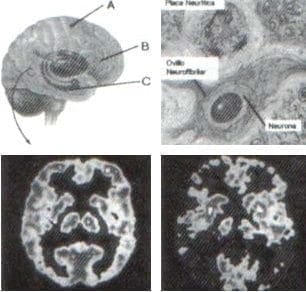
La enfermedad de Alzheimer afecta células nerviosas en diversas regiones del cerebro: A, la corteza cerebral, involucrada en el pensamiento consciente y en el lenguaje. B, el cerebro basal anterior, en donde existen numerosas neuronas con acetilcolina, importante para la memoria y el aprendizaje. C, el hipocampo, esencial para el almacenamiento de la memoria. Los síntomas más tempranos de enfermedad de Alzheimer se encuentran en la corteza entorrinal (Rinoencéfalo).
Figura 7. Tomado de: Cambios cerebrales en la enfermedad de Alzheimer.
Hallazgos típicos en la enfermedad de Alzheimer incluyen placas neuríticas (fuera de las neuronas) y ovillos neurofibrilares (dentro de las neuronas).
La tomografía de emisión de protones (PET) muestra la actividad cerebral normal (izquierda) y en la enfermedad de Alzheimer (derecha) Las zonas azules y negras son inactivas.
La aparición de oleadas de calor en mujeres usuarias de tres de los más conocidos SERM (tamoxifeno, raloxifeno y toremifeno), sugieren una acción SERM antagonista sobre el sistema nervioso central. Como contraste, entre los efectos benéficos más citados de los estrógenos, estan el aumento en el crecimiento de las neuritas (axones)28, el aumento del consumo de glucosa por el cerebro, la prevención de la formación de placas amiloideas y el efecto antioxidante sobre el tejido nervioso.
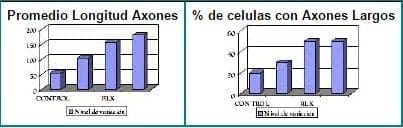
Figura 8. Porcentaje de crecimiento de células con axones largos y de longitud promedio de los axones.
Tomado de: Nilsen J y cols. Menopause, 1998;5:211-6
Estudios más recientes, han demostrado la capacidad de raloxifeno para promover, también, el crecimiento de las neuritas en medios de cultivo29, en forma similar a como lo hacen los estrógenos. (Fig. 8 y 9). Aún quedan por demostrarse efectos similares en humanos. El mecanismo de acción de raloxifeno sobre el SNC aún no está claro, pero estos hallazgos plantean la posibilidad de emplear raloxifeno para la prevención de la enfermedad de Alzheimer y del ACV en el futuro.
Figura 9. Crecimiento de axones de células PC 12 en medios de cultivo sin esteroides (a), con estradiol (b) y con raloxifeno (c).
Tomado de: Nilsen J. y cols. Menopause,1998;5:211-6
12. Efecto SERM de los Fitoestrógenos
De especial interés se consideran actualmente los fitoestrógenos, compuestos no esteroideos, derivados de plantas y con capacidad de efecto SERM.
Según Kuiper, descubridor del REb, “mientras que la potencia estrogénica de los derivados de químicos industriales, p. ej., el[3H]17b-estradiol, es muy limitada, la potencia estrogénica de los fitoestrógenos, p.ej., la genisteína, es muy significante, especialmente para REb y pueden desencadenar muchas de las respuestas biológicas características de los estrógenos fisiológicos”30.
Otros fitoestrógenos, como el coumesterol, pueden, también, ser modificados para desarrollar efectos tipo SERM31.
La tabla 3 resume el efecto agonista/antagonista de diversos compuestos con efecto SERM potencial, sobre diferentes tejidos.
Tabla 3. Efecto estrogénico agonista/antagonista de THR, raloxifeno,
tamoxifeno y fitoestrógenos sobre diferentes tejidos
Agon = agonista Antag = antagonista
* Aislados de la soya (isoflavones) Adaptada de Kuiper GG. Endrocrinol 1997; 138:863-70
13. El perfil de la mujer en Postmenopausia
Finalmente, es muy importante destacar la necesidad de establecer criterios claros para lograr la individualización de la terapia preventiva y supresiva de los efectos del hipoestrogenismo en la mujer postmenopáusica, de acuerdo con su propio perfil clínico.
En un trabajo reciente, Col y col[32] encontraron que THS, el alendronato raloxifeno tienen la misma eficacia predictiva en la prevención de fracturas de cadera (RR estimado: 0.57, 0.54 y 0.58, respectivamente). A su vez, la THS puede ser hasta 10 veces más eficaz que raloxifeno para la prevención de la enfermedad coronaria, pero el raloxifeno probablemente no induce el cáncer de mama. Según los autores, las mujeres con riesgo bajo de fractura de cadera, enfermedad coronaria y cáncer de mama, no se benefician significativamente con ninguna de tales terapias.
Entre las mujeres con riesgo promedio, se prefirió la THS, a menos que se pretendiera una reducción del 66% en cáncer de mama con raloxifeno, comparada con un aumento de 47% con THS. Mujeres con riesgo alto para enfermedad coronaria, se benefician más con THS y las mujeres con riesgo alto para cáncer de mama y/o endometrio, pero bajo para enfermedad coronaria, se benefician más con raloxifeno, pero sólo si se reduce el riesgo de cáncer de mama y de endometrio.
Las diferencias significantes en las respuestas de los principales compuestos empleados, deben tenerse en cuenta para la elección del tratamiento, con base en el riesgo individual de cada mujer para fractura de cadera, enfermedad coronaria y cáncer de mama.
14. Resumen y conclusiones
-
- Los SERM constituyen un grupo de compuestos nuevos, cuya principal característica común es la de comportarse como ligandos específicos de alta afinidad por los receptores estrogénicos conocidos (REa y b).
- El reciente descubrimiento del RE b ha facilitado el desarrollo de nuevos SERM.
- El mecanismo íntimo de la actividad ligando-receptor estrogénico, es aún desconocido.
- A diferencia de los estrógenos, los SERM se comportan como agonistas o antagonistas estrogénicos, según el tipo de célula blanco.
- Los SERM más estudiados hasta ahora, tamoxifeno, raloxifeno y toremifeno, tienen acción selectiva agonista/antagonista diferente sobre diversos tejidos.
- Hasta ahora, el efecto estrogénico agonista de la THS sobre la mama, el sistema nervioso central, el sistema óseo, el endometrio, el sistema mucocutáneo y los lípidos séricos, es mayor que el de los SERM.
- Los SERM tamoxifeno y raloxifeno, tienen marcado efecto antagonista sobre la mama.
- A diferencia de tamoxifeno y THR el raloxifeno tiene marcado efecto antagonista sobre el endometrio.
- Aún se requieren estudios clínicos controlados para establecer el efecto de los SERM sobre el sistema nervioso central, el tracto genitourinario y el sistema mucocutáneo, entre otros.
- El perfil de riesgo para enfermedades como el cáncer de mama y de endometrio, la osteoporosis, la enfermedad cardiovascular y la enfermedad de Alzheimer, debe ser definido en cada paciente, con el fin de prescribir la mejor terapia de suplencia durante la posmenopausia, según las alternativas disponibles.
- Se deben seguir con interés los importantes avances en el campo de los fitoestrógenos y su efecto SERM.
- Los SERM representan, actualmente, muy buena alternativa para el tratamiento de aspectos específicos del cuadro climaterio-menopausia y una muy prometedora perspectiva para su manejo en el inmediato futuro.
Referencias
1. Brett KM, Madans JH: Use of postmenopausal hormone replacement therapy: Estimates from a nationally representative cohort study. Am J Epidemiol 1997; 145: 536-545
2. Love RR, Mazess RB, Barden HS, et al: Effects of tamoxifen on bone mineral density in postmenopausal women with breast cancer. N Engl J Med 1992; 326: 852-856
3. Love RR, Newcomb PA, Wieve DA, et al:Effects of tamoxifen therapy on lipid and lipoprotein levels in postmenopausal patients with node-negative breast cancer. J Nat Cancer Inst 1990; 822: 1327-1332.
4. Kuiper GGJM, Enmark E, Pelto-Huikko M, Nilsson G.Cloning of a novel estrogen receptor expressed in rat prostate and ovary. Proc Nat Acad Sci USA 1996; 93: 5925-5930
5. Mosselman S, Polman J, Dijkema R:Erb identification and characterization of a novel human estrogen receptor. FEBS Lett 1996; 392: 49-53
6. Walsh BW, Kuller LH, Wild RA et al.Effects of Raloxifene on serum lipids and coagulation factors in healthy postmenopausal women. JAMA, 279(18): 1445-14517
7. Grey AB, Stapleton JP, Evans MC.The effect of the anti-estrogen Tamoxifen on cardiovascular risk factors in normal postmenopausal women. J Clin Endocrinol Metab. 1995;80:3191-3195
8. Shewmon DA, Stock JL, Rosen CJ, et al.Tamoxifen and estrogen lower circulating lipoprotein(a) concentrations in healthy postmenopausal women. Arterioscler Thromb. 1994; 14: 1586-1593
9. Mannucci PM, Bettega D. Chantarangkul V, et al.Effects of Tamoxifen on measurements of hemostasis in healthy postmenopausal women. Arch Intern Med. 1996; 156: 1806-1810
10. Davies GC, Huster WJ, Lu Y et al.Adverse Events Reported by Postmenopausal Women in Controlled Trials with Raloxifene. Obstet Gynecol; 1999; 93: 558-65
Bibliografía
11. The Writing Group for the PEPI Trial: Effects of estrogen or estrogen/progestin regimens on heart disease risk factors in postmenopausal women: the postmenopausal estrogen/progestin intervention (PEPI) trial. JAMA 1995; 273: 199-208
12. Grady D, Rubin SM, Petitti DB, et al.Hormone therapy to prevent disease and prolong life in a post-menopausal woman. Ann Intern Medd 1992; 117: 1016-1037
13. Draper MW, et al: A controlled trial of Raloxifene (LY139481)HCI:impact on bone turnover and serum lipid profile in healthy postmenopausal women, J Bone Miner Res 1996; 11: 835-842
14. Cole MP, Jones CT, Todd ID: A new anti-estrogrnic agent in late breast cancer. An early clinical appraisal of ICI46474. Br J Cancer 1971; 25: 270-275
15. Kristensen B, Ejkertsen B, Dalgaard P et al: Tamoxifen and bone metabolism in postmenopausal low-risk breast cancer patients; a randomized study. J Clin Oncol 1994; 12: 992
16. Grey AB, Stapleton JP, Evans MC et al: The effect of the antiestrogen Tamoxifen on bone mineral density in normal late postmenopausal women. Am J Med 1995; 99: 636-641
17. Powles TJ, Hickish T, Kanis JA et al:Effect of Tamoxifen on bone mineral density measured by dual-energy x-ray absortiometry in healthy premenopausal and postmenopausal women. J Clin Oncol 1996; 14: 78-84
18. Delmas PD, Bjarnason NH, Mitlak BH et al.Effects of Raloxifene on bone mineal density, serum cholesterol concentrations and uterine endometrium in posmenopausal women. N Engl J Med 1997; 337: 1641-1647 Dec 4
19. Fuchs.Young R, Glasebrook AL, Draper MW et al. Raloxifene is a tissue-selective agonist/antagonist that functions through the estrogen receptor. Ann N Y Acad Sci 1995; 761: 355-60
Fuentes
20. Fisher B, Dignam J, Bryant J et al.Five versus more than five years of Tamoxifen therapy for breast cancer patients with negative lymph nodes and estrogen-receptor positive tumors. J Natl Cancer Inst 1996; 88: 1529-1542
21. Neven P, Muylder X, Van Belle Y et al.Hysteroscopy Follow-up during Tamoxifen treatment. Eur J Obstet Gynecol Reprod Biol 1990; 35: 235-8
22. Gal D, Kopel S, Bashevkin M et al.Oncogenic potential of Tamoxifen on endometria of posmenopausal women with breast cancer-preliminary report. Gynecol Oncol 1991; 42: 120-3
23. Schwartz LB, Snyder J, Goldstein SR et al.The use of transvaginal ultrasound and saline infusion sonohysterography for the evaluation of asymptomatic postmenopausal breast cancer on tamoxifen. Ultrasound Obstet Gynecol 1997; 10: 1-6
24. Cohen I. Altaras MM, Beyth Y et al.Estrogen and progesterone receptors in the endometrium of postmenopausal breast cancer patients treate with Tamoxifeb and progestins. Gynecol Oncol 1997 April; 65(1): 83-8
25. Sherwin BB.Estrogen and cognitive functioning in women. Proc Soc Exp Biol Med 1998; 217: 17-22
26. Paganini-Hill A, Henderson WW.Estrogen deficiency and risk of Alzheimer´s Disease in women. Am J Epidemiol 1994; 140: 256-61
27. Tang MX, Jacobs D, Stern Y et al.Effect of estrogen during menopause on risk and age at onset of Alzheimer´s Disease. Lancet 1996; 348: 429-32
28. Díaz H, Lorenzo A, Carrer HF et al. Time lapse study of neurite growth in hypothalamic dissoaciated neurons in culture: sex differences and estrogen effectss. J Neurosci Res 1992; 33: 266-81
29. Nilsen J, More G, Naftolin F.Raloxifene induces neurite outgrowth in estrogen receptor positive PC cells. Menopause 1998; 5: 211-16
Referencias Bibliográficas
30. Kuiper GG, Lemmen JG, Carlson B et al.Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta. Endocrinol 1998, Oct, 139; 10: 4252-63
31. Grese TA, Cole HW, Magee DE et al.Conversión of the phytoestrogen into a Selective Estrogen Receptor Modulator (SERM) by attachement of an amine-containing side chain. Bioorg Med Chem Lett 1996; 6: 2683-6
32. Col, NF, Pauker SG, Goldberg RJ et al.Individualizing therapy to prevent long term consequences of estrogen deficiency in postmenopausal women. Arch Intern Med 1999, Jul 12; 159(13): 1458-66



CLIC AQUÍ Y DÉJANOS TU COMENTARIO