Apreciación clínica del Women’s Health Initiative
Actualidad Inmediata
Leon Speroff**
J. Obstet. Gynaecol. Res. April 2005; (31)2: 80–93.
* Traducción del inglés: Gustavo Gómez Tabares
** Department of Obstetrics and Gynecology, Oregon Health Sciences University, Portland Oregon. Oregon 97239, USA. Email:
lsperoff@msn.com
Nota del Editor
En nuestro concepto, esta es la contribución más clara acerca de la terapia hormonal y su lugar en el manejo de la mujer perimenopáusica, luego de todos los ires y venires del tema después de los reportes del WHI.
Introducción
El Women’s Health Initiative (WHI) fue organizado por la National Institute of Health (NIH) de los EUA en 1972 para estudiar la salud de mujeres postmenopáusicas y se programó para concluir en 2007. De 1993 a 1998, el WHI reclutó 161 809 mujeres entre 50 y 79 años en 40 centros clínicos. Los mayores componentes del WHI son:
1. Dos ensayos randomizados de terapia hormonal postmenopáusica programado para concluir en el 20052; un ensayo dietario modificado que randomiza 48.000 mujeres a una dieta sostenida baja en grasas autodeterminada3; un ensayo de suplementación con calcio/vitamina D4; un estudio observacional. Uno de los ensayos randomizados de terapia hormonal postmenopáusica, el brazo de estrógenos-progestágenos (0.625 mg/día de EEC combinados con 2.5 mg/día de acetato de medroxiprogesterona), randomizó 16.608 mujeres a tratamiento o a placebo. El otro ensayo hormonal, un brazo de solo estrógenos (0.625 mg/día de EEC), randomizó 10 739 mujeres histerectomizadas a tratamiento o placebo.
2. En Mayo 31 del 2002, el Comité de Seguridad (Data and Safety Monitoring Board – DSMB) hizo su revisión periódica de los datos acumulados por el WHI. La DSMB hizo dos recomendaciones que se anunciaron en Julio 9 del 2002: 1. descontinuar el brazo del ensayo con la administración diaria de estrógenos-progestinas; y 2. continuar el brazo comparando las dosis diarias de estrógenos sin oposición en pacientes histerectomizadas. El brazo de estrógenos y progestinas combinados fue descontinuado después de aproximadamente 5 años de seguimiento por el aumento estadísticamente significativo de cáncer invasivo de mama y un aumento en los eventos cardiovasculares2.
3. Los parámetros estadísticos para beneficio o daño se establecieron al principio del estudio en 1997. Cuando el aumento en el cáncer de mama excedió el dato predeterminado, la DMSB fue obligada a recomendar la suspensión de este brazo del estudio.
4. En Marzo 2 del 2004, el Nacional Heart, Lung and Blood Institute del National Institute of Health (NIH) de los EE UU canceló el brazo de solo estrógenos (0.625 mg de EEC diarios) del WHI. Este brazo del WHI incluyó 10 739 mujeres postmenopáusicas histerectomizadas quienes habían completado un promedio de 6.8 años de seguimiento. El DMSB del WHI hizo su última revisión periódica de los datos del estudio en Diciembre del 2003. La DMSB no fue unánime en su decisión, algunos querían parar el estudio y otros querían que el estudio continuara después de mandar una carta a las participantes describiendo los hallazgos. Aunque ninguno de los hallazgos había cruzado los límites predefinidos de riesgo, la NIH tomó la decisión de parar el estudio en Febrero 2 del 2004.
La decisión fue basada en los siguientes resultados:
• Un aumento del riesgo de ACV similar al reportado en el brazo estrógenosprogestinas cancelado del WHI; no aumento ni disminución en enfermedad cardiaca coronaria.
• Tendencia hacia el aumento de riesgo de probable demencia y/o trastorno cognitivo leve.
• Reducción en las fracturas de cadera.
• No aumentó el cáncer de mama.
En los primeros meses después de la publicación de los resultados del WHI, parece que hubo una gran reluctancia al análisis crítico de los datos.
Se aceptó ampliamente al principio que el WHI estaba en desacuerdo con más de 20 años de investigación, y que las noticias eran alarmantes e inmensamente importantes. Pero a medida que los meses pasaban, una evaluación más cuidadosa ha llevado a una conclusión más lógica.
Evaluación clínica del WHI
Los resultados publicados del estudio WHI están de acuerdo con más de 20 años de datos de casos-controles y cohortes, con la excepción de los datos cardiovasculares. La pregunta clínica crítica es la siguiente: ¿el leve aumento de los eventos cardiovasculares es real o hay otras explicaciones para los resultados reportados?
Esta es una pregunta muy importante porque el aumento reportado no fue muy grande y su desvío en un pequeño número de casos puede cambiar las conclusiones.
El WHI y la enfermedad Cardiovascular
Los resultados actualizados del riesgo de enfermedad cardiaca coronaria (ECC) del brazo cancelado de estrógenos- progestinas del WHI refleja la adjudicación central del diagnóstico cardiaco, en contraste con el reporte inicial que descansó en el diagnostico local4. La adjudicación central está en desacuerdo con el 10% de los diagnósticos de infarto del miocardio, y 3% de muerte por ECC. Este pequeño grado de desacuerdo cambió la fuerza de las conclusiones comparando el reporte inicial2 con el reporte actualizado. Indudablemente los resultados globales por definición no alcanzan significancia estadística en el reporte de seguimiento, y solamente los resultados del primer año fueron estadísticamente significantes en el análisis de año por año, una conclusión basada en una diferencia de solo 9 casos. Las características de las participantes ahora se conocen bien (tabla 1).
Tabla 1. Características de las participantes (Women’s Health Initiative study) en el brazo de Estrógenos-progestinas y en brazo de Estrógenos solos
Las mujeres en el brazo de estrógenosprogestinas estaban en un promedio de 18 años después de la menopausia, y parece que las mismas características estuvieron presentes en el brazo de solo estrógenos puesto que los rangos de edad fueron similares3. Las mujeres con síntomas menopáusicos significantes fueron excluidas del estudio para evitar un alto abandono del estudio en el grupo placebo.
Las mujeres que habían recibido terapia hormonal (aproximadamente el 25% del grupo de estrógenos-progestinas y 35% en el brazo de solo estrógenos) y que pasaron a un periodo de “lavado” de 3 meses y experimentaron síntomas menopáusicos se descartaron de participar (cerca del 12.5% de las participantes en el brazo de estrógenos-progestinas reportaron síntomas vasomotores al entrar, pero estaban dispuestas a entrar al grupo placebo, y por lo tanto sus síntomas no parecían ser de efecto de disturbio mayor).
Esta exclusión significa que solo un pequeño número de mujeres en el WHI estaban cerca de su edad de menopausia (aproximadamente 16.5% de las participantes en el grupo estrógenos-progestinas fueron menos de 5 años desde su menopausia). Por ejemplo, hubo un total de 574 mujeres, quienes estaban entre 50-54 años en el grupo de estrógenosprogestinas5.
Durante el tiempo del estudio, las participantes descontinuaron su medicación a una tasa aumentada sostenida, así que al final la mitad no seguían en el tratamiento. Los investigadores del WHI arguyen que la alta tasa de abandono puede llevar a una subestimación de los efectos adversos; sin embargo, este podría no ser el caso si una duración mayor de tratamiento ejerce un efecto benéfico. Por ejemplo, un estudio de casos y controles en el Reino Unido encontró una reducción significativa en el riesgo de infarto de miocardio solamente con el uso de terapia hormonal por más de 5 años6.
Indudablemente, la tendencia para una emergente protección contra la ECV con el aumento de duración del tratamiento se observó en ambos brazos del WHI. El análisis de las submuestras en el WHI reveló que el grupo tratado tenía reducciones mayores en el colesterol total, glucosa y niveles de insulina y mayor aumento de lipoproteínas de alta densidad y triglicéridos. Es tentativo relacionar estos hallazgos con él para tendencia que reveló una favorable disminución del RR en el tiempo, lo cual fue estadísticamente significante.
Sin embargo, este análisis fue dificultado por la disminución de los numerados en el tiempo y la conclusión no fue tan fuerte.
En el análisis de subgrupos, solamente las mujeres que estaban veinte o más años por encima de la menopausia tenían un significativo aumento del riesgo de ECV (1.71 IC 95% 1.20-2.50); sacando este grupo del resto de las participantes, se observó que la ECV prevalecía de manera idéntica cuando se comparó con los grupos de tratamiento y placebo. No es apropiado concluir que, basado en el WHI, la terapia hormonal aumenta el riesgo de eventos clínicos coronarios en todas las mujeres posmenopáusicas; esta conclusión solo se puede aplicar a un grupo específico de mujeres de edad mayor. Indudablemente los datos del brazo de solo estrógenos sugirieron que las mujeres más jóvenes experimentaron una reducción del riesgo de ECV con el uso de solo estrógenos3.
El WHI concluyó que la terapia hormonal no es una intervención viable para prevención primaria, basando esta conclusión en los resultados globales del WHI incluyendo la enfermedad cardiaca coronaria. Esto no es para decir que la prevención primaria de ECV no amerite controversia. Sin embargo, al mismo tiempo, el asunto no está establecido. ¿Se podría iniciar la terapia hormonal temprano después de la menopausia y mantenerse por un tiempo relativamente largo, para proveer protección de ECC (prevención primaria)?
El diseño del brazo cancelado del WHI no nos permite una respuesta a esta pregunta. Como se dijo previamente, las mujeres con síntomas menopáusicos significantes se excluyeron del estudio para evitar un exceso de abandono en el grupo placebo. El WHI enfocó este problema puntualizando que las relaciones de eventos cardiovasculares en el grupo tratado y en el placebo fueron los mismos cuando se midió usando grupos de edad en las décadas 50, 60, y 70. Sin embargo, este no fue el análisis crítico. Al excluir las mujeres con síntomas menopáusicos, es muy posible que un pequeño número de participantes estuvieran cerca de su edad de menopausia (solo 574 en los grupos de tratamiento y placebo estaban entre 50 y 54 años, y parece que aun estas mujeres estaban relativamente distantes de su menopausia).
Hasta que los datos sean analizados de acuerdo a los años de menopausia, los resultados cardiovasculares del WHI no pueden ser vistos como el producto de un ensayo de prevención primaria. Aun con el análisis apropiado de acuerdo a los años de menopausia, los resultados parecen estar limitados por el muy pequeño número de mujeres en su menopausia temprana.
Además, las altas tasas de abandono en esos ensayos clínicos erogan el poder estadístico para las mediciones anuales con tratamientos nuevos con estatinas o aspirina.
Hay un pequeño estudio de prevención primaria de 199 mujeres postmenopáusicas sanas aleatorizadas a una dosis diaria de 1 mg de estradiol o placebo y seguimiento por 2 años, durante el cual el cambio del espesor de la intima de la carótida se midió usando ultrasonido7.
Las mujeres que recibieron estradiol tenían una pequeña disminución en el grosor de la intima, en contraste con un marcado aumento en el grupo placebo. De forma interesante, no hubo diferencia entren las pacientes que estaban tomando antilipídicos y las que estaban tomando estrógenos o placebo (ambos grupos tenían una disminución pequeña en el grosor), indicando que las drogas antilipídicas y los estrógenos tienen unos efectos benéficos similares en la arteriosclerosis que no son aditivos. Ha habido otros dos estudios similares con ultrasonografía. Un estudio alemán de dos años no alcanzó diferencias significantes comparando los tratamientos con placebo, pero los resultados fueron influidos por una tasa alta de abandono y problemas con el seguimiento8.
Otro estudio alemán no encontró efecto de la terapia hormonal en mujeres que ya tenían aumento del grosor al reclutarse al estudio, y la duración de éste fue de solo un año9.
El WHI y ACV
El WHI informó de un aumento global en el brazo de estrógenos progestinas del ACV isquémico (1.44; IC 1.09-1.90), pero no unaumento en los ACV fatales2,10. El aumento en los ACV no fatales en el grupo de solo estrógenosen el WHI fue de magnitud similar (1.39; IC 1.05-1.84)3. Como el brazo de estrógenosprogestinas en el WHI, es razonable esperar los resultados de ACV en el grupo de solo estrógenos que refleje la dosis de éstos dada a un grupo de mujeres más viejas, muchos años distantes de la edad de menopausia. El grupo de solo estrógenos contenía más mujeres obesas con enfermedad cardiovascular preexistente; ¿fueron los resultados de ACV en mujeres muy mayores con enfermedad preexistente?
Estudios de Prevención Secundaria
El estudio de reemplazo estrogénico y ateroesclerosis (ERA) junta el corazón y el reemplazo estrógenos-progestinas (HERS) demostrando no efecto preventivo secundario de la terapia hormonal postmenopáusica en mujeres viejas con ECV significante11,12. Comparando los dos estudios, sin embargo, hay unaobservación importante. El estudio ERA contenía un brazo de solo estrógenos, y la ausencia de diferencia de efecto negativo entre el brazo de solo estrógenos y el de estrógenos- progestina es un argumento en contra de un efecto negativo debido a la administración diaria de acetato de medroxiprogesterona.
Al menos 3 estudios de prevención secundaria de ECV en mujeres fallan en demostrar un impacto benéfico de la terapia hormonal13,15.
Estos estudios midieron estrógenos orales conjugados, valerato de estradiol y estradiol transdérmico combinados con acetato de medroxprogesterona o noretindrona. Los resultados de los estudios de prevención secundaria en mujeres mayores con enfermedad cardiovascular establecida son uniformemente consistentes en no hallar efectos benéficos de la terapia hormonal y los datos indican que los diferentes estrógenos con los diferentes progestágenos se comportan de forma similar.
Trombosis Venosa
Resultados de múltiples estudios indican que la terapia hormonal postmenopáusica aumenta el riesgo de trombo embolismo en aproximadamente el doble, principalmente en el primer o segundo año de tratamiento, una conclusión apoyada por los resultados reportados por el brazo de estrógenos-progestágenos cancelado del WHI2.
En el brazo de estrógenos solos del WHI, se observó un pequeño aumento en la trombosis profunda (1.47; IC 1.04-2.08) y un aumento de trombo-embolismo pulmonar que no fue estadísticamente significativo (1.34; IC 0.87-2.06)3. Este es un riesgo que se reduce con el uso de estátinas y bajas dosis de aspirina16, aunque no se sabe si las estátinas y la aspirina podrían proteger completamente contra el aumento de riesgo asociado con la terapia hormonal. Podría Podría enfatizarse que el riesgo parece aplicarse solamente a quienes comienzan la terapia de hormonas; las mujeres que han estado en terapia hormonal pueden estar seguras de que el aumento de riesgo de trombosis venosa se concentra en los primeros 1-2 años de tratamiento.
El riesgo actual es muy bajo por la baja frecuencia de este evento. Si el riesgo relativo se aumentó dos veces, se podría aumentar la incidencia de trombo-embolismo venoso en aproximadamente dos casos por 10.000 mujeres por año con el uso de hormonas.
Además la trombosis venosa lleva un muy bajo riesgo de mortalidad, aproximadamente 1%, y la mayoría de los casos fatales seguidos de trombosis venosa están asociados con trauma, cirugía o enfermedades mayores. Los clínicos han argumentado que la administración transdérmica de estrógenos es más segura con relación al riesgo de tromboembolismo venoso, considerando el efecto del primer paso hepático de los estrógenos como un factor importante en el impacto protrombótico de los estrógenos. Por ejemplo, se ha reportado que la administración oral de estrógenos comparada con la administración transdérmica en transexuales hombre a mujeres se asoció con un estado protrombótico mayor y riesgo de trombosis venosa; sin embargo, este efecto podría ser, al menos parcialmente, atribuido a la mayor diferencia en la dosis de estrógeno17. Podría ser mejor tener evidencia independiente de la dosis, y para este propósito, podemos considerar la respuesta de la resistencia de la proteína C activada, reconocida como un marcador de riesgo de trombosis venosa. En un estudio aleatorizado, el tratamiento con estrógenos orales aumenta la resistencia de la proteína C activada, pero los transdérmicos no fueron diferentes al placebo18.
Otro estudio aleatorizado encontró que ambas rutas de administración aumentaron la resistencia de la proteína C activada; sin embargo, el aumento con estrógenos orales fue aproximadamente cuatro veces mayor que el de los transdérmicos19. Un estudio francés de casoscontroles concluyó que había un aumento de cuatro veces en trombo-embolismo venoso con el uso actual de estrógenos orales pero no había aumento de riesgo con estrógenos transdérmicos20. La evidencia ahora apoya, por lo tanto, la idea que los estrógenos administrados transdérmicos no tienen el mismo riesgo de trombo-embolismo venoso que lo reportado con los estrógenos orales.
Enfermedad Cardiovascular. Conclusión
El WHI concluye (lo mismo que muchos individuos y organizaciones) que la terapia hormonal no es una intervención viable para prevención primaria de ECV. No podemos reñir con la conclusión de que la terapia hormonal postmenopáusica no reduce o disminuye la progresión de la ECV establecida. Sin embargo, el WHI no estudió la población adecuada en el periodo de tiempo apropiado para establecer que la terapia hormonal no ejerce un efecto preventivo primario sobre el riesgo de ECV.
Los resultados de los estudios sobre prevención secundaria proveen unas sólidas bases para razonablemente no recomendar la terapia hormonal postmenopáusica para mujeres con arteriosclerosis existente, con la anticipación de prevenir eventos cardiovasculares futuros. Los resultados también indican que no hay necesidad de evitar el uso de acetato de medroxiprogesterona, porque no se han visto diferencias en mujeres tratadas con solo estrógenos comparadas con las de estrógenos y progestinas.
Los resultados cardiovasculares en los últimos años hacen emerger otro tema. Ese tema es: Se necesita un endotelio sano para responder a los estrógenos. Evidencia experimental en el mono indica que el efecto benéfico del tratamiento hormonal disminuye progresivamente con el aumento de la arteriosclerosis21. En mujeres posmenopáusicas, el efecto vasodilatador de los estrógenos se disipa con el aumento de edad22. En el tiempo, el endotelio está relacionado con la arteriosclerosis, y es muy tarde para que los estrógenos ejerzan un efecto benéfico. Los reportes de los ensayos clínicos hacen el argumento de que el enfoque óptimo de la terapia hormonal posmenopáusica es comenzarla cerca de la menopausia, evitando un periodo prolongado de exposición a bajos niveles estrogénicos antes de comenzar la terapia. Y continúa siendo una buena razón (una combinación de datos biológicos y un acuerdo uniforme en un gran número de estudios de observación) creer que la terapia hormonal puede tener un papel benéfico en la prevención primaria de ECV.
Cáncer de mama
Por más de una década hemos estado enseñando que la falta de uniformidad en más de 60 estudios caso-control y de cohorte sobre cáncer de mama y terapia hormonal posmenopáusica significa que cualquier efecto debe ser pequeño. Los resultados del WHI no cambian esa enseñanza.
La más importante pregunta sin respuesta es si la terapia hormonal posmenopáusica inicia el crecimiento de nuevos cánceres de mama o si los resultados epidemiológicos reflejan un impacto de tumores preexistentes. Observaciones que favorecen un impacto de tumores pre-existentes incluyen: (I) en los estudios que reportan un aumento del riesgo, la evidencia es aparente y relativamente rápida, dentro de pocos años; (II) el retorno a riesgos de peligro en el WHI, brazo de estrógenosprogestinas casi a 1.0 en el año6, y en los datos observacionales, un retorno a la línea de base inmediatamente después de descontinuar la terapia; (III) no hay diferencias en el cáncer de mama invasivo en los brazos de tratamiento y placebo del WHI; y (IV) la gran cantidad de literatura que documenta bajo grado y estado de la enfermedad en las usuarias de hormonas, da como resultado una mayor tasa de supervivencia.
El WHI está de acuerdo con la evidencia convincente en la literatura de que la terapia hormonal postmenopáusica no aumenta el riesgo de cáncer de mama más allá que los ya reconocidos factores de riesgo, tales como una historia familiar positiva23. El reporte actualizado del WHI sobre cáncer de mama en el brazo estrógenos-progestinas resultó en pocos cambios en los riesgos de peligro publicados en el reporte inicial24. El cáncer invasivo se aumentó, 199 casos en el grupo de tratamiento y 150 en el grupo placebo(1.24; IC 1.01-1.54). Sin embargo los carcinomas in situ se aumentaron solo levemente: 47 casos en el grupo de tratamiento y 37 en el grupo placebo, una diferencia que no alcanza una significancia estadística. El análisis de los cánceres invasivos de mama solamente en las participantes adherentes, reconociendo el alto porcentaje de abandono en el estudio, no cambia los resultados. Los cánceres de mama en el grupo tratado fueron ligeramente más grandes con más nódulos positivos y menos enfermedad localizada. No hubo diferencia en la distribución de los cánceres con receptores de estrógenos y receptores de progesterona o grado del tumor. El WHI no detectó diferencias entre los tipos histológicos de los cánceres de mama, en desacuerdo con los estudios casos-controles de que la terapia estrógenos-progestinas está asociada con un aumento principalmente de los tumores lobulares25, 26. ¿Cómo se correlaciona esto con lasestadísticas nacionales que indican un aumento de los tumores lobulares pero no un cambio en la incidencia de cánceres ductales?27
Las mujeres con mayor densidad mamográfica de los senos tienen una mayor incidencia de cáncer de mama28-30, y aproximadamente el 25% de las mujeres en terapia estrógenosprogestinas estrógenosprogestinas tienen aumento de su densidad mamaria. En contraste, raloxifeno y tibolona no tienen impacto en la densidad mamaria31. Sin embargo, no es cierto que el aumento a corto plazo de la densidad mamaria con terapia hormonal cambie el riesgo individual de cáncer de mama. La mayoría de la usuarias corrientes de terapia hormonal tienen senos másdensos que las no usuarias32-35. En el área de Seattle, el 49% de las usuarias actuales tenían mamas densas comparadas con el 33% en las no usuarias, y el efecto fue mayor con el aumento de la edad36. Indudablemente en mujeres menores de 55 años, es difícil de encontrar cualquier diferencia entre suarias y no usuarias37. Pero ¿cuál es el impacto en mujeres mayores de 55 años? En un estudio, la densidad del seno aumentó en solo 8% de las usuarias de hormonas por encima de 55 años (dos tercios de las pacientes usaban solo estrógenos, una tercera parte utilizaba estrógenosprogestinas); en la gran mayoría de las pacientes, los senos permanecían iguales37. El efecto de la terapia hormonal sobre la densidad mamaria se resenta rápidamente; así, la duración del uso no tiene efecto37.
En el estudio PEPI randomizado de 3 años en mujeres postmenopáusicas con estrógenosprogestinas, casi todo el aumento ocurrió en el primer año, con un incremento de densidad mamaria del 8% en las usuarias de solo estrógenos, 19-24% en el grupo estrógenosprogestinas y solamente 2% en el grupo placebo38. Las usuarias de regímenes combinados de estrógenos- progestinas tenían un mayor riesgo de desarrollar mamas más densas comparadas con el grupo de tratamiento con estrógenos solos (7-13 veces mayor en el estudio PEPI sin diferencia entre medroxiprogesterona y progesterona micronizada)38. En estudios cuidadosos de administración diaria continua de regímenes combinados de estrógenos-progestágenos se ha reportado que tienen un efecto mayor que los regímenes secuenciales, con un aumento de la densidad que ocurre dentro de los primeros meses del tratamiento y permaneciendosin cambios39-43. Por lo tanto, la terapia hormonal aumenta la densidad mamaria principalmente en mujeres posmenopáusicas más viejas; más mujeres responden a la terapia combinada estrógenos- rogestinas (particularmente los programas diarios continuos) y el efecto ocurre en los primeros meses de uso y permanece estable, sin cambios con el aumento de la duración del uso. Sin embargo, este efecto se ve solo en aproximadamente el 25% más de las usuarias comparadas con las no usuarias. Indudablemente, no todas las mujeres responden de esta manera (de hecho, la mayoría no). Y más importante aún, en aquellas mujeres con un aumento de la densidad mamaria, ladescontinuación del tratamiento disminuye la densidad35, 44, 45.
El aumento en la densidad mamaria asociada con la terapia hormonal posmenopáusica parece ser transitorio, con cambios reversibles y un cambio no consistente con un efecto persistente de proliferación celular. Después de descontinuar la terapia hormonal, la densidad mamaria rápidamente disminuye35, 44, 45.
A mayor edad de los pacientes, mayor el riesgo de desarrollar un aumento en la densidad mamaria con la terapia hormonal. Por lo tanto hay una buena razón para recomendar la suspensión de la terapia por dos semanas antes de la mamografía en mujeres mayores de 65 años, en quienes tienen senos densos. En mujeres más jóvenes, a las que se ha hecho volver por una sospecha o dificultad para leer la mamografía, podría se útil suspender el tratamiento hormonal por dos semanas antes de repetir la evaluación. ¿Puede la terapia hormonal dañar el tamizaje de la mamografía? Si la efectividad del tamizaje del cáncer de mama se reduce por la terapia hormonal postmenopáusica, uno podría esperar un efecto adverso sobre la mortalidad por cáncer de mama, aunque, un estudio que indica reducción en la sensibilidad de la mamografía también reporta tumores más pequeños y mejor diferenciados (Grado I) entre las usuarias comparadas con las no usuarias,43 y la mayoría de los estudios que han examinado las tasas de mortalidad por cáncer de mama de las mujeres que han usado terapia hormonal postmenopáusica han documentado tasas de supervivencia mejores.46-56 La evidencia indica que las usuarias de hormonas desarrollaron tumores más pequeños y mejor diferenciados (bajo grado), certeza que es consistente con los efectos de tumores preexistentes y que el sesgo de supervivencia / detección no es la única explicación para una supervivencia mayor57-68. Los tumores de bajo grado están presentes aun cuando no hay diferencia en la prevalencia de la mamografía comparando las usuarias de hormonas con las no usuarias o cuando los datos se ajustan para el método dedetección53, 55, 63. La mayoría de los tumores en las usuarias de hormonas se detectan usando el tamizaje de la mamografía, pero cuando se miden los resultados de todos los cánceres detectados por mamografía, las usuarias de hormonas tienen más tumores ductales in situ, más cánceresnódulo-negativos, tumores más pequeños y enfermedad menos invasiva y por lo tanto mejores tasas de sobrevida69. En contraste, los resultados del WHI en el brazo de estrógenos-progestinas indicaron una aparición más temprana y tumores peores que los previamente reportados en los estudios casos-controles y de cohortes. El WHI puntualizó que los resultados (los cánceres de mama invasivos y los detectados por mamografía) son consistentes con la estimulación del crecimiento en cánceres mamarios establecidos (apoyado por la no diferencia de tumores in situ), pero al mismo tiempo una demora en el diagnóstico.
Esta ciertamente despierta la idea de que las usuarias de hormonas tienen mejor pronóstico por una detección más temprana. El WHI sugiere que este desacuerdo podría ser por una diferencia en el uso de la mamografía en los estudios observacionales. Sin embargo, hay estudios que examinan las características del tumor y el pronóstico en las usuarias y no usuarias quienes han usado igualmente mamografía. Una enfermedad de bajo grado y estado con un mejor pronóstico, se identificó en las usuarias53, 55, 69. Adicionalmente un estudio prospectivo de cohorte encontró poco impacto del uso de hormonas sobre la especificidad de la mamografía70. En contraste con muchos reportes en la literatura, el WHI concluyó que sus resultados sugerían que los cánceres de mama invasivos diagnosticados en mujeres que usaban terapia hormonal podrían tener un pronóstico peor, basando esta conclusión en las diferencias observadas en el tamaño del tumor y la extensión de la enfermedad. Por ahora está bien reconocido que las participantes en el WHI representan una población posmenopáusica más vieja (promedio de edad 63 años y un promedio de 18 años de menopausia). Esta población más vieja está más propensa a tener tumores preexistentes ocultos que podrían llegar a ser detectables muy rápido después de la estimulación hormonal. Además el tejido mamario de mujeres mayores podría responder de forma diferente ala estimulación hormonal que el tejido mamario de las mujeres cercanas a su menopausia. ¿Es posible que los resultados el WHI reflejen esta población más vieja, la cual podría tener tumores ocultos que son de hecho más grandes ymás propensos a responder a la estimulación hormonal que en las mujeres más jóvenes? Otro problema incluye la falta de adjudicación del diagnóstico histológico que fue establecido por cientos depatólogos y las variaciones en el tratamiento entre las dispersas participantes (por ejemplo la introducción de la medición y búsqueda del nódulo centinela en la mitad del estudio en una forma no controlada).
El brazo de solo estrógenos del WHI no observó un aumento en el cáncer mamario; indudablemente, el riesgo de cáncer de mama fue reducido en el grupo de tratamiento, aunque no alcanzó significancia estadística (Tabla 2)3. Es importante tener presente que las participantes en los dos brazos el WHI no fueron idénticas71. El brazo de solo estrógenos tenía 5 859 participantes, haciéndolo más susceptible de perder poder estadístico con el aumento de casos de abandono, el cual alcanzó el 53.8% en el tiempo. Con relación a factores de riesgo de cáncer mamario, la mujeres en el grupo de solo estrógenos tuvieron más partos tempranos, ooforectomía bilateral, y más duración previa de terapia hormonal. Los factores de riesgo en los dos brazos fueron iguales; es posible que entre más temprano y mayor el uso de terapia hormonal, antes de la participación en el estudio se identifiquen las mujeres con tumores preexistentes quienes fueron excluidas de la participación, dando como resultado la baja incidencia de cáncer mamario en el grupo de tratamiento.
Terapia Hormonal postmenopáusica y cáncer de mama: Conclusiones
El WHI está de acuerdo con algunos estudios casos-controles y de cohorte que indicaba
Tabla 2. Incidencia de cáncer de mama entre las participantes de brazo de estrógenos solos del Women’s Health Initiative
Que el uso corriente de estrógenos combinados con progestinas iba con un ligero aumento del riesgo de cáncer de mama. Aún no se conoce si esos hallazgos son debidos a la terapia hormonal o a tumores preexistentes.
Los datos epidemiológicos indican que una historia familiar positiva para cáncer de mama podría no ser contraindicación para el uso de terapia hormonal posmenopáusica. Las mujeres que desarrollan cáncer de mama mientras usan TRH tienen un riesgo reducido de morir de cáncer de mama. Esto es probablemente por dos factores: i) aumento de la vigilancia y detección temprana; y ii) un efecto de un tumor preexistente, de tal manera que los tumores aparecen en un estado menos virulento y agresivo.
La terapia hormonal posmenopáusica está asociada con un pequeño aumento de cáncer de mama o afecta tumores preexistentes. Por lo tanto, aun un pequeño aumento del riesgo de cáncer de mama es atemorizante para que los pacientes lo contemplen. Es de ayuda recordar a los pacientes el riesgo de cáncer de pulmón asociado con el cigarrillo (un RR de 10-20), una magnitud de riesgo que provee perspectiva sobre el posible riesgo asociado con la terapia hormonal. Es también importante puntualizar que el riesgo reportado con terapia hormonal está asociado con reconocidos factores de riesgo tales como una historia familiar positiva, que tiene mayor peso después de la menopausia y del consumo de alcohol. Desde nuestro punto de vista, debido a que la literatura es suficientemente fuerte, es apropiado compartir con las pacientes una explicación alternativa para los reportes epidemiológicos acerca del cáncer de mama y la terapia hormonal postmenopáusica.
Es de ayuda enfatizar la posibilidad de que los estudios reflejen un efecto de la terapia hormonal en tumores preexistentes y que las usuarias de hormonas que desarrollan cáncer de mama tienen un riesgo reducido de morir de cáncer de mama, porque sus tumores son más diferenciados, más localizados y más pequeños. Los diferentes resultados del WHI son un misterio, y pueden reflejar la mayor edad de las participantes o variaciones en el diagnóstico y tratamiento.
Osteoporosis
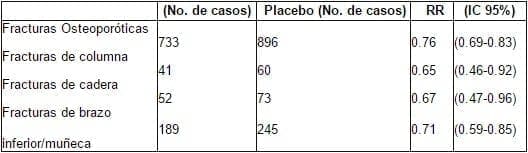
La terapia estrogénica estabiliza el proceso de osteoporosis o previene su ocurrencia. Igual que inhiben la actividad resortiva del osteoblasto, los estrógenos aumentan la absorción intestinal de calcio, aumentan la 1,25 dihidroxivitamina D (la forma activa de vitamina D), aumentan la conservación renal de calcio, y apoyan la supervivencia de los osteoblastos. Con la terapia estrogénica uno puede esperar de un 50 a 60% de reducción de fracturas del brazo y la cadera72-75, y cuando los estrógenos se suplementan con calcio, un 80% de reducción en la fracturas vertebrales por compresión76. Esta reducción se ve primariamente en pacientes que toman estrógenos por más de 5 años77, 78. La protección contra las fracturas disminuye con la edad, y se necesita uso de estrógenos por largo tiempo para maximizar la reducción del riesgo de fractura después de los 75 años de edad.
Debido a que la mayoría de las fracturas osteoporóticas ocurren tarde en la vida, las mujeres y los clínicos debemos entender que no se puede esperar que el uso de estrógenos por corto tiempo, inmediatamente después de la menopausia, proteja contra las fracturas en las décadas de los setenta o los ochenta de la vida. Alguna protección a largo plazo se alcanza con 7 a 10 años de terapia estrogénica después de la menopausia, pero el impacto es mínimo después de los 75 años de edad79. En un estudio prospectivo de cohorte de mujeres mayores de 65 años de edad, en las que habían suspendido el uso de estrógenos, aun si ellas habían usado estrógenos por más de diez años, no hubo un efecto sustancial sobre el riesgo de fracturas80. El impacto efectivo de los estrógenos requiere iniciación dentro de los 5 años siguientes a la menopausia y su uso puede extenderse hasta los años mayores. El efecto protector de los estrógenos se disipa rápidamente después de la suspensión de la terapia estrogénica, y hay una pérdida acelerada de hueso8-83. En un estudio sueco de casos y controles, la mayoría de los efectos benéficos de la terapia hormonal se perdió a los cinco años, después de la suspensión del tratamiento75. La máxima protección contra las fracturas requiere terapia por largo tiempo, y aun alguna protección a largo término necesita de más de diez años de tratamiento84; las dosis estándar de estrógenos administradas de manera transdérmica (50 mg) parece que protegen contra las fracturas también como las dosis estándar orales75.
Hay razones para creer que el impacto de la terapia hormonal se desestimó en el WHI (Tabla 3). La reducción en las fracturas aumenta en el tiempo, sugiriendo que el efecto más poderoso se alcanza con tratamiento de larga duración. Las fracturas de columna incluyeron solo las fracturas clínicas sintomáticas (que se sabe representan aproximadamente un tercio de las fracturas vertebrales). El efectopodría haber sido más grande si los clínicos participantes no hubieran prescrito bifosfonatos a un 6% del grupo de tratamiento y a un 10% del grupo placebo. Inicialmente, las participantes no se seleccionaron para obtener un grupo de mujeres con alto riego de fractura; por el contrario, se trataba de mujeres con bajo riesgo de tener fracturas.
Cáncer de Ovario
Estudios de cohorte prospectivos concluyeron que el riesgo de cáncer de ovario fatal se aumentó con el uso de estrógenos a largo plazo86-88. No sabemos si esta asociación es real. Estudios individuales han sido atacados por el relativo bajo número, pero la falta de uniformidad y asociación consistente arguye en contra de un mayor impacto de los estrógenos del tratamiento con estrógenos en posmenopausia sobre el riesgo de cáncer de ovario. En un estudio relativamente grande de casos y controles, no se encontró indicación para una asociación entre terapia hormonalposmenopáusica y riesgo de cáncer epitelial de ovario, aun en tratamientos a largo plazo91. En otro estudio casos-controles no se pudo encontrar aumento del riesgo con el no uso, el uso pasado o la larga duración del uso (y nohubo diferencias al comparar los diversos regímenes de estrógenos)92.
Tabla 3. Reporte del Women’s Health Initiative sobre fracturas (Estrógenos / progestinas)
El diagnóstico de cáncer de ovario en el grupo de tratamiento de estrógenos-progestágenos combinado podría aumentar el riesgo de cáncer de ovario, pero el pequeño número limita el poder estadístico. El WHI apropiadamente concluye que este es un tema preocupante y requiere posterior estudio epidemiológico.
Un mayor problema es que el riesgo de cáncer de ovario está influido por muchos otros factores. El reporte del WHI dejó establecido que muchos estudios de observación han encontrado un aumento modesto de riesgo de cáncer de ovario, pero en realidad la mayoría de los estudios no y aquellos que reportan un aumento del riesgo están falseados por el increíble bajo número, haciendo imposible el control de todos los factores que influyen.
El efecto de la terapia hormonal en el riesgo de cáncer de ovario permanece como un tema no concluido, aunque la mayoría de los estudios casos-controles no encuentran aumento.
Cáncer Colorrectal
La mayoría, pero no todos los estudios de cohorte casos-controles, han reportado una significante disminución de la incidencia del riesgo de cáncer colorrectal en usuarias de estrógenos posmenopáusicos94-100. El efecto es mayor en usuarias corrientes de estrógenos y la mayoría de los estudios no han indicado un incremento del efecto con el aumento de la duración del uso. Por ejemplo, el Nurses’s Health Study (el cual encontró un 34% de reducción del riesgo en usuarias corrientes) no pudo demostrar un beneficio adicional con duración mayor del uso corriente101. Una reducción del cáncer fatal de colon ha sido documentada en usuarias corrientes96. También parece haber un riesgo reducido de pólipos, particularmente pólipos grandes, entre usuarias actuales y recientes de hormonas.
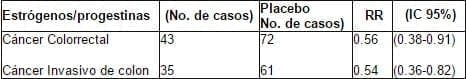
El cancelado brazo de estrógenos-progestágenos del WHI reportó una reducción significante del riesgo de cáncer de colon alcanzado con solo unos pocos años de terapia estrógenosprogestágenos (Tabla 4)102. Hubo muy pocos casos de cáncer rectal para hacer análisis separados.
Este resultado no deja de ser preocupante; sin embargo, en el grupo tratado había enfermedad más avanzada. Indudablemente, la conclusión fue demorada porque a diferencia de la enfermedad localizada, 10 casos en el grupo tratado y 36 en el grupo placebo. Los resultados sugieren que así todos los casos de cáncer presentes fueron influidos por la terapia hormonal para alcanzar un estado más avanzado, pero el tratamiento estrógenosprogesterona redujo el riesgo de nuevos cánceres de colon. El brazo de solo estrógenos del WHI no reparó una diferencia en el cáncer colorrectal, pero recordemos que este brazo tenía dos problemas importantes: una tasa alta de abandono y aproximadamente 600 participantes menos3.
Tabla 4. Women’s Health Initiative: Cáncer Colorrectal
Uno solamente puede especular acerca del mecanismo de este beneficio. El cambio inducido por los estrógenos en la bilis (una disminución en los ácidos biliares con un aumento en la saturación de colesterol) favorece la formación de cálculos, pero podría reducir la promoción (por los ácidos biliares) del cáncer de colon. Otro posible mecanismo incluye un efecto supresivo directo sobre el crecimiento de células de la mucosa y un efecto benéfico sobre las secreciones de la mucosa. Él contiene solo receptores b, y la reducción en el riesgo del cáncer de colon asociado con la terapia hormonal posmenopáusica podía reflejar un efecto antiproliferativo de la actividad del receptor b.
Este potencial efecto benéfico merece mayor atención; los cánceres colorrectales están en tercer lugar en las mujeres, en incidencia y en mortalidad, y son más prevalentes que los cánceres de útero y ovario3.
El reporte del WHI en demencia y efecto cognitivo
El estudio de memoria del WHI (WHIMS) es un estudio clínico aleatorizado, que utilizó 4 532 de las participantes en el WHI. Después de la cancelación del brazo de estrógenosprogestinas, el WHIMS analizó el efecto hormonal en un subgrupo de las participantes, todas mayores de 65 años de edad.
El WHI concluyó que la terapia de estrógenos-progestinas aumentaba el riesgo de probable demencia en mujeres de 65 o más años de edad y no prevenía el trastorno leve cognitivo104, 105. Sin embargo, el único hallazgo estadístico fue el aumento de la demencia (no enfermedad de Alzhiemer) en mujeres viejas (22 casos en el grupo tratado y 10 casos en el grupo placebo) quienes fueron de 75 años o más y quienes habían sido expuestas a un ciclo relativamente corto de terapia estrógenosprogestinas.
El brazo de solo estrógenos el WHI tenía más mujeres obesas con enfermedad enfermedad cardiovascular preexistente, y la tendencia a un aumento de la demencia parece que refleja un efecto en mujeres viejas con arteriosclerosis establecida.
¿Podrían estar protegidas contra la demencia las mujeres viejas que han usado terapia estrógenos-progestágenos por largo tiempo, desde poco después de su menopausia? El reporte del WHI reconoció que esta hipótesis no podía ser probada en este estudio clínico por lo mayor de las edades de las participantes en el estudio. Un estudio prospectivo de un grupo de población homogéneo de Utah (minimizando, pero no eliminado el sesgo de usuarias sanas) concluyó que una reducción en el riesgo de Alzheimer requiere un tratamiento prolongado, iniciado al menos diez años antes de que los síntomas de demencia aparezcan106. El efecto favorable de la terapia hormonal en el área cognitiva y el riesgo de enfermedad de Alzhiemer parecen estar limitados a mujeres que inician el tratamiento cerca de la menopausia.
Conclusión
La terapia hormonal posmenopáusica no está acabada por los resultados reportados por el WHI. Continúa siendo una buena razón para creer que hay beneficios asociados al tratamiento, incluyendo mejoría en la calidad de vida más allá del alivio de los fogajes, protección máxima contra fracturas osteoporóticas, reducción en cáncer colorrectal, mantenimiento de la turgencia y elasticidad de la piel y la posibilidad de prevención primaria de ECV y enfermedad de Alzheimer. Por lo tanto, esto no significa que deben retirarse los esfuerzos de aplicar terapias probadas (p. ej. la estátina) y de apoyar la modificación del estilo de vida. Un tema emergente de la confusión epidemiológica de los últimos años: se necesita un tejido sano para permitir una respuesta efectiva a los estrógenos y el mantenimiento de la salud. Evidencia experimental en macacus y mujeres indica que como las células endoteliales están relacionadas con la arteriosclerosis y las neuronas son afectadas en el proceso patológico del Alzheimer21, 22, 106, la respuesta benéfica de los estrógenos disminuye. El efecto máximo, por lo tanto, puede requerir el inicio temprano de la terapia, cerca del tiempo de la menopausia.
Referencias
1. The Women’s Health Initiative Study Group. Design of the Women’s Health Initiative clinical trial and observational study. Control Clin Trials 1998; 19: 61– 109.
2. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288: 321–333.
3. The Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The Women’s Health Initiative Randomized Controlled Trial. JAMA 2004; 291: 1707–1712.
4. Manson JE, Hsia J, Johnson KC et al. Estrogen plus progestin and the risk of coronary heart disease. N Engl J Med 2003; 349: 523–534.
5. Hays J, Ockene JK, Brunner RL et al. Effects of estrogen plus progestin on healthrelated quality of life. N Engl J Med 2003; 348: 1839–1854.
6. Chilvers CE, Knibb RC, Armstrong SJ, Woods KL, Logan RF. Post menopausal hormone replacement therapy and risk of acute myocardial infarction – a case control study of women in the East Midlands, UK. Eur Heart J 2003; 24: 2197–2205.
7. Hodis HN, Mack WJ, Lobo RA et al. Estrogen in the prevention of atherosclerosis: A randomized, double-blind, placebo- ontrolled trial. Ann Intern Med 2001; 135: 939–953.
8. De Kleijn MJ, Bots ML, Bak AA et al. Hormone replacement therapy in perimenopausal women and 2-year change of carotid intima-media thickness. Maturitas 1999; 32: 195–204.
9. Angerer P, Störk S, Kothny W, Schmitt P, von Schacky C. Effect of oral postmenopausal hormone replacement on progression of atherosclerosis. A randomized, controlled trial. Atheroscler Thromb Vasc Biol 2001; 21: 262–268.
10. Wassertheil-Smoller S, Hendrix SL, Limacher M et al. Effect of estrogen plus progestin on stroke in postmenopausal women. The Women’s Health Initiative: A randomized trial. JAMA 2003; 289: 2673– 2684.
11. Hulley S, Grady D, Bush T et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. JAMA 1998; 280: 605–618.
12. Herrington DM, Reboussin DM, Brosnihan KB et al. Effects of estrogen replacement on the progression of coronary artery atherosclerosis. N Engl J Med 2000; 343: 522–529. 13. Clarke SC, Kelleher J, Lloyd-Jones H, Slack
13. M, Schofield PM. A study of hormone replacement therapy in postmenopausal women with ischaemic heart disease: The Papworth HRT Atherosclerosis Study. Br J Obstet Gynaecol 2002; 109: 1056–1062.
14. Waters DD, Alderman EL, Hsia J et al. Effects of hormone replacement therapy and antioxidant vitamins supplements on coronary atherosclerosis in postmenopausal women. A randomized controlled trial. JAMA 2002; 288: 2432–2440.
15. The ESPRIT Team. Oestrogen therapy for prevention of reinfarction in postmenopausal women: A randomised placebo controlled trial. Lancet 2002; 360: 2001– 2008.
16. Herrington DM, Vittinghoff E, Lin F et al. Statin therapy, cardiovascular events, and total mortality in the Heart and Estrogen/ Progestin Replacement Study (HERS). Circulation 2002; 105: 2962–2967.
17. Toorians AWFT, Thomassen MCLGD, Zweegman S et al. Venous thrombosis and changes of hemostatic variables during cross-sex hormone treatment in transsexual people. J Clin Endocrinol Metab 2003; 88: 5723–5729.
18. Oger E, Alhenc-Gelas M, Lacut K et al. Differential effects of oral and transdermal estrogen/progesterone regimens on sensitivity to activated protein C among postmenopausal women: A randomized trial. Arterioscler Thromb Vasc Biol 2003; 23: 1671–1676.
19. Post MS, Christella M, Thomassen LG et al. Effect of oral and transdermal estrogen replacement therapy on hemostatic variables associated with venous thrombosis: A randomized, placebo-controlled study in postmenopausal women. Arterioscler Thromb Vasc Biol 2003; 23: 1116–1121.
20. Scarabin PY, Oger E, Plu-Bureau G, Estrogen and Thromboembolism Risk Study Group. Differential association of oral and transdermal oestrogen-replacement therapy with venous thromboembolism risk. Lancet 2003; 362: 1242.
21. Mikkola TS, Clarkson TB. Estrogen replacement therapy: Atherosclerosis, and vascular function. Cardiovasc Res 2002; 53: 605–619.
22. Herrington DM, Espeland MA, Crouse JR III et al. Estrogen replacement and brachial artery flow-mediated vasodilatation in older women. Arterioscler Thromb Vasc Biol 2001; 21: 1955–1961.
23. Scheele F, Burger CW, Kenemans P. Postmenopausal hormone replacement in the woman with a reproductive risk factor for breast cancer. Maturitas 1999; 33: 191–196.
24. Chlebowski RT, Hendrix SL, Langer RD et al. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women. The Women’s Health Initiative Randomized Trial. JAMA 2003; 289: 3243–3253.
25. Li CI, Weiss NS, Stanford JL, Daling JR. Hormone replacement therapy in relation to risk of lobular and ductal breast carcinoma in middle-aged women. Cancer 2000; 88: 2570–2577.
26. Li CI, Malone KE, Porter PL et al. Relationship between long durations and different regimens of hormone therapy and risk of breast cancer. JAMA 2003; 289: 3254–3263.
27. Li CI, Anderson BO, Daling JR, Moe RE. Trends in incidence rates of invasive lobular and ductal breast carcinoma. JAMA 2003; 289: 1421–1424.
28. Byrne C, Schairer C, Wolfe J et al. Mammographic features and breast cancer risk: Effects with time, age, and menopause status. J Natl Cancer Inst 1995; 87: 1622–1629. Clinical appraisal of the WHI 91.
29. Byng JW, Yaffe MJ, Jong RA et al. Analysis of mammographic density and breast cancer risk from digitized mammograms. Radiographics 1998; 18: 1587–1598.
30. Ursin G, Ma H, Wu AH et al. Mammographic density and breast cancer in three ethnic groups. Cancer Epidemiol Biomarkers Prev 2003; 12: 332–338.
31. Christodoulakos GE, Lambrinoudaki IV, Vourtsi AD, Panoulis KPC, Kelekis DA, Creatsas G. Mammographic changes associated with raloxifene and tibolone therapy in postmenopausal women: A prospective study. Menopause 2002; 9: 110– 116.
32. Marugg RC, van der Mooren MJ, Hendriks JHCL, Rolland R, Ruijs SHJ. Mammographic changes in postmenopausal women on hormonal replacement therapy. Eur Radiol 1997; 7: 749–755.
33. Persson I, Thurfjell E, Holmberg L. Effect of estrogen and estrogen-progestin replacement regimens on mammographic parenchymal density. J Clin Oncol 1997; 15: 3201–3207.
34. Sala E, Warren R, McCann J, Duffy S, Luben R, Day N. Highrisk mammographic parenchymal patterns, hormone replace ment therapy and other risk factors: A case–control study. Int J Epidemiol 2000; 29: 629–636.
35. Rutter CM, Mandelson MT, Laya MB, Seger DJ, Taplin S. Changes in breast density associated with initiation, discontinuation and continuing use of hormone replacement therapy. JAMA 2001; 285: 171–176.
36. El-Bastawissi AY, White E, Mandelson MT, Taplin SH. Reproductive and hormonal factors associated with mammographic breast density by age (United States). Cancer Causes Control 2000; 11: 955–963.
37. Sterns EE, Zee B. Mammographic density changes in perimenopausal and postmenopausal women: Is effect of hormone replacement therapy predictable? Breast Cancer Res Treat 2000; 59: 125–132.
38. Greendale GA, Reboussin BA, Sie A et al. Effects of estrogen and estrogen-progestin on mammographic parenchymal density. Ann Intern Med 1999; 130: 262–269.
39. Lundström E, Wilczek B, von Palffy Z, Söderqvist G, von Schoultz B. Mammographic breast density during hormone replacement therapy: Differences according to treatment. Am J Obstet Gynecol 1999; 181: 348–352.
40. Lundström E, Wilczek B, von Palffy Z, Söderqvist G, von Schoultz B. Mammographic breast density during hormone replacement therapy: Effects of continuous combination, unopposed transdermal and low-potency estrogen regimens. Climacteric 2001; 4: 42–48.
41. Erel CT, Esen G, Seyisoglu H et al. Mammographic density increase in women receiving different hormone replacementregimens. Maturitas 2001; 40: 151–157.
42. Colacurci N, Fornaro F, De Franciscis P, Palermo M, del Vecchio W. Effects of different types of hormone replacement therapy on mammographic density. Maturitas 2001; 40: 159–164.
43. Sendag F, Terek MC, Õzsener S et al. Mammographic density changes during different postmenopausal hormone replacement therapies. Fertil Steril 2001; 76: 445– 450.
44. Berkowitz JE, Gatewood OMB, Goldblum LE, Gayler BW. Hormonal replacement therapy: Mammographic manifestations. Radiology 1990; 174: 199–201.
45. Harvey JA, Pinkerton JV, Herman CR. Short-term cessation of hormone replacement therapy and improvement of mammographic specificity. J Natl Cancer Inst 1997; 89: 1623–1625.
46. Bergkvist L, Adami H-O, Persson I, Bergstrom R, Krusemo UB. Prognosis after breast cancer diagnosis in women exposed to estrogen and estrogen-progestogen replacement therapy. Am J Epidemiol 1989; 130: 221–227.
47. Hunt K, Vessey M, McPherson K. Mortality in a cohort of long-term users of hormone replacement therapy: An updated analysis. Br J Obstet Gynaecol 1990; 97: 1080–1086.
48. Henderson BE, Paganini-Hill A, Ross RK. Decreased mortality in users of estrogen replacement therapy. Arch Intern Med 1991; 151: 75–78.
49. Persson I, Yuen J, Bergkvist L, Schairer C. Cancer incidence and mortality in women receiving estrogen and estrogenprogestin replacement therapy – long-term followup of a Swedish cohort. Int J Cancer 1996; 67: 327–332.
50. Willis DB, Calle EE, Miracle-McMahill HL, Heath CW Jr. Estrogen replacement therapy and risk of fatal breast cancer in a prospective cohort of postmenopausal women in the United States. Cancer Causes Control 1996; 7: 449–457.
51. Grodstein F, Stampfer MJ, Colditz GA et al. Postmenopausal hormone therapy and mortality. N Engl J Med 1997; 336:1769– 1775.
52. Sellers TA, Mink PJ, Cerhan JR et al. The role of hormone replacement therapy in the risk for breast cancer and total mortality in women with a family history of breast cancer. Ann Intern Med 1997; 127: 973– 980.
53. Schairer C, Gail M, Byrne C et al. Estrogen replacement therapy and breast cancer survival in a large screening study. J Natl Cancer Inst 1999; 91: 264–270.
54. Fowble B, Hanlon A, Greedman G et al. Postmenopausal hormone replacement therapy: Effect on diagnosis and outcome in early-stage invasive breast cancer treated with conservative surgery and radiation. J Clin Oncol 1999; 17:1680–1688.
55. Jernström H, Frenander J, Fernö M, Olsson H. Hormone replacement therapy before breast cancer diagnosis signifi-cantly reduces the overall death rate compared with neveruse among 984 breast cancer patients. Br J Cancer 1999; 80:1453–1458.
56. Nanda K, Bastian LA, Schulz K. Hormone replacement therapy and the risk of death from breast cancer: A systematic review. Am J Obstet Gynecol 2002; 186: 325–334.
57. Squitieri R, Tartter P, Ahmed S, Brower ST. Carcinoma of the breast in postmenopausal hormone user and nonuser control groups. J Am Coll Surg 1994; 178: 167–170.
58. Bonnier P, Romain S, Giacalone PL, Laffargue F, Martin PM, Piana L. Clinical and biologic prognostic factors in breast cancer diagnosed during postmenopausal hormonereplacement therapy. Obstet Gynecol 1995; 85: 11–17.
59. Magnusson C, Holmberg L, Norden T, Lindgren A, Persson I. Prognostic characteristics in breast cancers after hormone replacement therapy. Breast Cancer Res Treat 1996; 38: 325–334.
60. Holli K, Isola J, Cuzick J. Low biologic aggressiveness in breast cancer in women using hormone replacement therapy. J Clin Oncol 1998; 16: 3115–3120.
61. O’Connor IF, Shembekar MV, Shousha S. Breast carcinoma developing in patients on hormone replacement therapy: A L. Speroff 92 histological and immunohistological study. J Clin Pathol 1998; 51: 935–938.
62. Salmon RJ, Ansquer Y, Asselain B, Languille O, Lesec G, Remvikos Y. Clinical and biological characteristics of breast cancers in post-menopausal women receiving hormone replacement therapy for menopause. Oncol Rep 1999; 6: 699–703.
63. Bilimoria MM, Winchester DJ, Sener SF, Motykie G, Sehgal UL, Winchester DP. Estrogen replacement therapy and breast cancer: Analysis of age of onset and tumor characteristics. Ann Surg Oncol 1999; 6: 200–207.
64. Manjer J, Malina J, Berglund G, Bondeson L, Garne JP, Janzon L. Increased incidence of small and welldifferentiated breast tumours in post-menopausal women following hormone-replacement therapy. Int J Cancer 2001; 92: 919–922.
65. Delgado RC, Lubian Lopez DM. Prognosis of breast cancers detected in women receiving hormone replacement therapy. Maturitas 2001; 20: 147–156.
66. Pappo I, Meirshon I, Karni T et al. The characteristics of malignant breast tumors in hormone replacement therapy users versus nonusers. Ann Surg Oncol 2004; 11: 52–58.
67. Kerlikowske K, Miglioretti DL, Ballard-Barbash R et al Prognostic characteristics of breast cancer among postmenopausal hormone users in a screened population. J Clin Oncol 2003; 21: 4314–4321.
68. Gertig DM, Erbas B, Fletcher A, Amos A, Kavanagh AM. Duration of hormone replacement therapy, breast tumour size and grade in a screening programme. Breast Cancer Res Treat 2003; 80: 267–273.
69. Cheek J, Lacy J, Toth-Fejel S, Morris K, Calhoun K, Pommier RF. The impact of hormone replacement therapy on the detection and stage of breast cancer. Arch Surg 2002; 137:1015–1019.
70. Carney PA, Miglioretti DL, Yankaskas BC et al. Individual and combined effects of age, breast density, and hormone replacement therapy use on the accuracy of screening mammography. Ann Intern Med 2003; 138: 168–175.
71. Stefanick ML, Cochrane BB, Hsia J, Barad DH, Liu JH, Johnson SR. The Women’s Health Initiative postmenopausal hormone trials: Overview and baseline characteristics of participants. Ann Epidemiol 2003; 13: S78–S86.
72. Weiss NC, Ure CL, Ballard JH, Williams AR, Daling JR. Decreased risk of fractures of the hip and lower forearm with postmenopausal use of estrogen. N Engl J Med 1980;303: 1195–1198.
73. Ettinger B, Genant HK, Cann CE. Longterm estrogen replacement therapy prevents bone loss and fractures. Ann Intern Med 1985; 102: 319–324.
74. Kiel DP, Felson DT, Anderson JJ, Wilson PWF, Moskowitz MA. Hip fracture and the use of estrogen in postmenopausal women: The Framingham Study. N Engl J Med 1987;317: 1169–1174.
75. Michaëlsson K, Baron JA, Farahmand BY et al. Hormone replacement therapy and risk of hip fracture: Population based case– control study. Br Med J 1998; 316: 1858–1863.
76. Riggs BL, Seeman E, Hodgson SF, Taves DR, O’Fallon WM. Effect of the fluoride/ calcium regimen on vertebral fracture occurrence in postmenopausal osteoporosis. N Engl J Med 1982; 306: 446–450.
77. Quigley MET, Martin PL, Burnier AM, Brooks P. Estrogen therapy arrests bone loss in elderly women. Am J Obstet Gynecol 1987; 156: 1516–1523.
78. Lafferty FW, Fiske ME. Postmenopausal estrogen replacement: A long-term cohort study. Am J Med 1994; 97: 66–77.
79. Felson DT, Zhang Y, Hannan MT, Kiel DP, Wilson PWF, Anderson JJ. The effect of postmenopausal estrogen therapy on bone density in elderly women. N Engl J Med 1993; 329:1141–1146.
80. Cauley JA, Seeley DG, Enbsrud K et al. Estrogen replacement therapy and fractures in older women. Ann Intern Med 1995; 122: 9–16.
81. Lindsay R, MacLean A, Kraszewski A, Clark AC, Garwood J. Bone response to termination of estrogen treatment. Lancet 1978; i: 1325–1327.
82. Horsman A, Nordin BEC, Crilly RG. Effect on bone of withdrawal of estrogen therapy. Lancet 1979; ii: 33.
83. Christiansen C, Christiansen MS, Transbol IB. Bone mass in postmenopausal women after withdrawal of oestrogen/ gestagen replacement therapy. Lancet 1981; i: 459– 461.
84. Schneider DL, Barrett-Connor EL, Morton DJ. Timing of postmenopausal estrogen for optimal bone mineral density. The Rancho Bernardo Study. JAMA 1997; 277: 543–547.
85. Cauley J, Robbins J, Chen Z et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density. The Women’s Health Initiative Randomized Trial. JAMA 2003;290: 1729–1738.
86. Rodríguez C, Patel AV, Calle EE, Jacob EJ, Thun MJ. Estrogen replacement therapy and ovarian cancer mortality in a large prospective study of US women. JAMA 2001; 285: 1460–1465.
87. Lacey JV Jr, Mink PJ, Lubin JH et al. Menopausal hormone replacement therapy and risk of ovarian cancer. JAMA 2002; 288: 334–341.
88. Folsom AR, Anderson JP, Ross JA. Estrogen replacement therapy and ovarian cancer. Epidemiology 2004; 15: 100– 104.
89. Riman T, Dickman PW, Nilsson S et al. Hormone replacement therapy and the risk of invasive epithelial ovarian cancer in Swedish women. J Natl Cancer Inst 2002; 94: 497–504.
90. Hempling RE, Wong C, Piver MS, Natarajan N, Mettlin CJ. Hormone replacement therapy as a risk factor for epithelial ovarian cancer: Results of a case–control study. Obstet Gynecol 1997; 89: 1012–1016.
91. Risch HA. Estrogen replacement therapy and risk of epithelial ovarian cancer. Gynecol Oncol 1996; 63: 254–257.
92. Sit ASY, Modugno F, Weissfeld JL, Berga SL, Ness RB. Hormone replacement therapy formulations and risk of epithelial ovarian carcinoma. Gynecol Oncol 2002; 86: 118– 123.
93. Anderson GL, Judd HL, Kaunitz AM et al. Effects of estrogen plus progestin on gynecologic cancers and associated diagnostic procedures. The Women’s Health Initiative Randomized Trial. JAMA 2003; 290: 1739–1748.
94. Chute CG, Willett WC, Colditz GA, Stampfer MJ, Rosner B, Speizer FE. A prospective study of reproductive history and exogenous estrogens on the risk of colorectal cancer in women. Epidemiology 1991; 2: 201–207.
95. Jacobs EJ, White E, Weiss NS. Exogenous hormones, reproductive history, and colon cancer. Cancer Causes Control 1994; 5: 359–365. Clinical appraisal of the WHI 93
96. Calle EE, Miracle-McMahill ML, Thun MJ, Heath CW Jr. Estrogen replacement therapy and risk of fatal colon cancer in a prospective cohort of postmenopausal women. J Natl Cancer Inst 1995; 87: 517–523.
97. Kampman E, Potter JD, Slattery ML, Caan BJ, Edwards S. Hormone replacement therapy, reproductive history, and colon cancer: A multicenter, case–control study in the United States. Cancer Causes Control 1997; 8: 146–158.
98. Troisi R, Schairer C, Chow W-H, Schatzkin A, Brinton LA, Fraumeni JF Jr. A prospective study of menopausal hormones and risk of colorectal cancer (United States). Cancer Causes Control 1997; 8: 130–138.
99. Fernandez E, La Vecchia C, Braga C et al. Hormone replacement therapy and risk of colon and rectal cancer. Cancer Epidemiol Biomarkers Prev 1998; 7: 329–333.
100. Paganini-Hill A. Estrogen replacement therapy and colorectal cancer risk in elderly women. Dis Colon Rectum 1999; 42:1300– 1305.
101. Grodstein F, Martinez E, Platz EA et al. Postmenopausal hormone use and risk for colorectal cancer and adenoma. Ann Intern Med 1998; 128: 705–712.
102. Chlebowski RT, Wactawski-Wende J, Ritenbaugh C et al. Estrogen plus progestin and colorectal cancer in postmenopausal women. N Engl J Med 2004; 350: 991–1004.
103. American Cancer Society. Cancer Facts & Figures 2003. [Cited February 2004.] Available from URL: https://www.cancer. org/docroot/STT/stt_0.asp.2004
104. Shumaker SA, Legault C, Rapp SR et al. Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women. The Women’s Health Initiative Memory Study: A randomized controlled trial. JAMA 2003; 289: 2651–2662.
105. Rapp SR, Espeland MA, Shumaker SA et al. Effect of estrogen plus progestin on global cognitive function in postmenopausal women. The Women’s Health Initiative Memory Study: A randomized controlled trial. JAMA 2003;289: 2663–2672.
106. Zandi PP, Carlson MC, Plassman BL et al. Hormone replacement therapy and incidence of Alzheimer disease in older women. The Cache County Study. JAMA 2002; 288: 2123–2129
CLIC AQUÍ Y DÉJANOS TU COMENTARIO