Hipertiroidismo durante el Embarazo: Enfoque y Manejo
*Orlando Restrepo Ochoa.
Resumen
Se hace una revisión de la enfermedad de Graves, causa más común del hipertiroidismo durante la gestación. Se hace énfasis en el diagnóstico clínico y bioquímico del hipertiroidismo materno y fetal (cordocentesis), en la asesoría preconcepcional y en el resultado materno – fetal. Finalmente, se proponen las guías de seguimiento para la medición de los anticuerpos contra el receptor de TSH (TSHRAb) durante la gestación y se analizan las diferentes modalidades terapéuticas.
Palabras Claves: Hipertiroidismo, tiroxina, anticuerpos, propiltiouracilo, metimazol, propranolol, remisión, recaída.
Summary
This is a review of Graves disease, the most common cause of hyperthyroidism during pregnancy. I emphasize in clinical and biochemical diagnosis of maternal anf fetal (cordocentesis) hyperthyroidism, in prepregnancy counseling and in maternal – fetal outcome. Finally, I propose the guidelines for measurement of anti-TSH receptor antibodies (TSHRAb) during pregnancy and I analize the different therapeutic modalities.
Key Words: Hyperthyroidism, thyroxine, antibodies, propylthiouracil, methimazole, propranolol, remission, relapse.
Introducción
La primera descripción de un paciente con tirotoxicosis severa fue hecha por Parry en 1786; luego Graves (1835) y Von Basedow (1840) describen la papera maligna difusa, conocida hoy como enfermedad de Graves o Bocio Difuso Tóxico, la cual cursaba con insuficiencia cardíaca y taquicardia auricular, 2 de las principales complicaciones de la tirotoxicosis1.
Las enfermedades tiroideas son comunes durante los años reproductivos de la mujer; igualmente, la disfunción tiroidea puede afectar no sólo la capacidad de la mujer para embarazarse, sino también la evolución de la gestación ya establecida, la salud fetal y la condición materno-neonatal en el posparto. Por otra parte, el embarazo puede alterar la evolución de la enfermedad tiroidea autoinmune.
Del conocimiento de la función tiroidea en la paciente normal, de los cambios anatomofisiológicos de la tiroides durante la gestación y fisiopatológicos en el hipertiroidismo, depende el diagnóstico acertado y el manejo correcto del hipertiroidismo durante el embarazo y el período posparto2.
Definición
El término hipertiroidismo se refiere a un aumento de la función de la glándula tiroides. La tirotoxicosis hace relación a los cambios bioquímicos y fisiológicos que resultan del aumento de la hormona tiroidea en el organismo, el cual puede deberse a una hiperfunción de la glándula o ser secundaria a otras causas.
Frecuencia
La enfermedad de Graves afecta el 1,9% de la población femenina y una décima parte de esa cifra de varones, según un estudio de población hecho en Inglaterra. Su frecuencia máxima ocurre durante la tercera y cuarta décadas de la vida, con una predilección de 7 a 1 a favor de las mujeres1. La frecuencia del hipertiroidismo durante el embarazo es de 2 x 1.000. Por otra parte, la tiroxicosis fetal ocurre en el 1% de los niños nacidos de una mujer con historia de enfermedad de Graves o tiroiditis de Hashimoto2-3; para Orgiazzi, se observa hipertiroidismo feto-neonatal en el 2% a 10% de gestaciones de madres con enfermedad de Graves previa o actual debido al paso transplacentario de anticuerpos maternos4.
Etiología
La enfermedad de Graves es la causa más frecuente de hipertiroidismo durante el embarazo, ocasionando más del 85% de todos los casos; el resto es producido por bocios nodulares tóxicos, tanto multinodulares como únicos y por tiroiditis subaguda y posparto, tal como puede observarse en el cuadro 1.
Ahora, debemos recordar que diversos medicamentos pueden alterar la función tiroidea mediante mecanismos diferentes (ver cuadro 2)3.
Fisiopatología
La causa más común de hipertiroidismo es la enfermedad de Graves, y a ella se refiere básicamente este artículo. Este desorden autoinmune se caracteriza por la producción de anticuerpos contra el receptor de TSH (TSHRAb), los cuales activan dichos receptores en la superficie de las células tiroideas y estimulan la síntesis de coloide y de hormonas tiroideas. Estos anticuerpos IgG son elaborados por los linfocitos B, suelen ser policlonales y pueden estimular o inhibir el receptor, según la naturaleza de su interacción con el sitio receptor. Cuando se usa el tejido tiroideo humano como modelo experimental, los parámetros medidos son:
La estimulación de la síntesis de gotas de coloide o la producción de AMP cíclico en el caso de los anticuerpos estimulantes de la tiroides (TSAb) o
La inhibición de la TSH a sus receptores en el tejido tiroideo humano, en el caso de las inmunoglobulinas inhibidoras de la unión de la TSH (TBII).
La desaparición de los factores estimulantes del suero con el tratamiento antitiroideo, predice una remisión prolongada tras la suspensión de la medicación4, 6.
La enfermedad de Graves se caracteriza por exacerbaciones y remisiones de larga duración y se distingue por tres manifestaciones clínicas principales que son: bocio difuso, la oftalmo y la dermopatía, las cuales aparecen en asociación y frecuencia variables, además de los síntomas hipermetabólicos e hiperadrenérgicos. Su causa última se desconoce, los factores genéticos son importantes y participa el complejo mayor de histocompatibilidad (HLA); así, se ha detectado una frecuencia mayor de los haplotipos HLA-B8 y DRW3 en la raza blanca, HLA-BW36 en los japoneses y HLA-BW46 en los pacientes chinos con la enfermedad. Lo anterior significa que hay una predisposición genética a sufrir la enfermedad; además, los familiares de pacientes con enferme
dad de Graves pueden presentar también enfermedad de Hashimoto, hipotiroidismo tiroprivo primario, anemia perniciosa, miastenia gravis y otras enfermedades autoinmunes1-7.
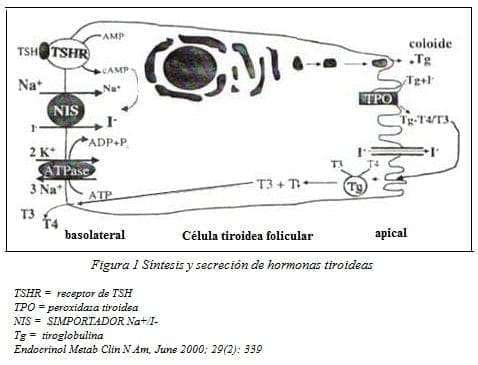
Síntesis de Hormonas Tiroideas
Las hormonas tiroideas se sintetizan y almacenan como residuos de aminoácidos de tiroglobulina, proteína que constituye la mayor parte del coloide folicular de la tiroides. La síntesis y secreción de hormonas tiroideas se puede dividir en 5 etapas secuenciales (ver figura 1)8-9.
1. Captación de yoduro: esta primera etapa consiste en el transporte activo del yoduro hasta la célula tiroidea, un proceso que es mediado por una proteína situada en la membrana plasmática de estas células y que recibe el nombre de “simportador” Na+/I-. Este proceso ocurre a una velocidad tal que supera la difusión pasiva del yoduro fuera de la glándula, estableciéndose un gradiente de presión para el yoduro de 25 (cociente concentración tiroidea/plasmática) que puede llegar a 500 o más en condiciones fisiopatológicas.
2. Oxidación y yodación: bajo la acción de peroxidasas intratiroideas, esta etapa comprende la oxidación del yoduro a una forma de valencia más alta, capaz de yodar los residuos tirosilo de la tiroglobulina, proceso llamado de organificación, para formar monoyodotirosina (MIT) y diyotirosina (DIT).
3. Acoplamiento: consiste en el apareamiento oxidativo de las yodotirosinas, también mediado por la peroxidasa tiroidea, para formar yodotironinas: tiroxina (T4) y 3, 5, 3′ – triyodotironina (T3) principalmente.
4. Secreción: las yodotirosinas y las yodotironinas permanecen unidas a la tiroglobulina. Las hormonas activas se liberan a la sangre mediante pinocitosis de la sustancia coloidal folicular en el borde apical de las células. Durante este proceso se forman las gotas coloidales que se unen con los lisosomas tiroideos formando “fagolisosomas”. La tiroglobulina es hidrolizada por las proteasas y peptidasas dentro de los fagolisosomas y finalmente hay liberación de T4 y T3 libres hacia la sangre.
5. Conversión de T4 en T3 en los tejidos periféricos: la producción diaria de T4 varía entre 70 y 90 mcg y la de T3 entre 15 y 30 mcg. El principal sitio de conversión de T4 en T3 fuera de la tiroides, es el hígado.
Función Tiroidea Materna durante la Gestación
La gestación produce cambios hormonales complejos y aumento de las demandas metabólicas; igualmente, durante el embarazo se altera la producción, circulación y distribución de las hormonas tiroideas. De ahí que para definir los cambios normales en los estudios de función tiroidea, se debe tener en cuenta la etapa específica del embarazo; así por ejemplo, las alteraciones que ocurren durante el primer trimestre, sirven para garantizar un aporte adecuado de hormona tiroidea para el desarrollo fetal, antes de que madure su propio tiroides10-11.
Bocio y metabolismo del yodo: un agrandamiento leve de la tiroides puede ocurrir como resultado de hiperplasia glandular y aumento de la vascularización; la presencia de bocio franco es patológica y puede deberse a una deficiencia de yodo, o en regiones con alta ingesta del mineral, a enfermedad tiroidea3, 12-13.
La depuración renal del yodo aumenta precozmente en el embarazo, continúa alta hasta el término y se normaliza a las 6 semanas posparto. Lo anterior, sumado al aumento de la filtración glomerular y a la hemodilución, podrían producir una deficiencia del mineral, si no fuera compensado por el crecimiento glandular tanto metabólica como estructuralmente. Durante el embarazo se requieren 250 mcg al día de yodo por vía oral, el cual se absorbe en el tubo digestivo como yoduro. Recordar que la deficiencia de yodo produce hipotiroidismo materno y fetal, lo cual provoca una deficiencia neurológica grave; igualmente, la ingesta excesiva del mineral (más de 2.000 mcg/día) puede producir bocios fetales gigantes y obstrucción traqueal neonatal, hipotiroidismo congénito pasajero, retardo mental y muerte fetal14.
Metabolismo de las hormonas tiroideas: la secreción normal de la glándula tiroides contiene 80% de levotiroxina (LT4) y 20% de T3, y a nivel tisular, mediante las deiodinasas tipo I a III, se transforma la T4 en T3, de acuerdo con las necesidades de los tejidos; no olvidar que la T3 es la hormona metabólicamente activa. La sulfatación hepática o la formación de glucurónidos de metabolitos de hormona tiroidea permite su excreción por los riñones o la bilis.
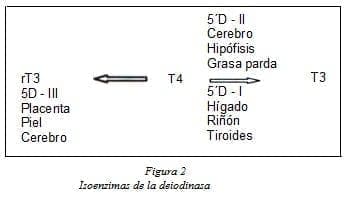
Según el sitio donde actúan se conocen 3 tipos de deiodinasas: 5′ – deionidasas fenólicas (tipo I y II) en el anillo exterior, y 5 – deiodinasas tirosílicas tipo III, en el anillo interior (ver figura 2)8. La mayor parte de la T3 (80%) se deriva de la conversión periférica de T4 a T3 por la enzima 5’D – I. Los tejidos con más alto contenido de esta enzima son el hígado, los riñones y la tiroides.
Factores como el ayuno, los glucocorticoides, los medios de contraste yodados, altas dosis de propranolol y el propiltiouracilo inhiben la actividad de esta enzima. La 5’D – I requiere del oligoelemento selenio; por tanto es necesario una dieta rica en yodo y selenio para obtener una adecuada producción de hormona tiroidea y evitar la formación de bocio10.
La 5D – II se encuentra principalmente en el cerebro, la hipófisis y la grasa parda, aportando selectivamente T3 a estos tejidos; su actividad aumenta durante el hipotiroidismo y es resistente al propiltiouracilo. La 5D – III convierte T4 en el metabolito biológicamente inactivo rT3 y transforma la T3 en T2, la cual también es inactiva. La T3 estimula la actividad de la 5D – III, la cual se halla en el cerebro, piel y placenta y su actividad se incrementa cuando aumenta la masa placentaria.
El eje hipotálamo – hipófisis – tiroides fetal y el desarrollo y maduración del feto, son independientes de la madre, pero depende del sistema placentario de ella para el abastecimiento del yoduro; éste se obtiene del plasma materno y de la desiodinización placentaria de T4. Por tanto, se dice que la 5D – III juega un papel homeostático importante en la protección cerebral y quizás también en el hipertiroidismo fetal: con el yodo resultante de la desiodinización y la TRH, el feto construye su propia hormona tiroidea15-17.
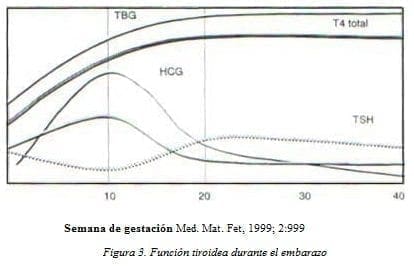
Pruebas de función tiroidea: el primer cambio y el más notable es un aumento en la concentración sérica de globulina fijadora de tiroxina (TBG) inducido por la mayor producción de estrógenos. Esta TBG fija el 70% de T4 y T3; el resto de la hormona tiroidea se une a la prealbúmina o transtiretina y una pequeña fracción a la albúmina. La TBG aumenta desde la segunda semana de gestación, se eleva linealmente hasta las 20 semanas y luego permanece estable hasta el parto, regresando a lo normal a las 6 semanas posparto (ver figura 3)3.
El aumento de la TBG, lleva a un incremento de la T4 y T3 totales en suero, pero la fracción libre de T4 y T3 es normal, pudiendo aumentar un poco en el primer trimestre y disminuir ligeramente en el tercero. Sólo la fracción libre es metabólicamente activa y representa 0,02% de la concentración total de T4 y 0,30% de la concentración total de T3; esta fracción libre regula la producción de hormona tiroidea por retroalimentación en el eje hipotálamo – hipofisiario10, 16.
La concentración de TSH disminuye en el primer trimestre, coincidiendo con los valores más altos de la gonadotropina coriónica humana (HCG). En Bélgica, se observaron 606 mujeres en un estudio de pruebas de función tiroidea seriadas
que incluían análisis de alta sensibilidad; dicho estudio mostró lo siguiente: la concentración sérica de TSH fue menor en el primer trimestre en comparación con los otros dos y un porcentaje importante de las 606 mujeres tuvo supresión de la TSH. Además, la concentración sérica de T4 libre fue significativamente más alta en el primer trimestre que en el segundo y tercero, lo que refuerza lo dicho antes, de que la T4 libre juega papel importante en el desarrollo fetal normal.10
La concentración sérica de tiroglobulina (Tg) se aumenta durante la gestación; los niveles del primer trimestre se elevan por encima de lo normal y el incremento más grande se observa en el tercer trimestre.
Interacciones Materno-Placentario- Fetales
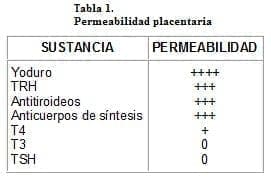
La tiroides fetal sintetiza hormona tiroidea entre las 10 y 12 semanas de gestación. El sistema hipolálamo – hipófisis fetal puede sintetizar hormona liberadora de tirotropina (TRH) y TSH desde las 8 – 10 semanas de embarazo; igualmente, las comunicaciones vasculares entre el hipotálamo y la hipófisis aparecen entre las 11 y 12 semanas16. La placenta es libremente permeable a la TRH, anticuerpos tipo IgG y a drogas antitiroideas como el propiltiouracilo (PTU), el metimazol (MTZ), el yodo y el propranolol;3, 10 es impermeable a TSH y a T3 y deja pasar pequeñas cantidades de T4 (ver tabla 1)18. El estado tiroideo de la madre y las pequeñas cantidades de hormonas tiroideas que atraviesan la placenta, tienen importancia para la madurez cerebral fetal. Igualmente, los neonatos hipotiroideos lucen bien al nacer debido a que la madre les transfirió T4 en cantidad suficiente para prevenir las manifestaciones del hipotiroidismo fetal; la T4 materna normal puede compensar la insuficiente producción de la hormona tiroidea fetal, pero en caso de insuficiencia materno – fetal, es probable que se presenten anormalidades neurológicas. Después del nacimiento, cuando ya no está disponible la T4 materna, se desarrolla el hipotiroidismo y causa deficiencias cognitivas si no se da tratamiento10.
Diagnóstico
Se hace con el cuadro clínico que es característico y con las mediciones de TSH, T4 y T3 libres. Veamos:
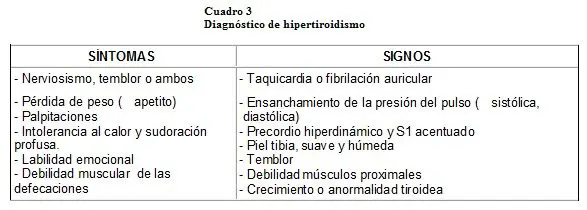
1. Clínico: casi todos los síntomas y signos de la tirotoxicosis se derivan de la producción excesiva de calor, del incremento de la actividad motora y del aumento de la función del sistema nervioso simpático. En el cuadro 3, se pueden observar los síntomas y signos más comunes.
No es raro que haya oligomenorrea seguida de amenorrea. Aún cuando el diagnóstico se establezca durante el embarazo, los síntomas lo anteceden por muchos meses. Ahora, si bien el embarazo normal genera cambios parecidos a los que ocurren en el hipertiroidismo, los siguientes síntomas y signos deben hacernos sospechar el diagnóstico de la enfermedad tiroidea: pulso > 100 latidos/minuto y taquicardia con ritmos ectópicos, miopatía proximal, mixedema pretibial, osteoporosis, hipocratismo digital, una presión diferencial > 50 mmHg, frecuencia del pulso anormalmente elevada durante el sueño, tiroidomegalia, exoftalmos y el no aumento de peso a pesar de una ingesta normal o aumentada1, 8, 10, 12. En otros casos la paciente sufre preeclampsia grave o aún insuficiencia cardíaca congestiva, cuyas causas no se distinguirán mientras no se ordenen pruebas de función tiroidea.
Las alteraciones de la función cardiovascular constituyen una de las características más notables: la resistencia vascular periférica está disminuida durante el reposo, hay aumento del gasto cardíaco debido al incremento del volumen sistólico y la frecuencia cardíaca, taquicardia > de 100 latidos por minuto, presión del pulso ensanchada, soplo sistólico o presistólico sobre la punta del corazón, fibrilación en el 10% de las pacientes e insuficiencia cardíaca.
Es común observar signos oculares debido al exceso de catecolaminas; estos signos son independientes de la oftalmopatía causada por la enfermedad de Graves, observándose: retracción del párpado superior y mirada fija y brillante. Ahora, la oftalmopatía infiltrante es específica de la enfermedad de Graves, afecta del 30% al 50% de las pacientes, siendo rara su forma grave; los síntomas principales son irritación ocular, fotofobia y lagrimación excesiva. En casos graves puede haber mirada doble, subluxación del globo y ulceración de la córnea con papiledema y pérdida de la visión; puede observarse quemosis y exoftalmos.
En el 5% de las pacientes se observa mixedema pretibial o dermopatía infiltrante. En un pequeño grupo de pacientes con enfermedad de Graves, hay signos oculares con o sin mixedema pretibial, pero sin hipertiroidismo; lo anterior, puede deberse a destrucción de la tiroides por una enfermedad de Hashimoto coexistente o a retraso en la aparición del hipertiroidismo.
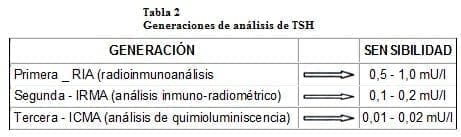
2. Bioquímico: los niveles normales de TSH en suero son de 0,5 a 5 mU/ml y el hipertiroidismo cursa con valores menores de 0,1 mU/ml; el rango entre 0,1 y 0,5 mU/m, corresponde a diferentes grados de alteración del eje hipotálamo – hipofisiario y se da en pacientes con una función tiroidea autónoma. Hoy en día los análisis de segunda y tercera generación para medir TSH, tienen una excelente sensibilidad, tal como puede observarse en la tabla 2.
Para medir la T3L y la T4L se utilizan métodos ultrasensibles de RIA. El término de tirotoxicosis por T3 se refiere a un aumento de la T3 sin incremento de la T4, siendo la fibrilación auricular frecuente en estos casos6, 9.
Por tanto, según la interpretación de los resultados de las pruebas de función tiroidea, tendremos:
| Hipertiroidismo clínico: | SH disminuida o suprimida T4L, T3L o ambas aumentadas |
| Hipertiroidismo subclínico: (incipiente) |
Ausencia de síntomas TSH disminuida T4L y T3L normales |
La prueba de estimulación con TRH mostrará una respuesta de la TSH baja o abolida en el hipertiroidismo y aumentada en el hipotiroidismo.
Otros hallazgos de laboratorio son: hipercalcemia en el 27% de las pacientes, aumento de la fosfatasa alcalina de origen óseo en un número importante de ellas, leucopenia por disminución de neutrófilos con linfocitosis relativa. Las plaquetas y los factores de coagulación son normales. No olvidar que a veces coexisten el hipertiroidismo y el hiperparatiroidismo.
Anticuerpos antitiroideos: los anticuerpos contra el receptor de TSH (TSHRAb) han sido asociados históricamente a la enfermedad de Graves y contrariamente a los otros anticuerpos antitiroideos, ellos son fisiopatológicos, con la capacidad de activar o bloquear las funciones del receptor de TSH. Se encuentran TSHRAb en el 70% a 100% de las pacientes con enfermedad de graves; la prevalencia es usualmente más alta para TSAb (85% a 100%) que para TBII (75% a 96%)4.
Otros anticuerpos que con frecuencia se elevan en la enfermedad de Graves incluyen: los anticuerpos antiperoxidasa o antimicrosomales (TPO-Ac), los anticuerpos anti-tiroglobulina (TGB-Ac) y los recientemente identificados anticuerpos anti-simportador Na+/I- (proteína que media el transporte activo del yoduro durante la síntesis de hormona tiroidea). Se detectan TPO-Ac en el 3% de las mujeres no embarazadas y entre el 5% y el 20% de las embarazadas; la presencia sérica de TPO-Ac indica enfermedad tiroidea o una alta probabilidad de que ésta se encuentre en desarrollo. Su positividad al inicio del embarazo se relaciona con desarrollo de tiroiditis posparto en el 50% de las madres; igualmente incrementan la presentación de aborto espontáneo3-4, 10, 20.
Las indicaciones para solicitar los TSHRAb durante la gestación, con el fin de pronosticar la posibilidad de disfunción tiroidea fetal o neonatal, son2:
Hipertiroidismo fetal o neonatal en gestaciones anteriores
Enfermedad de Graves activa con terapia antitiroidea
Estado eutiroideo, después de ablación o remisión, si hay:
– Taquicardia fetal
– Retardo de crecimiento intrauterino (RCIU)
– Bocio fetal diagnosticado por ultrasonido
*Orlando Restrepo Ochoa. Profesor del Grupo de Perinatología. Departamento de Obstetricia y Ginecología. Facultad de Medicina. Universidad de Antioquia.
Recibido: Abril 18/2001 – Revisado: Julio 17/2001 – Aceptado: Octubre 2/2001
Asesoría Preconcepcional
No se ha definido cuál es la mejor forma de tratamiento del hipertiroidismo en pacientes que desean embarazarse; la elección depende de la experiencia del médico y de la forma en que la mujer entienda las ventajas y desventajas de cada método. Deben analizarse las modalidades de tratamiento con la paciente y su familia, lo mismo que las complicaciones que cada método produce a corto y a largo plazo en la madre, el feto y el neonato.
Las pacientes no embarazadas con enfermedad de Graves, se pueden tratar de 3 maneras2:
Con fármacos antitiroideos (FAT) a largo plazo (12 a 24 meses), logrando la remisión de la enfermedad en el 20% a 50% de los casos; las pacientes que tienen mayor probabilidad de remisión son aquellas que han padecido la enfermedad por corto tiempo, tienen bocios pequeños y no presentan oftalmopatía.
Ablación de la glándula tiroides con I-131, método preferido por los endocrinólogos de Estados Unidos, y
Resección quirúrgica de casi todo el tejido tiroideo, siendo la menos utilizada. La principal complicación de la ablación a largo plazo es el hipotiroidismo permanente, el cual es un trastorno benigno.
La medicación tiroidea no afecta al feto ni al neonato durante el embarazo; igualmente, no hay pruebas de que el tratamiento radiactivo que se administra a la mujer antes de embarazarse tenga efectos adversos sobre el feto o el niño en etapas posteriores de la vida. No obstante, se recomienda obtener el estado eutiroideo antes de la concepción y evitar el embarazo en los 6 meses posteriores al tratamiento con I-131.
Por último, es necesario informar a los futuros padres que las dosis de los FAT deben ajustarse con frecuencia durante el embarazo y que el bocio fetal y el hipotiroidismo neonatal son causados por dosis excesivas de ellos; igualmente, que los FAT no causan malformaciones congénitas y que existe posibilidad de desarrollar tiroiditis posparto o recurrencias del hipertiroidismo.
Resultado del Embarazo
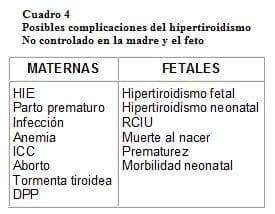
Los resultados maternos y fetales dependen directamente del control del hipertiroidismo. En general, las pacientes a quienes se les hizo el diagnóstico al comienzo del embarazo, las que ya recibían atención para controlar la tirotoxicosis cuando concibieron y aquellas en quienes se inició pronto el tratamiento, tuvieron pronósticos excelentes, lo mismo que sus neonatos. Las complicaciones materno-fetales aumentan significativamente en las mujeres que permanecen hipertiroideas en la segunda mitad de la gestación (ver cuadro 4)16.
Recordar que en el embarazo, la evolución natural del hipertiroidismo de Graves se caracteriza por agravamiento de los síntomas durante la primera mitad de la gestación, con mejoría durante la segunda y recurrencia en el período posparto. Por ello, los FAT pueden reducirse marcadamente o incluso suspenderse en la mayoría de las pacientes, sin que se presenten recaídas de la enfermedad. No obstante, en el 10% de las pacientes no se observa mejoría, necesitando altas dosis de estos agentes. Igualmente, al avanzar la gestación, hay disminución de los anticuerpos antitiroideos, tanto de los TPO-Ac como de los TSHRAb.
El tiroides fetal es afectado por los FAT y por los TSHRAb, los cuales pasan fácilmente la barrera placentaria. Así, el tratamiento con FAT conlleva el riesgo de hipotiroidismo fetal y bocio si no es manejado apropiadamente; igualmente, el hipertiroidismo feto-neonatal es observado en el 2% a 10% de los embarazos de madres con enfermedad de Graves previa o actual y está asociado con niveles altos de TSHRAb maternos. Lo anterior representa un grave problema, con una rata de mortalidad neonatal de 16% y el riesgo de muerte intrauterina y desarrollo de anomalías esqueléticas, incluyendo cráneosinostosis. Según Mitsuda21 son factores de riesgo para trastornos del crecimiento fetal y de la función tiroidea neonatal, los siguientes: antecedentes de enfermedad de Graves por más de 10 años, tirotoxicosis materna durante 30 semanas o más del embarazo, inicio de la enfermedad antes de los 20 años de edad y tener concentraciones de TSHRAb maternos de 30% o más al momento del parto.
Ahora, en la mayoría de los casos, los niños con hipertiroidismo neonatal tienen una alteración transitoria que dura de uno a cinco meses. Se ha calculado que la vida media de los TSAb oscila entre 5 y 14 días; sin embargo, puede presentarse enfermedad de Graves neonatal de comienzo retardado (dos a cuatro meses de edad), posiblemente debido a interacciones entre los TSAb y un inhibidor tiroideo7.
Recientemente, las siguientes guías de seguimiento para la medición de los TSHRAb durante la gestación, han sido propuestas en la literatura americana y europea4:
En mujeres con antecedentes de enfermedad de Graves en remisión después del tratamiento con FAT, el riesgo para hipertiroidismo feto-neonatal es insignificante, no siendo necesaria la medición sistemática de los TSHRAb. La función tiroidea debe ser evaluada durante el embarazo para detectar una improbable pero posible recurrencia. En este caso, el análisis de los TSHRAb sería mandatorio.
En la mujer con antecedente de enfermedad de Graves previamente tratada con yodo radiactivo o tiroidectomía, y a pesar del estado tiroideo actual, eutiroidismo con o sin sustitución de tiroxina, los TSHRAb deben ser medidos tempranamente en el embarazo para evaluar el riesgo para hipertiroidismo fetal, ya que la producción de los TSHRAb puede persistir por varios años después del tratamiento ablativo. Si el nivel es alto, es mandatorio un monitoreo cuidadoso del feto para la detección temprana de signos de sobrestimulación tiroidea como: pulso > 170 latidos/minuto, oligoamnios, RCIU y bocio. Las medidas por ultrasonido de la tiroides fetal son posibles desde las 20 semanas de gestación, pero se requiere de un ecografista bien entrenado, ya que la visualización tiroidea puede ser impedida debido a la posición de la cabeza fetal. El ultrasonido con Doppler a color es útil en la evaluación de la hipervascularización tiroidea. El diagnóstico de hipertiroidismo fetal puede realizarse intrauterinamente mediante cordocentesis; ésta es factible desde las 25 semanas de gestación, con menos de 1% de efectos adversos (hemorragia fetal, bradicardia, infección, aborto espontáneo y muerte intraútero) en centros con experiencia. En este caso, la administración de FAT a la madre, debe ser considerada para tratar el hipertiroidismo fetal.
En la mujer con enfermedad de Graves hipertiroidea actual, sin importar si ella precede al comienzo del embarazo, el tratamiento con FAT debe ajustarse para mantener la T4L en el límite superior normal para prevenir el hipotiroidismo fetal. Los TSHRAb deben ser medidos a comienzos del último trimestre, especialmente si la dosis de FAT requerida es alta. Si el ánalisis de los TSHRAb es negativo, el hipertiroidismo feto-neonatal es improbable. Si los niveles de anticuerpos son altos (TBII ³ 40 U/l o TSAb ³ 300%), la evaluación del feto para hipertiroidismo es mandatoria. En aquellos casos en los cuales una dosis alta de FAT (> 300 mg de PTU o > 20 mg de MTZ) es necesaria, hay un riesgo de hipotiroidismo bociógeno en el feto, el cual puede ser indistinguible del bocio de la enfermedad de Graves. El diagnóstico correcto depende del análisis de las hormonas tiroideas y de la TSH fetales mediante cordocentesis, lo que permitirá un adecuado tratamiento.
En la mujer que previamente ha dado nacimiento a un niño con hipertiroidismo, los análisis de los TSHRAb deben ser determinados tempranamente en el embarazo. Cuando el nivel de los TSHRAb es significativo durante la gestación tardía, los TSHRAb deben ser determinados en sangre del cordón en el recién nacido y luego cada 7 a 10 días durante 2 a 4 meses, con el fin de monitorizar la duración y la dosis del tratamiento con FAT.
Tratamiento
Es recomendable que el manejo lo haga un equipo interdisciplinario conformado por obstetra, endocrinólogo, perinatólogo, neonatólogo y anestesiólogo. Al realizar el diagnóstico de enfermedad de Graves en una embarazada, el médico puede enfrentarse a las siguientes situaciones clínicas:
- La paciente está bajo tratamiento con FAT.
- El diagnóstico inicial del hipertiroidismo se realiza durante el embarazo.
- Hay antecedentes de hipertiroidismo tratado con ablación.
- Hay hipertiroidismo en remisión después de usar FAT y
- Hay antecedentes de un lactante con disfunción tiroidea.
En cada caso clínico la decisión terapéutica se basa en un interrogatorio médico minucioso, en los antecedentes obstétricos, en los signos observados al examen físico y en la adecuada interpretación de las pruebas de laboratorio. En la primera consulta prenatal debe delinearse un plan terapéutico, el cual se comentará con la paciente y su familia. Como se dijo antes, el pronóstico materno-fetal es excelente cuando el diagnóstico y el tratamiento se establecen en las primeras semanas de la gestación. La mayoría de los autores prefieren el tratamiento médico con FAT; en algunos casos se recomienda la adición de bloqueadores beta – adrenérgicos y a veces yoduros, durante un tiempo corto. Se reserva la tiroidectomía subtotal para casos seleccionados, veamos:
Farmacoterapia antitiroidea1,3-6, 10: el tratamiento médico del hipertiroidismo se hace a base de tionamidas, siendo los medicamentos más utilizados el propiltiouracilo (PTU) y el metimazol (MTZ). Estos fármacos inhiben la organificación del yodo y bloquean el acoplamiento de las yodotirosinas para formar yodotironinas, lo que inhibe la formación de hormonas tiroideas. Hoy se sabe que en realidad lo que ocurre, es que las tionamidas bloquean la peroxidasa, lo cual evita la oxidación del yoduro o de los grupos tirosilo hacia el estado activo requerido; las tionamidas no inhiben la liberación de hormona tiroidea preformada. El PTU inhibe la conversión periférica de T4 a T3, lo que le da una ventaja terapéutica sobre el MTZ. La vida media del PTU es de más o menos una hora y la del MTZ es de 6 a 8 horas; igualmente, el MTZ es 10 a 15 veces más potente que el PTU, pero este último se une a las proteínas plasmáticas mucho más que el MTZ, lo que hace que la placenta sea más impermeable al PTU. Por lo anterior, el PTU debe administrarse cada 8 horas, mientras que el MTZ ha de tomarse 1 ó 2 veces al día. El MTZ (tapazol) se administra en tabletas de 5 y 10 mg, en tanto que el PTU (tirostat) se da en tabletas de 50 mg, lo que hace que la paciente se apegue menos fácil al régimen de PTU.
La respuesta clínica a las dos drogas es similar y el tratamiento sólo requiere pocas semanas (dos- seis) para lograr la normalización de las pruebas de función tiroidea. La dosis inicial es de 150 mg de PTU cada 8 horas o de 20 mg de MTZ 2 veces/día, pero la dosis puede variar según la sintomatología. Las pacientes que tienen bocios grandes, enfermedad de larga duración o son más sintomáticas, requieren dosis mayores y responden menos rápido a la droga. El aumento de peso y la disminución en la frecuencia del pulso, son excelentes signos de buena respuesta.
La concentración de T4L es la mejor prueba para observar la respuesta a los FAT. La concentración de T3L es inadecuada para ajustar la dosis de los FAT, ya que no existe correlación entre los niveles de T3L maternos y las concentraciones de T4L o T3L en sangre del cordón. Por otra parte, las concentraciones séricas de TSH maternas permanecen suprimidas durante varias semanas o meses después de normalizarse la concentración de T4L; por lo tanto, no conviene basarse en la TSH sérica durante los primeros 2 meses de terapia con FAT. La normalización de la TSH, es un buen indicador de la respuesta al tratamiento, a la vez que permite disminuir la dosis de los FAT y aún descontinuarlos en las últimas 6 semanas de gestación. Se debe determinar la TSH sérica en la primera consulta prenatal, en pacientes que toman FAT, con el fin de ajustar la dosis de ellos.
Tan pronto mejoren los resultados de las pruebas de función tiroidea, la dosis de los FAT se reduce a la mitad; si continúa la mejoría de los resultados y de la sintomatología, se puede reducir aún más la dosis: en casi el 30% de las pacientes hipertiroideas es posible descontinuar los FAT entre las 32 y 36 semanas; no se recomienda antes con el fin de evitar recaídas. Igualmente, se puede descontinuar el tratamiento cuando la paciente ha permanecido eutiroidea con pequeñas dosis de FAT (50 a 100 mg de PTU o 5 a 10 mg de MTZ) durante algunas semanas. No necesitan tratamiento las pacientes asintomáticas o con pocos síntomas, las que tienen ligeros aumentos de T3 y/o T4 libres y las que aumentan normalmente de peso.
El objetivo terapéutico consiste en normalizar el estado metabólico en el menor tiempo posible, prevenir las complicaciones maternas y evitar el hipo y el hipertiroidismo neonatal. Inicialmente, se debe revisar a la paciente cada 2 semanas y realizar pruebas de función tiroidea en cada consulta; luego se solicitarán éstas cada 4 semanas, hasta que la TSH se vuelva normal y la T4L se mantenga en el tercio superior normal con las dosis mínimas de FAT. Requieren hospitalización las pacientes con síntomas graves que no mejoran con los FAT y aquellas con manifestaciones clínicas importantes que se observan por primera vez en la segunda mitad de la gestación.
Se recomienda el tratamiento del hipertiroidismo subclínico (TSH suprimida y T4L y T3L normales) en los siguientes casos: presencia de bocio tóxico multinodular, adenoma tóxico >2,5 cm de diámetro y en pacientes mayores de 50 años. No olvidar que primero se debe descartar hipertiroidismo por T3L22. Con relación al hipotiroidismo subclínico (TSH alta y T4L normal) deben recibir tratamiento: las pacientes que tengan una TSH sérica >10 mU/ml. Si la TSH se encuentra entre 5 y 10 mU/ml, recibirán tratamiento las pacientes que presenten hiperprolactinemia, hipercolesterolemia, anticuerpos antitiroideos positivos o bocio14, 22.
Efectos secundarios: se presentan en el 5% de los casos e incluyen: eritema cutáneo, artralgias, fiebre, náuseas, sabor metálico y prurito (el cual puede ser síntoma del hipertiroidismo); estos efectos pueden resolverse por sí solos, aún sin descontinuar los FAT; es raro que haya sensibilidad cruzada, por lo cual el PTU se debe sustituir por MTZ o viceversa. La agranulocitosis ocurre en el 0,2% de las pacientes y es una complicación grave que no aparece con dosis de MTZ < 25 mg/día; la sintomatología es aguda e incluye fiebre, dolor de garganta, malestar general y gingivitis. Los cambios hematológicos se recuperan 7 a 10 días después de suspender la droga. Raramente, el PTU puede provocar daño hepatocecular y el MTZ, ictericia colestásica. El MTZ produce aplasia cutis congénita en el 0,03% de los neonatos, aunque algunas series grandes no han reportado esta complicación.
El tratamiento de la enfermedad de Graves con tionamidas se administra durante 6 a 18 meses, con el fin de disminuir las recaídas; la no reducción de la tiroides y de los títulos de TSHRAb durante la terapia predicen un alto grado de persistencia o recurrencia de la enfermedad. Los índices de recaída a largo plazo, después de la terapia con FAT, son de 14 a 80%2.
Tratamiento con tiroides y FAT: se ha propuesto su uso combinado bajo la hipótesis de que la hormona tiroidea que cruzara la placenta, evitaría el bocio y el hipotiroidismo neonatal. Los informes concluyen que la hormona tiroidea enmascara los resultados de las pruebas de función tiroidea, lo cual dificulta la predicción de la dosis mínima del tratamiento con FAT que se requiere para alcanzar el estado eutiroideo2.
Cirugía: es un tratamiento eficaz para controlar el hipertiroidismo, pero actualmente se utiliza poco durante el embarazo. Se reserva para pacientes que no mejoran con FAT, por falta de apego al tratamiento o alergia a ellos (suceso raro) o para los casos de bocio grande que requieren altas dosis de FAT, realizándola de preferencia durante el segundo trimestre. Después de ella es esencial lograr el estado eutiroideo; es recomendable determinar los títulos de TSHRAb en el momento de ejecutar la tiroidectomía subtotal: los títulos altos son indicativos y predictores del hipertiroidismo fetal; si se confirma este diagnóstico mediante cordocentesis, la administración de FAT a la madre (especialmente MTZ) es eficaz para controlar la taquicardia fetal y normalizar el crecimiento fetal10.
Bloqueadores beta-adrenérgicos: son muy eficaces para controlar síntomas de hipermetabolismo; se deben utilizar durante pocas semanas en combinación con los FAT, hasta que los síntomas desaparezcan. La dosis usual es de 20 a 40 mg de propanolol cada 6-8 horas, o 25 a 50 mg de atenolol 2 veces/día. Los síntomas disminuyen pocos días después de iniciado el tratamiento; la dosis se debe ajustar para mantener la frecuencia del pulso en reposo entre 70 y 90 latidos/minuto. Se utilizan como tratamiento único o como preparación para la tiroidectomía subtotal; en este último caso es necesario mantener el bloqueo beta-adrenérgico después de la cirugía, con el fin de evitar la crisis tiroidea. No se recomienda el tratamiento a largo plazo por su potencial de morbilidad neonatal (elevación de la frecuencia de abortos espontáneos, RCIU y depresión respiratoria)1, 3, 6, 10.
Yoduros: están contraindicados durante el embarazo debido a que producen bocio fetal e hipotiroidismo, pero la administración por períodos cortos en preparación para la cirugía o el tratamiento de la crisis tiroidea, no es peligrosa para el feto9.
Tratamiento con I – 131: la administración de yodo radiactivo está contraindicada durante la gestación, especialmente después de la semana 12, cuando la tiroides fetal ya puede concentrar yodo. La administración inadvertida durante el primer trimestre se relaciona con malformaciones congénitas e hipotiroidismo congénito; luego de la duodécima semana, producirá hipotiroidismo fetal1,3-6, 9.
Manejo según la Causa del Hipertiroidismo1-2, 23
- Enfermedad de Graves: lo antes anotado.
- Adenomas tóxicos: pueden ser únicos (enfermedad de Plummer) o múltiples (bocio tóxico multinodular). Estos no se acompañan de oftalmopatía o dermopatía infiltrativa; los anticuerpos antitiroideos casi nunca están presentes y los TSHRAb son negativos. El tratamiento a corto plazo no difiere del de las pacientes con enfermedad de Graves; el hipertiroidismo se maneja de manera sintomática con propranolol, pero el tratamiento definitivo es con cirugía o con yodo radiactivo (no en embarazo). El hipertiroidismo por bocio tóxico multinodular puede revertirse efectivamente con tionamidas, pero hay un índice de reincidencia de 95% después de suspenderlos.
- Tiroiditis subaguda: se debe a infección viral y se caracteriza por tiroides con crecimiento moderado y doloroso; si la glándula no es dolorosa, el trastorno se denomina “tiroiditis silenciosa”. Durante la fase de tirotoxicosis, el tratamiento se hace a base de propranolol y analgésicos hasta que ceda la enfermedad, por lo general varios meses después.
- Enfermedad de Jod Basedow o hipertiroidismo por yodo: puede ocurrir en pacientes con bocios multinodulares después de la ingestión de grandes cantidades de yodo, en especial en forma de materiales de contraste radiológico o medicamentos como la amiodarona. La supresión del yodo produce una recuperación completa.
- Tirotoxicosis ficticia: se debe a la ingestión de excesivas cantidades de hormona tiroidea exógena. Una variante poco común con epidemia de tirotoxicosis, se debe al consumo de carne molida contaminada con glándula tiroides de bovino. Con la suspensión de la hormona tiroidea exógena, mejorará la paciente.
- Estruma ovárico: el tejido tiroideo se encuentra en cerca del 3% de los tumores dermoides y teratomas ováricos. El tratamiento es quirúrgico.
- Tumores trofoblásticos secretores de HCG: el New England Trophoblastic Disease calcula que el 20% de las mujeres con molas completas padece hipertiroidismo. La eliminación quirúrgica produce rápidamente la cura del trastorno; el tratamiento del coriocarcinoma requiere quimioterapia adecuada. El propranolol y otros antagonistas adrenérgicos ayudan a controlar la taquicardia y otros síntomas simpáticos.
- Tiroiditis de Hashimoto: se presenta con hipertiroidismo transitorio durante la fase destructiva inicial; es frecuente en las mujeres posparto y el tratamiento es a base de propranolol.
- Tumor hipofisiario secretor de TSH: causa sumamente rara de hipertiroidismo; la TSH sérica es normal o alta (no suprimida), no hay oftalmopatía y los anticuerpos antitiroideos y los TSHRAb son normales. El tratamiento es la resección transesfenoidal del adenoma cuando esto es posible; tumores más grandes requieren radioterapia y en ocasiones bromocriptina u octreótido (análogo de la somatostatina de acción prolongada) por vía subcutánea. El hipertiroidismo se trata sintomáticamente con propranolol.
- Metástasis de carcinoma folicular de tiroides: este trastorno se diagnostica fácilmente y se trata con I – 131 (no durante la gestación).
Lactancia
Estudios en humanos demuestran que la cantidad de PTU excretada en la leche materna es muy pequeña: si la madre recibe 200 mg 3 veces al día, el lactante recibe ± 99 mcg/día; sólo el 0,077% de una dosis ingerida es excretada por la leche. El MTZ se excreta por la leche en concentraciones más altas, ya que no se une a las proteínas del plasma en el mismo grado que el PTU. Por tanto, se puede utilizar PTU en dosis divididas, administrando la dosis después de cada alimentación y vigilando de cerca a los lactantes con pruebas de función tiroidea frecuentes9.
Tormenta Tiroidea
La tormenta tiroidea (TT) es una urgencia médica que se caracteriza por una exacerbación aguda de los síntomas del hipertiroidismo y que se desarrolla en condiciones de estrés como infección grave, inducción anestésica, trabajo de parto, cirugía, síndrome de abstinencia de FAT o después del tratamiento con I -131 en pacientes con hipertiroidismo intenso.
El cuadro clínico incluye fiebre superior a 40°C, dolor abdominal y alteraciones del SNC como irritabilidad, temblor intenso, delirio, obnubilación y alteraciones del estado mental que van desde desorientación hasta psicosis o coma. Los síntomas cardiovasculares son muy notables e incluyen palpitaciones, signos de ICC y taquiarritmias que incluyen fibrilación auricular. Puede haber náuseas, vómito y diarrea.
Las pruebas de diagnóstico no son útiles, ya que la diferenciación con un hipertiroidismo grave no es fácil; otras pruebas de laboratorio son inespecíficas y muestran leucocitosis, enzimas hepáticas elevadas y en ocasiones hipercalcemia durante la gestación. La TT aparece en el 1% a 2% de todos los casos de tirotoxicosis, con una frecuencia mayor en quienes no reciben tratamiento. Por lo general este trastorno se inicia por HIE, placenta previa, ICC, infecciones e inducción del trabajo de parto. Si se va a realizar cirugía durante el embarazo, deben normalizarse las pruebas de función tiroidea mediante la administración de FAT antes del procedimiento, utilizando propranolol I.V. como coadyuvante de los FAT.
El tratamiento de la TT incluye medidas generales y específicas e internar a la paciente en la UCI. Veamos:
- Tratamiento del fenómeno precipitante si lo hay, incluso con análisis del LCR, si se sospecha enfermedad neurológica subyacente.
- Líquidos I.V. y multivitamínicos, para tratar el desequilibrio hidroelectrolítico, con vigilancia de la reserva cardiovascular.
- PTU, dosis de carga de 400 mg cada 6 horas por sonda nasogástrica o mediante supositorio rectal, para inhibir la síntesis de hormona tiroidea y bloquear la conversión de T4 a T3; luego se continúa con 150 a 300 mg cada 6 horas. Si hay alergia al PTU, se puede dar MTZ.
- Yoduro de sodio, 250 mg cada 6 horas o 500 mg cada 12 horas I.V. Si la paciente tolera la vía oral, se pueden administrar 30 a 60 gotas de solución de lugol al día en dosis divididas o solución saturada de yoduro de potasio, 3 gotas 3 veces/día por varios días. El yoduro evitará la liberación de la hormona tiroidea preformada, administrándolo 1 a 3 horas después de los FAT.
- Succinato sódico de hidrocortisona, 50 a 100 mg cada 6 horas IV o fosfato sódico de dexametasona, 8 mg/día en dosis divididas, eficaces para bloquear en forma aguda la conversión periférica de T4 a T3 y para evitar el desarrollo de insuficiencia adrenal aguda.
- Propranolol (en pacientes sin asma, bronquitis crónica o ICC) a la dosis de 10 a 40 mg cada 4 a 6 horas por vía oral o una venoclisis lenta de 1 mg/minuto durante 2 a 10 minutos, con vigilancia de la presión arterial y EKG. El propranolol puede precipitar edema pulmonar en algunos pacientes con hipertiroidismo; es útil para controlar la frecuencia del pulso.
- Enfriamiento externo y acetaminofén, 300 a 600 mg cada 4 a 6 horas para la hipertermia grave. Como medida adicional para controlar la hipertermia se recomienda bloqueo del SNC con 25 a 50 mg de cloropromacina y 25 a 50 mg de meperidina cada 4 a 6 horas. No usar salicilatos, ya que aumentan las hormonas tiroideas libres y el consumo de oxígeno.
- Glucósidos de la digital para tratar la ICC y bloquear una respuesta ventricular rápida a una taquiarritmia auricular.
- Oxígenoterapia, hemocultivos, cultivo de orina y otros cultivos necesarios. Considerar el uso de antibióticos de amplio espectro, al conocer los resultados de los cultivos.
- Vigilancia continua fetal después de las 24 – 28 semanas de gestación. Una vez corregida la crisis, es necesario mantener a la paciente hospitalizada hasta el parto o hasta que se normalicen las funciones metabólicas y cardiovasculares.
Con este enérgico tratamiento, la mortalidad se ha reducido a menos del 20%. La ablación con I – 131 o la tiroidectomía subtotal es recomendada luego del parto.
Bibliografía
1. Larsen PR. Tiroides. Enfermedad de Graves y otras causas de hipertiroidismo. En: Wyngaarden JB, Smith LH, Bennett JC. Tratado de Medicina Interna de Cecil. 19° edición. México. Editorial Interamericana 1994; (II): 1461-1468.
2. Mestman JH. Hipertiroidismo en el embarazo. Clin Obst Ginecol 1997; 1: 41-58.
3. Seely BL, Burrow GN. Thyroid Disease and Pregnancy. En: Creasy RK, Resnik R. Medicina Materno Fetal. 4 th edition. Philadelphia, Pennsylvania. W.B. Saunders Company 1999; 2: 996-1014.
4. Orgiazzi J. Autoinmune Thyroid Disease. Anti – TSH receptor antibodies in clinical practice. Endocrinol Metab Clin N Am. June 2000; 29(2): 339-355.
5. Irwin K, Becker DV, Levey GS. Treatment of hyperthyroid disease. Ann Inter Med. 1994; 221: 281-288.
6. Wartofsky L. Enfermedades del tiroides – Tirotoxicosis. En: Fauci AS, Braunwald E, Isselbacher KJ, Wilson JD, Martin JB, Kasper DL, Hauser SL, Longo DL. Principios de Medicina Interna de Harrison. 14° edición. México. Mc Graw – Hill. Agosto 1998; (II): 2299-2312.
7. Hollingsworth DR. Enfermedad de Graves. Clin Obst y Ginecol. 1983; 3: 745-770.
8. Farwell AP, Braverman LE. Fármacos tiroideos y antitiroideos. En: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW. Las bases farmacológicas de la terapéutica de Goodman y Gilman. 9° edición. México. Mc Graw _ Hill Interamericana. 1996; (II): 1469-1496.
9. Spitzweg C, Morris JC. Autoinmune Thyroid Disease. The inmune response to the iodide transporter. Endocrinol Metab Clin Am. June 2000; 29(2): 389-398.
10. Brent GA. Función tiroidea materna. Interpretación de pruebas de función tiroidea en el embarazo. Clin Obstet y Ginecol. 1997; 1: 3-14.
11. Burrow GN, Fisher DA, Larsen PR. Maternal and fetal thyroid function. N Engl J Med 1994; 331: 1072-1078.
12. Lowe TW, Cunningham FG. Embarazo y tiroidopatías. Clin Obst y Ginecol. 1991; 1: 69-77.
13. Whiteman VE, Mamopoulos M, Salameh WA. Endocrinopatías agudas durante el embarazo. Clin Obst y Ginecol. 1994; 1: 73-85.
14. Restrepo O. Enfoque y manejo de la embarazada hipotiroidea. Revista Colombiana de Obstetricia y Ginecología. Octubre – diciembre 1998; 49(4): 207-216.
15. Montoro MN. Tratamiento del hipotiroidismo durante el embarazo. Clin Obst y Ginecol. 1997; 1: 59-72.
16. Mestman JH, Goodwin TM, Montoro MN. Thyroid disorders of pregnancy. Endocrinol Metab Clin N Am. March 1995; 24(1): 41-71.
17. Koopdonk – Kool JM, de Vijider JJ, Veenboer GJ et al. Type II and type III deiodinase activity in human placenta as a function of gestational age. J Clin Endocrinol Metab. 1996; 8(6): 2154-2158.
18. Polk DH, Fisher DA. Fetal and neonatal thyroid physiology. 2nd edition. Philadelphia, Pennsylvania. WB Saunders Company 1998; (2): 2460-2467.
19. Uribe LF. Hipotiroidismo. En: Álvarez H, Betancur J, Correa G y col. Actualización en medicina interna. Primera edición. Medellín. Editorial Universidad de Antioquia; 1991; 139-147.
20. Lazarus JH, Hail R, Othman S et al. The clinical spectrum of postpartum thyroid disease. Q.J.M. 1996; 89(6): 429 – 435.
21. Mitzuda N, Tamaki H, Amino N et al. Risk factors for developmental disorders in infants born to women with Grave’s disease. Obstet Gynecol. 1992; 80: 359-364.
22. Klee GG, Hay ID. Biochemical testing of thyroid function. Endocrinol Metab Clin N Am. December 1997; 26(4): 763 – 775.
23. Fitzgerald PA. Endocrinología – Enfermedades de la glándula tiroides. En: Tierney LM, Mc Phee SJ, Papadakis MA. Diagnóstico clínico y tratamiento. 32° edición. México. Manual Moderno. 1997; 1000-1012.


CLIC AQUÍ Y DÉJANOS TU COMENTARIO