Infarto Agudo del Miocardio: Otros Métodos Diagnósticos
Los niveles de LDH comienzan a aumentar después de 24 a 48 horas de iniciado el cuadro, alcanzan el pico entre los 3 y 6 días y retornan a lo normal entre 8 y 14 días postinfarto.
Se recomienda realizar troponina en los pacientes con dolor torácico que sugiere angina o infarto de miocardio y sin cambios electrocardiográficos que permitan definir claramente la existencia del mismo o para el diagnóstico tardío del evento coronario por permanecer elevadas de 7 a 14 días. La utilización de las enzimas séricas para el diagnóstico es particularmente importante cuando los cambios electrocardiográficos son difíciles de interpretar.
Rayos X de Tórax
Los hallazgos en la radiografía de tórax no son específicos para el infarto del miocardio pero sí sirven para determinar indirectamente la presencia o no de disfunción ventricular izquierda.
Ecocardiograma
La principal utilidad en el IAM es la valoración segmentaria de la contractilidad, la cual se encuentra alterada en caso de isquemia aguda, infarto antiguo, espasmo coronario, bloqueo de rama, miocardio aturdido.
En caso de IAM no-Q el 20-40% de los casos no tienen alteración de la contractilidad segmentaria.
En casos de sospecha clínica es útil para detectar las complicaciones mecánicas del infarto agudo del miocardio como trombos, aneurisma, derrame pericárdico, y/o extensión a ventrículo derecho.
Ecocardiograma de Estrés
Luego del infarto agudo del miocardio tiene utilidad para determinar la función ventricular lo cual ayuda para predecir nuevos eventos de isquemia.
Se recomienda utilizar el protocolo de dobutamina a dosis baja que evalua la viabilidad e isquemia de miocardio en los siguientes casos:
1. Medición de la función ventricular sistólica y diastólica
2. Infarto inferior con sospecha de extensión a ventrículo derecho
3. Evaluación de las complicaciones mecánicas y de trombos murales (CIV, ruptura de músculo papilar, ruptura de pared libre, aneurisma vs pseudoaneurisma, insuficiencia mitral, derrame)
4. Evaluación del tamaño y extensión del infarto
5. Valoración de la función ventricular izquierda antes de su salida para definir el tipo de tratamiento médico por iniciar.
Medicina Nuclear
Gamagrafías de perfusión miocárdica con Sestamibi o Talio tienen un alto valor predictivo en la fase aguda. En un estudio que incluyó 691 pacientes el valor predictivo negativo fue de 91%.
Gamagrafía con pirofosfatos: es útil en la evaluación de infartos a partir de las primeras 24 horas hasta los siete días de presentado el infarto, pero su sensibilidad y especificidad son menores en el infarto subendocárdico.
Tratamiento
• Hospitalización del paciente en una unidad de cuidado coronario. Una vez el paciente llega al servicio de urgencias la evaluación debe hacerse con prontitud. Se le realiza una historia clínica completa, se le toma electrocardiograma de 12 derivaciones con marcadores enzimáticos seriados y selección del método de reperfusión si está indicado.
• Las mediciones iniciales comprenden la administración de oxígeno para aquellos pacientes que llegan con SaO2 <90% o evidencia de congestión pulmonar, para todos los pacientes con IAM no complicado durante las primeras 2-3 horas y para continuarlo más alla de las 3 a 6 horas iniciales.
• Analgesia con opioides tipo morfina o meperidina de acuerdo con la actividad simpática o parasimpática predominante.
• Debe iniciarse aspirina en dosis de 160 a 325 mg, preferiblemente masticable y sin cubierta entérica la cual continua diariamente y por tiempo indefinido.
• La atropina por su efecto de facilitación de la conducción sobre el nodo AV, se reservan para pacientes que cursen con evidencia de hipoperfusión en presencia de bradicardia sinusal o bloqueo AV de segundo grado Mobitz I, Mobitz II o bloqueo AV de tercer grado siempre y cuando cursen con QRS estrecho. También es de utili-dad en caso de asistolia ventricular. En caso de bradicardia menor de 40 latidos por minuto, sin bajo gasto cardíaco o en caso de bloqueos AV de II o III grado con QRS ancho está contraindicada la atropina. La depresión del segmento ST en cara anterior, derivaciones V1-V4 tiene un comportamiento heterogéneo pues puede ser una angina inestable o infarto no-Q de pared anterior o ser la manifestación de un IAM transmural verdadero de la pared posterior cuyo diagnóstico se hace cuando el infradesnivel es de 3 mm de V1 a V3 y tendría indicación para terapia de reperfusión. En el diagnóstico de infarto posterior verdadero se recomienda complementar la evaluación con las derivaciones V7, V8 y V9 donde se observa un supradesnivel > 0,5 mm del segmento ST o también sería útil un ecocardiograma o estudio de medicina nuclear.
• Monitorización continua de los signos vitales, manejo del dolor, aspirina, nitratos, sedación, laxación, dieta asistida guiada según las recomendaciones de la Asociación Americana de Cardiología.
• Actividad: se recomienda mantener al paciente en reposo sólo las primeras 12 horas. La actividad física se puede comenzar entre las 12-24 horas, inicialmente sentado en silla y al segundo día deambulación.
• La terapia de reperfusión con trombolíticos debe iniciarse durante los primeros 30 minutos de haber ingresado el paciente al servicio de urgencias.
• Dieta: nada por vía oral hasta el control del dolor y estabilización del paciente, luego se puede reiniciar con líquidos orales y dentro de las 12 horas dieta blanda 1000-1500 calorías, 4-5 g de sal y baja en colesterol.
• Ansiedad: puede mejorar con soporte sicológico y educación que influye en el cambio del comportamiento y disminución del estrés; si persiste pueden usarse ansiolíticos.
• Laxantes naturales: son necesarios para evitar maniobras de valsalva y cambios en la tensión arterial diastólica, balance de líquidos y control de peso diario.
• Monitoria con EKG: se inicia desde urgencias y permanece como mínimo las primeras 24 horas escogiendo la derivación comprometida y se mantiene cuando hay complicaciones eléctricas o disfunción del ventrículo izquierdo.
• Monitoria de signos vitales: cada 30 minutos en las primeras 4 horas y luego cada 4 horas si permanece estable.
Educación: el mejor conocimiento de la enfermedad ayuda al control de los factores de riesgo y contribuye a cambios de hábitos y educación a la familia.
Uso de antiagregantes plaquetarios en el infarto agudo del miocardio
Otros Antiplaquetarios
La ticlopidina se recomienda en casos de alergia o resistencia al ácido acetil salicílico (ASA). Actualmente el clopidrogel tiende a reemplazar a la ticlopidina como tratamiento asociado con la aspirina® en la prevención de trombosis de stents y también como alternativa a la aspirina® en casos de alergia o resistencia.
Uso de nitratos
En la fase inicial está indicada la administración de Nitroglicerina (NTG) sublingual e infusión endovenosa. Los pacientes con isquemia residual, hipertensión e insuficiencia mitral asociada con IAM son los más beneficiados del uso de NTG.
Uso de betabloqueadores
Se recomienda que todos los pacientes con infarto de miocardio, que no presenten contraindicación para ello, deben recibir tratamiento con betabloqueadores: idealmente, iniciar por vía intravenosa en las primeras 24 horas; si la presentación es más tardía, iniciar por vía oral. Continuar el tratamiento por lo menos durante tres años.
Contraindicaciones para la administración de Betabloqueadores
• Bradicardia significativa
• Presión arterial sistólica menor de 90 mmHg
• Disfunción ventricular moderada a severa
• Signos de hipoperfusión periférica
• Bloqueos de conducción AV
• EPOC o asma clínicamente significativa
• Enfermedad vascular periférica severa
• Diabetes Mellitus de difícil control.
Inhibidores de la ECA
Basados en la información actual se puede recomendar el uso rutinario de IECA en cualquiera de las dos modalidades: indiscriminada o selectiva (sólo en aquellos con marcadores de riesgo para disfunción ventricular).
Una vez iniciado el IECA se debe continuar en todos los pacientes hasta estratificar el riesgo al alta. Se recomienda suspender el IECA cuando en la valoración 4 a 6 semanas postinfarto se documente fracción de eyección (FE) >45%, no se encuentran signos de disfunción ventricular, se descarte insuficiencia mitral significativa y no se presente hipertensión arterial, ya que en estas circunstancias el beneficio sería marginal.
Recomendaciones
1. Pacientes dentro de las primeras 24 horas con sospechas de IAM con supradesnivel del ST en dos o más derivaciones precordiales anteriores o infartos con evidencia de falla cardíaca en ausencia de hipotensión significativa o de conocida contraindicación para inhibidores de la ECA.
2. Pacientes con IAM y fracción de eyección menor de 40% pacientes con evidencia clínica de falla cardíaca secundaria a disfunción sistólica durante o inmediatamente después del IAM.
3. No hay evidencia suficiente para demostrar beneficio en el uso indiscriminado en todas las variedades de IAM sin disfunción ventricular y sin evidencia de contraindicaciones para los IECA.
4. Se recomienda suspender el tratamiento luego de 4 a 6 semanas en caso de IAM anterior, cuando la FE sea superior al 40% y si no se documenta la insuficiencia cardíaca.
5. Se debe continuar el IECA en forma indefinida cuando hay IAM anterior o alguna de sus variedades, si hay IAM extenso con FE<40% o en casos de insuficiencia cardíaca.
Uso de anticoagulación en infarto agudo del miocardio
Se debe usar en todo paciente que sea llevado a procedimiento de revascularización, durante el curso de un infarto agudo, ya sea quirúrgico o por angioplastia, teniendo en cuenta que en estos casos es altamente recomendable usar para su monitoría el tiempo activado de coagulación (ACT).
Se usa por vía intravenosa en los pacientes sometidos a trombolisis con agentes selectivos. Se ha recomendado modificar las dosis sugiriendo un bolo de 60U/Kg con el inicio del trombolítico y luego mantenimiento de 12U/ Kg con un máximo de 4000U para el bolo y de 1000 U por hora en la infusión con PTT ajustado en 1.5-2.0 veces y PTT (50seg). La infusión debe continuarse por 48 horas.
Se puede utilizar 7500U de heparina no fraccionada o heparina fraccionada como la enoxaparina a dosis de 1m/Kg.
No se recomienda el uso rutinario de heparina en infusión luego de trombolisis con agentes no selectivos en pacientes con bajo riesgo de embolia sistémica.
Terapia de reperfusión del IAM
1. Terapia trombolítica por vena periférica
2. Angioplastia primaria
3. Revascularización quirúrgica
Posiblemente por disponibilidad en nuestro país el método más práctico y accesible sea la trombolisis periférica, sin embargo, mundialmente se considera la angioplastia primaria como terapia por lo menos igual de efectiva si no más que la trombolisis, la elección del método queda a criterio del médico tratante y a los recursos de la institución.
Trombolisis
Los trombolíticos intravenosos deben ser administrados en asocio con aspirina® debido al beneficio comprobado de esta combinación.
En pacientes con depresión del ST la trombolisis no ha demostrado ser efectiva en reducir la mortalidad, siendo el EKG además de la ventana de tiempo, otro predictor de éxito e impacto en la terapia trombolítica.
Parte fundamental del éxito y del control de las complicaciones radica en los criterios de selección adecuados y de un manejo racional de las contraindicaciones.
Contraindicaciones
Absolutas
• Sangrado activo
• Cirugía mayor reciente (menos de seis semanas)
• Punción arterial en puntos no comprensibles
• Evento cerebrovascular reciente
• Hipertensión arterial no controlada. Relativas
• Mayores de 75 años
• Historia de sangrado digestivo reciente, enfermedad ulcerosa activa
• Administración previa de estreptoquinasa y/o alergia
• Shock cardiogénico, excepto el caso de no disponer de angioplastia
• Historia de diatesis hemorrágica
• Luego de resucitación cardiopulmonar (según duración)
• Retinopatía diabética con hemorragia activa.
Las sustancias trombolíticas más ampliamente usadas son la estreptoquinasa (SK) 150000 unidades endovenosas administradas en una hora; el rtPA activador tisular del plasminógeno administrado en forma acelerada, recibiendo 15 miligramos endovenosos en bolo seguido de una infusión de 0,75 miligramos por kilo en 30 minutos, hasta un máximo de 50 miligramos y luego infusión de 0,5 miligramos por kilo en un período de 60 minutos hasta un máximo de 35 miligramos, asociando bolo de 5000 unidades endovenosas de heparina e infusión de 1000 unidades hora; el APSAC se administra en una dosis de 100 miligramos en bolo y la Uroquinasa (UK) se administra en una dosis de 2000 unidades en una hora.
La estreptoquinasa es el trombolítico de primera elección debido a que tiene un menor costo. La administración del rt-PA asociadas con heparina endovenosa debe preferirse en pacientes con contraindicaciones para recibir estreptoquinasa y puede también ser considerada de primera elección para aquellos pacientes con infartos extensos, infartos anteriores, menores de 75 años y preferiblemente a pacientes que se presenten con el infarto en las primeras cuatro horas de instauración de los síntomas. No existe una evidencia suficiente para sugerir que la heparina sea utilizada rutinariamente en conjunción con la estreptoquinasa. Actualmente se dispone de otros trombolíticos como el rPA (Reteplase® ), TNK-tPA (Lanetoplase® ) los cuales han mostrado la ventaja de poderse administrar más fácilmente en uno o dos bolos. El metaanálisis de nueve estudios, cada uno con más de 1000 pacientes en los cuales se usó el trombolítico, completando una base de datos con 58600 pacientes mostró: mortalidad en 6177 (10%), enfermedad cardio vascular (ECV) en 564 (1,0%) y 436 eventos de sangrado mayor no cerebral.
De los 45000 pacientes con supradesnivel y/o BRC, se documentó reducción absoluta de mortalidad de 30% en las primeras 6 horas.
Está surgiendo en la actualidad una modalidad de tratamiento farmacológico que se ha denominado quimioterapia y que consiste en la administración de trombolítico rtPA a mitad de dosis asociado con heparina y con antagonista de Glicoproteína lIb/IIIa que en estudios preliminares ha mostrado obtener rápidamente un flujo más adecuado: esta modalidad de tratamiento deberá ser comprobada en experimentos clínicos.
Está probándose en ensayos clínicos que la asociación de estreptoquinasa con antitrombínicos directos del tipo Hirulog, puede resultar en una reperfusión más temprana y completa. Se espera resultados para el año 2001.
Recomendaciones para la trombolisis en IAM
La trombolisis está indicada en:
1. Pacientes con supradesnivel del ST (>0,1 mV, en >2 derivaciones contiguas), evolución de síntomas < a 12 horas y edad < de 75 años.
2. Pacientes con cuadro clínico de IAM y EKG con bloqueo completo de rama (Difícil interpretación de ST)
Definitivamente no hay utilidad del uso de trombolíticos en infartos de más de 24 horas de evolución si el cuadro de dolor ha resuelto. En estos casos solo se manifestarían las complicaciones
Angioplastia primaria
Recomendaciones para angioplastia primaria:
1. Se considera alternativa a la terapia trombolítica en todos los pacientes con IAM y supradesnivel del ST o nuevo bloqueo completo de rama izquierda que puedan ser llevados a angioplastia dentro de las primeras 12 horas de iniciados los síntomas o más de 12 horas si persisten los síntomas de isquemia, con la disponibilidad del personal y el laboratorio apropiado.
2. En aquellos pacientes que cursen dentro de las 36 horas de un IAM con supradesnivel del ST u onda Q, o nuevo bloqueo completo de rama izquierda y que desarrollen shock cardiogénico, menores de 75 años y que la revascularización pueda practicarse dentro de las siguientes 18 horas al desarrollo del shock.
La angioplastia de emergencia primaria debe considerarse de elección para pacientes con infarto agudo del miocardio con grandes áreas de riesgo y en quienes está contraindicada la trombolisis. La angioplastia primaria es una alternativa terapéutica para los pacientes con shock cardiogénico. Debido a los problemas logísticos la angioplastia primaria directa es una terapia que puede recibir solo una maniobra de pacientes con infarto agudo del miocardio. Recientemente a esta modalidad terapéutica se ha adicionado la utilización de Stent que ha mejorado el índice de éxito temprano en el procedimiento.
Los pacientes que no responden al agente trombolítico en la siguiente hora pueden ser candidatos para realizarles una angioplastia de emergencia de rescate si existe la sospecha de un área del miocardio a riesgo grande o el paciente está inestable hemodinámicamente.
La cirugía de revascularización miocárdica estaría indicada para pacientes en que durante la fase aguda del infarto se conoce su anatomía coronaria y se sabe que tiene indicación quirúrgica como se discutirá en otra sección de estas guías.
Arteriografía realizada tempranamente en los pacientes con IAM
1. Pacientes con cambios en EKG tempranos del ST o presencia de bloqueo de rama izquierda de Haz de His.
• Cuando se encuentra el paciente dentro de las primeras seis horas del inicio del evento y se dispone de sala hemodinámica, la recomendación de la arteriografía coronaria se establece como de nivel I. (Estudios: GUSTO IIB, FRESCO, GRAMI PAMI STENT)
• Pacientes en estado de shock cardiogénico o en inestabilidad hemodinámica persistente, como nivel II.
• Pacientes que presentan un infarto de la cara anterior extenso bajo tratamiento trombolítico fallido.
• Pacientes a quienes se les intervino con trombolisis y no presentan sintomas ni tienen inestabilidad hemodinámica, se realiza la arteriografía de rutina, dentro de las primeras 24 a 48 horas, como nivel III. (TIMI IIIB)
Complicaciones inherentes
1. Infarto agudo que persista con isquemia o tenga recurrencia tornándose refractaria al tratamiento.
2. Presencia de un defecto septal ventricular o de una insuficiencia valvular mitral.
3. Cuando se sospecha una formación de pseudoaneurisma.
4. Falla cardíaca congestiva o hipotensión, o ambas, durante el tratamiento médico intensivo.
5. Taquicardia ventricular recurrente o fibrilación ventricular.
Angiografía temprana en el infarto no Q
1. Pacientes con infarto agudo de miocardio del tipo no-Q sin adecuada respuesta al tratamiento médico o con isquemia inducible.
2. Pacientes con infarto agudo del miocardio del tipo no-Q con respuesta al tratamiento.
Evaluación invasiva previa a la salida del período hospitalario
Determinado en el paciente de alto riesgo
1. Isquemia a bajo nivel de actividad con cambios EKG (ST presión mayor o igual de 1 mm o imágenes de anormalidades), o gastos calóricos menores de 4 METS.
2. Signos de falla ventricular durante el período de hospitalización.
3. Evidencia ecocardiográfica de función contráctil menor de 45% e incapacidad de realizar prueba de ejercicio.
4. Isquemia inducida por alto nivel de ejercicio.
5. Pacientes con infarto agudo no- Q sin alto riesgo con el objetivo de realizar revascularización.
6. Retorno del paciente postinfarto a una actividad de inusual gasto calórico.
7. Paciente con un infarto de miocardio antiguo remoto en localización con el que actualmente está en curso, sin manifestaciones de descompensación o sin evidencia de isquemia inducible.
8. Pacientes con taquicardia ventricular recurrente, fibrilación ventricular o presencia de ambas, en presencia de buen tratamiento antiarrítmico, sin evidencia de isquemia.
9. Pacientes asintomáticos menores de 50 años.
10.Terapia trombolítica en el momento agudo con evidencia de reperfusión.
Monitoría hemodinámica
Aparte de la monitoría básica asociada con las unidades de cuidado intensivo descrito en secciones previas, se debe hacer mención especial de la monitoría con catéter de balón flotante en la arteria pulmonar o catéter de Swan Ganz. Aunque existe controversia y resultados encontrados con respecto a la evidencia en la mejoría de sobrevida de pacientes con IAM en quienes se utiliza el catéter de arteria pulmonar, si hay acuerdo en sus bondades y utilidad como herramienta para facilitar el manejo del paciente con IAM que cursa con inestabilidad hemodinámica, síndrome de bajo gasto, arritmias persistentes, edema pulmonar o shock cardiogénico.
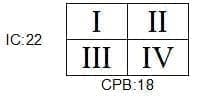
En el paciente con hipotensión y taquicardia este tipo de monitoría permite obtener una diferencia rápida y fácil del estado hemodinámico real e inclusive permite su estadificación como fue propuesto por Forrester y Diamond en cuatro cuadrantes teniendo en cuenta el valor de la presión capilar pulmonar y el índice cardíaco.
Clasificación hemodinámica
Con esta aproximación se logra interpretar los diferentes estadios en que se puede encontrar un paciente con IAM (volemia y gasto normal o incluso hiperdinamia en el cuadrante I, hipervolemia o disminución significativa de precarga de diferentes orígenes, cuadrante III, y claro shock cardiogénico con edema pulmonar, cuadrante IV).
Aunque la técnica es relativamente segura se debe contar con la experiencia y el personal entrenado para evitar complicaciones que podrían ser inclusive potencialmente fatales.
Definitivamente no está indicado en caso de infarto no complicado. Se recomienda uso de monitoría de presión intraarterial en:
• Pacientes que requieran utilización de vasopresores potentes intravenosos
• No hay acuerdo definitivo, pero se puede recomendar cuando se utilizan vasodilatadores intravenosos potentes (NTG, NTP)
• Definitivamente no esta indicado este tipo de monitoría en pacientes con IAM que curse sin estabilidad hemodinámica como técnica de rutina.
Complicaciones eléctricas y arrítmicas en IAM
Dentro de las complicaciones eléctricas se encuentran diferentes variedades de arritmias dentro de las cuales sobresale la taquicardia ventricular, la fibrilación ventricular primaria y la fibrilación auricular temas estos tratados en otros segmentos del consenso y en consensos anteriores, motivo por el cual se enunciarán fundamentalmente las recomendaciones.
Fibrilación auricular
Las diferentes taquiarritmias supraventriculares que ocurren durante el infarto agudo del miocardio tienen diferentes sustratos. Dentro de estas posibles causas se debe tener presente que la aparición de taquiarritmia supraventricular durante las fases tempranas del IAM puede ser la primera alarma de disfunción ventricular izquierda, evoluciona a insuficiencia cardíaca y sobrecarga auricular. Otras posibles etiologías pueden ser arritmias asociadas con el estado de hiperdinamia mediado por catecolaminas endógenas, irritabilidad asociada con pericarditis preinfarto, desencadenada por fluctuaciones espontáneas de niveles de electrolitos o facilitada por el tratamiento y finalmente acompañade de cuadros sistémicos como embolia pulmonar o ser simplemente una manifestación extra del proceso isquémico con participación de territorios auriculares.
Recomendaciones
1. Se debe practicar cardioversión eléctrica inmediata en todo paciente que desarrolle fibrilación auricular con compromiso hemodinámico asociado.
2. Utilizar el protocolo de digitalización rápido para buscar disminuir la frecuencia de respuesta ventricular y optimizar la función ventricular
3. Se puede usar betabloqueador IV para enlentecer la respuesta ventricular en ausencia de contraindicaciones (disfunción ventricular, broncoespasmo, bloqueos auriculoventriculares)
4. Se debe iniciar infusión de heparina en todos los casos excepto que coexista una contraindicación categórica.
Taquicardia ventricular/Fibrilación Ventricular
1. La fibrilación ventricular (FV) debe tratarse con desfibrilación eléctrica con carga inicial de 200J; si no hay éxito se realiza una segunda dosis de 200-300J y si es necesario se efectúa una tercera carga de 360J.
2. Versión eléctrica asincrónica en casos de taquicardia ventricular (TV) polimorfa sostenida (duración mayor de 30 segundos asociada con colapso circulatorio), usar dosis semejantes al numeral anterior.
3. Se recomienda versión sincrónica en casos de taquicardia ventricular monomorfa sostenida que ocasione o se asocie a angina, edema pulmonar o hipotensión. La carga inicial es de 100J, se pueden incrementar las dosis si la respuesta es insuficiente.
4. En casos de TV monomorfa sostenida no asociada con angina, edema pulmonar o hipotensión se recomienda tratamiento farmacológico con cualquiera de los tres esquemas siguientes:
• Lidocaina en bolos iniciales de 0,1 a 1,5 mg/Kg y adicionales cada 10 minutos de 0,5 a 0,75 mg/Kg hasta un máximo total de 3mg/Kg. Posteriormente continua con una infusión de 2 a 4 mg/min. (30 a 50 mcg/Kg. por minuto).
• Amiodarona: 150 mg en bolo durante 10 minutos, continuando con infusión de 1,0 mg/min por 6 horas y luego disminuir la infusión a la mitad.
• Cardioversión eléctrica iniciando dosis de 50J, asegurando sedación y analgesia.
La corrección de electrolitos y la administración posterior de infusiones de antiarrítmicos continúa en controversia y debe dejarse como terapia individualizada.
No hay estudios que soporten suficientemente los beneficios de las terapias agresivas de reperfusión o de soporte mecánico como tratamiento para la TV polimorfa refractaria a fármacos. En estos casos se recomienda, de todas formas continuar con la infusión de Amiodarona en espera de una respuesta a las medidas extremas antiisquémicas.
1. No hay evidencia de beneficio en tratar la arritmia ventricular aislada, como extrasístoles, dupletas, ritmo idioventricular acelerado o TV no sostenida.
2. No hay justificación para el uso de antiarrítmicos profilácticos en pacientes sometidos a terapia trombolítica.
Bradiarritmias y bloqueos
Se enunciarán a continuación las principales recomendaciones con respecto al uso de marcapasos.
Marcapaso transvenoso temporal
1. Asistolia
2. Bradicardia sintomática (sinusal asociada con hipotensión y bloqueo AV de segundo grado tipo I con hipotensión que no responda a Atropina)
3. Bloqueo completo bilateral de rama (alternante)
4. Bloqueo bifascicular de aparición nueva o de evolución indeterminada que implique como uno de sus componentes bloqueo AV de primer grado
5. Bloqueo AV de segundo grado Mobitz tipo II
Es controvertido el uso de marcapaso en otras variedades de bloqueo bifascicular, o en casos de bloqueo completo de rama izquierda de tiempo desconocido.
No está indicado y podría estar contraindicado en:
1. Bloqueo AV de primer grado
2. Bloqueo AV de segundo grado tipo I sin compromiso hemodinámico
3. Ritmo idioventricular acelerado
4. Bloqueos bifasciculares o de rama preexistentes.
Asistencia mecánica ventricular en IAM
El balón de contrapulsación aórtica es un dispositivo que intenta mejorar el desempeño miocárdico en el contexto de la falla ventricular severa. Es importante anotar que sólo resulta útil para disminuir la mortalidad si el paciente es llevado posteriormente a un procedimiento de revascularización, ya sea por medio de cirugía o angioplastia, o si se resuelve quirúrgicamente la complicación mecánica causal. El balón de contrapulsación actua mediante reducción de la postcarga y mejorando la perfusión miocárdica. Se implanta vía arterial femoral y se avanza en forma retrógrada hasta el orígen de la arteria subclavia izquierda. El efecto se ejerce al inflarse durante la diástole, incrementando así el llenado coronario.
De la misma manera, al desinflarse en sístole facilita el avance de la sangre luego de cada contracción ventricular, disminuye la poscarga y por ende el trabajo miocárdico, está indicado en las siguientes situaciones:
1. Shock que no responde al tratamiento, como medida antes de algún procedimiento de revascularización miocárdica
2. Evidencia de complicaciones mecánicas como ruptura septal o de la pared libre del ventrículo
3. Arritmia recurrente con compromiso hemodinámico
4. Angina postinfarto refractaria al tratamiento médico convencional
Pacientes con inestabilidad hemodinámica con área miocárdica en riesgo y como puente para procedimiento de revascularización son altamente beneficiados desde este dispositivo.
Manejo de las complicaciones mecánicas del IAM
Comprenden la ruptura del septum interventricular, la disfunción del músculo papilar por la ruptura total o parcial del mismo, conllevando a insuficiencia mitral masiva secundaria, la ruptura de la pared del ventrículo izquierdo, y aquellas relacionadas con la transmuralidad del infarto. El manejo médico de estas entidades conlleva alta mortalidad, pero se hace absolutamente necesario como soporte previo a la corrección quirúrgica. Este manejo quirúrgico complementario ha demostrado significativa disminución de la mortalidad en 13 a 14%.
Insuficiencia mitral isquémica
La insuficiencia mitral postinfarto del miocardio ocurre en 1% de los pacientes, siendo una complicación rara pero potencialmente fatal; es causa del 5% de las muertes que ocurren en el contexto de un infarto de pared inferior, debida a la irrigación única del mismo. La transección completa de un músculo papilar es incompatible con la vida debido a la regurgitación mitral masiva súbita que se desarrolla y solo podría superarse con intervención quirúrgica temprana, cirugía de gran riesgo. La ruptura ocurre con infartos relativamente pequeños en aproximadamente la mitad de los casos.
El evento suele presentarse entre cuatro a siete días luego del infarto y se caracteriza por la aparición súbita de disnea, hipotensión, edema y soplo pansistólico apical. En el registro de la onda del catéter de arteria pulmonar es evidente la presencia de onda V prominente.
El diagnóstico radiológico es sugerido por la presencia de edema pulmonar con la silueta cardíaca del tamaño normal. La confirmación diagnóstica se hace mediante la realización de un ecocardiograma transtorácico o transesofágico.
Se realiza cateterismo cardíaco para definir de la anatomía coronaria a fin de practicar en el mismo tiempo quirúrgico la revascularización respectiva. Dicho procedimiento podrá llevar-se a cabo solo en caso de que el paciente no esté en shock, ya que este último evento obliga la realización inmediata de la intervención quirúrgica.
El tratamiento médico está orientado a estabilizar el paciente antes de la cirugía y comprende el soporte inotrópico, control de las arritmias, mantener un aporte hídrico bajo, y fundamentalmente, la colocación de un balón de contrapulsación aórtico.
El tratamiento quirúrgico deberá realizarse lo antes posible, ya sea median-te reparo de la ruptura o cambio de toda la válvula si es necesario.
Ruptura de la pared libre del ventrículo izquierdo
Ocurre hasta en 10% de los pacientes que fallecen por infarto agudo del miocardio. Sucede hacia el tercer a sexto día postinfarto y es más común en los infartos anteriores. El uso previo de corticosteroides y agentes antiinflamatorios no esteroides está implicado como predisponente de la ruptura como resultado de alteración en el proceso normal de curación, aunque existe controversia al respecto. El uso temprano de la trombolisis parece reducir la incidencia, un efecto que es responsable en parte de la supervivencia incrementada con la trombolisis efectiva. Paradógicamente, la terapia trombolítica tardía podría en realidad tardar el riesgo de ruptura.
El cuadro clínico puede ser de presentación aguda, subaguda o crónica. El cuadro agudo se caracteriza por la aparición súbita del dolor torácico severo, seguido de disociación electromecánica y muerte. El tratamiento es la toracotomía de urgencia.
La presentación subaguda ocurre por una ruptura que permite sólo un sangrado lento; se produce dolor por el pequeño desgarro y el cuadro clínico es dominado por el derrame pericárdico secundario, seguido de taponamiento, diagnóstico que se confirma mediante ecocardiografía.
La forma crónica se da en el contexto de la presencia de un pseudoaneurisma que consiste en una ruptura contenida por la reacción cicatrizal del pericardio circundante que sella el defecto formando una especie de bolsa que semeja un aneurisma. El diagnóstico se hace nuevamente mediante ecocardiografía.
Los cuadros agudos y subagudos tienen indicación absoluta de cirugía mediante la colocación de un parche de teflón.
Comunicación interventricular
Su incidencia está en el rango de 1 a 2% de los pacientes con infarto del miocardio siendo responsable del 5% de las muertes. La muerte generalmente no es inmediata, y los pacientes con frecuencia pueden llegar a un centro de referencia donde se les puede tratar su complicación. Ocurre hacia el segundo a cuarto día postinfarto. El 66% de los casos ocurre en el contexto de un infarto anterior por oclusión de la descendente anterior, en cuyo caso la ruptura tiende a ser de localización apical, mientras que los infartos inferiores están asociados con perforación del septum basal y con un pronóstico peor que los de localización anterior.
La historia natural de la enfermedad no tratada quirúrgicamente indica que 25% mueren en las primeras 24 horas, el 50% lo hace durante la primera semana, 65% fallece en las dos semanas iniciales, 85% muere las cuatro primeras semanas y 7% estan vivos al año. Se habla de comunicación interventricular aguda si el curso clínico es menor de 15 días y crónica si su tiempo de evolución es mayor. Puede ser de localización anterior o posterior en el septum.
En el 60% de los casos se detecta angiográficamente enfermedad de un vaso, en 10% de dos vasos y en 30% de tres.
El tamaño del defecto determina la magnitud del corto-circuito de izquierda a derecha y la extensión del compromiso hemodinámico, lo que a su vez afecta la probabilidad de sobrevida. Se caracteriza por la aparición de un nuevo soplo holosistólico, alto y rudo que se ausculta mejor en el borde esternal izquierdo inferior acompañado por lo general de thrill. Se desarrolla descompensación hemodinámica con falla biventricular.
El catéter de arteria pulmonar detecta el corto-circuito, con contaminación del ventrículo derecho de sangre arterial. El defecto puede reconocerse mediante ecocardiografía bidimensional con Doppler a color. El cateterismo está indicado para efectuar revascularización en el mismo acto quirúrgico.
El tratamiento consiste en la estabilización del paciente mediante el uso de vasodilatadores, colocación de balón de contrapulsación, ventilación mecánica de ser necesario, y proceder con la corrección quirúrgica urgente, la cual puede tener una mortalidad que va desde el 12 a 40%, siendo mayor como se mencionó anteriormente en infartos de pared posterior (35%). Si se asocia shock la mortalidad es de 40%. Si el paciente sobrevive el acto quirúrgico tendrá una sobrevida a 10 años de 60%. Por lo tanto, la cirugía tiene recomendación de grado A, basada en evidencia tipo III.
Complicaciones por transmuralidad
La tendencia a la generalización de la trombolisis ha disminuido las complicaciones asociadas con la transmuralidad del infarto, habiéndose reducido la frecuencia de pericarditis en un 50%. De la misma manera, la incidencia de ruptura temprana y tardía ha bajado.
La pericarditis aparece hacia las 24 horas del evento, y no después de 72 horas. Su diagnóstico es clínico, con confirmación electrocardiográfica o por ultrasonido. El tratamiento de elección es el ASA a razón de 650 mg cada 4 a 6 horas. El uso de otros antinflamatorios y contricciones está contraindicado por el riesgo de remodelación y ruptura del infarto.
El infarto agudo del miocardio puede complicarse con situaciones como la ruptura del músculo papilar que causa una insuficiencia mitral aguda masiva y deterioro hemodinámico que requiere cirugía de urgencia; la ruptura de la pared libre del ventrículo izquierdo es una de las causas más frecuentes de mortalidad intrahospitalaria por taponamiento cardíaco y requiere cirugía, cuando da tiempo para realizarse; el aneurisma ventricular izquierdo se presenta en aproximadamente 15% de los pacientes y es quirúrgico cuando se asocia con arritmias, embolismos o insuficiencia cardíaca; los trombos intraventriculares se demuestran generalmente por ecocardiografía y requieren manejo médico con anticoagulación por tres meses o cirugía en caso de ser fuente de embolismo periférico. La mayoría de las complicaciones mecánicas requieren apoyo con balón de contrapulsación intraaórtico.
Cirugía de revascularización coronaria en infarto agudo del miocardio
Recomendaciones del American College of Cardiology/American Heart Association
• Angioplastia fallida con dolor persistente o inestabilidad hemodinámica en pacientes con anatomía favorable para cirugía
• IAM con isquemia persistente o recurrente, refractaria al tratamiento médico, en pacientes con anatomía coronaria favorable para cirugía y que no son candidatos para intervención por catéter
• En el momento de reparo quirúrgico de comunicación interventricular o insuficiencia mitral.
• Shock cardiogénico con anatomía favorable para cirugía. Angioplastia fallida con área pequeña de miocardio en riesgo y hemodinámicamente estable.
• Cuando la mortalidad quirúrgica esperada sea igual o exceda la mortalidad asociada con terapia médica apropiada.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO