Comorbilidad en Obesidad
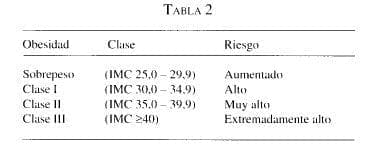
Una variedad de alteraciones se asocian con la obesidad, las cuales en grupo se señalan como “comorbilidad”. El riesgo de complicaciones y mortalidad precoz está directamente relacionado con la Clase de Obesidad, según el IMC. Es así como el riesgo ha sido clasificado por los National Institutes of Health (Klein 2001; NIH 1998):
El IMC no es el único factor que determina riesgo de enfermedades y entidades patológicas asociadas. Otros factores, tales como distribución de la grasa, aumento del peso corporal desde la juventud, estado físico general y etnia modifican los riesgos relacionados con el IMC (Klein 2001).
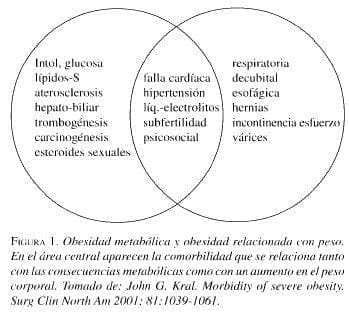
Según Kral (2001), mucha de la comorbilidad de la obesidad no necesariamente está relacionada con un IMC elevado o con altos niveles de grasa corporal: en el rango normal, una distribución anormal de la grasa viene a ser el factor característico común en las enfermedades asociadas. Puesto que la pérdida de peso casi sin excepción lleva a la mejoría o prevención de la comorbilidad, y en algunos casos a la curación, es fácil entender cómo el exceso de grasa corporal es interpretado como la causa de esta patología. Sin embargo, lo que realmente ocurre es que tanto la distribución como la cantidad de grasa corporal, en forma independiente, contribuyen a la comorbilidad.
Por lo tanto, se puede clasificar la obesidad en dos tipos: un tipo relacionado con el peso o la masa corporal, la “Obesidad relacionada con el peso”, y un tipo relacionado con el metabolismo, la “Obesidad metabólica”. Los dos tipos con frecuencia se superponen.
Sugerman (2000) y Kral (2001) señalan cómo la relación entre obesidad central o visceral y la constelación de problemas de salud que en forma colectiva se denomina síndrome metabólico o síndrome X (Reaven 1988), ha sido bien establecida. El síndrome es secundario a un incremento en la producción de glucosa por la grasa visceral, lo cual conduce a hiperglicemia e hiperinsulinismo. A largo plazo resulta insuficiente la producción de insulina para mantener euglicemia, y el paciente desarrolla diabetes mellitus tipo 2. Los niveles aumentados de glicemia e insulina se asocian con la aparición del síndrome de ovarios poliquísticos, que se lo conoció como síndrome de Stein-Leventhal, el cual se manifiesta por quistes ováricos, hirsutismo, amenorrea y esteatosis no alcohólica; algunas pacientes desarrollan hipertensión arterial. El síndrome de ovarios poliquísticos, o síndrome ovárico poliquístico, se lo conoce hoy como hiperandrogenismo ovárico funcional, y se caracteriza por irregularidad menstrual crónica (amenorrea u oligomenorrea), hirsutismo, hiperinsulinemia (con resistencia a la insulina) e infertilidad (Heber et al 2003).
La asociación entre una variedad de alteraciones metabólicas y un estado de resistencia a la insulina fue propuesta por primera vez por Gerald M. Reaven en la Banting Lecture de la American Diabetes Association en 1988. Reaven planteó que la resistencia a la insulina es un fenómeno que se asocia con la intolerancia a la glucosa, dislipidemia e hipertensión, y que tales anormalidades representan el conjunto determinante de alto riesgo de enfermedad cardiovascular (Mingrone et al 2000).
El síndrome metabólico, caracterizado por obesidad central, intolerancia a la glucosa, hiper-trigliceridemia e hipertensión ha sido denominado el “cuarteto de la muerte” (Kaplan 1989). Se reconoce el síndrome metabólico consistente en la asociación de intolerancia a los carbohidratos, resistencia a la insulina, dislipidemia, hiperlipidemia, hiperuricemia y obesidad, el cual hoy se denomina más comúnmente síndrome de resistencia a la insulina (Davidson 1995; Duperly 2000), por cuanto la resistencia a la insulina parece ser el común denominador de la constelación de alteraciones metabólicas que lo caracterizan. Son muy interesantes las interacciones fisiopatológicas de este síndrome metabólico de la obesidad (Davidson 1988; Reaven 1988; Sheehan & Jensen 2000).
En resumen, la resistencia a la insulina es un prominente marcador biológico de la obesidad y se la define como una inadecuada respuesta a la insulina exógena o endógena. Como lo expresan Mingrone et al (2000), tal tipo alterado de respuesta no está estrictamente confinada a la relación entre insulina y glucosa, sino que se extiende a otras acciones biológicas de la hormona, incluyendo sus efectos sobre el metabolismo lipoídico y proteico, la función del epitelio vascular y la expresión genética (por ejemplo los genes que codifican la formación de los receptores de glucosa GLUT 3 y GLUT 4). Los fenómenos principales de la resistencia a la insulina son la defectuosa captación de glucosa mediada por insulina y la mala utilización de la glucosa con el consiguiente defectuoso almacenamiento de glicógeno en el músculo.
Las complicaciones metabólicas de la obesidad a la luz de consideraciones fisiopatológicas han sido revisadas recientemente por Sheehan y Jensen (2000) de la Clínica Mayo. La mayoría de los investigadores coinciden en que la cantidad de grasa visceral, que parece tener una predisposición genética, puesto que las características de herencia de la grasa visceral abdominal es de 50% en algunos estudios, se relaciona más con las anormalidades metabólicas que con la cantidad de grasa subcutánea o de grasa corporal total. La grasa que es liberada de los depósitos en el epiplón y los mesenterios ingresa al sistema venoso portal y por allí al hígado, antes de mezclarse con la circulación sistémica y, por consiguiente, ejercen mayor efecto sobre la función hepática.
Sheehan y Jensen (2000) resumen e ilustran bien el papel del tejido adiposo y del metabolismo de los ácidos grasos en las alteraciones metabólicas que ocurren en los obesos: las concentraciones plasmáticas de ácidos grasos libres (AGL) son más elevadas en los individuos obesos, especialmente los que sufren la obesidad central, y el nivel de estas concentraciones se relaciona con las complicaciones metabólicas; tales elevaciones de AGL circulantes se deben bien a un incremento en su liberación a partir del tejido adiposo, o sea un exceso en la disponibilidad, o bien a una disminución en la captación por los tejidos. El exceso de AGL contribuye a la patogenia del síndrome metabólico.
En efecto, el papel de los AGL en la circulación es preponderante en cuanto a las alteraciones metabólicas que se observan en la obesidad, especialmente en la obesidad de tipo central u obesidad visceral. Los AGL son liberados de los adipocitos, donde se almacenan en forma de triglicéridos (TGL); constituyen el más importante carburante lípido en el ser humano. Se dice que los AGL son al metabolismo de la grasa como la glucosa al metabolismo de los carbohidratos; sin embargo, su concentración plasmática es apenas de 500 mmol/L, contra 5 mmol/L de la glucosa. La hidrólisis de los TGL en el tejido adiposo resulta en la liberación de los AGL y una molécula de glicerol. Los AGL son utilizados como carburante, y el glicerol es convertido a glucosa, por el proceso de gluconeogénesis en el hígado y en el riñón, o para nueva síntesis de TGL en el hígado y en el músculo. El proceso de lipólisis es inhibido por la insulina y estimulado por las catecolaminas; el cortisol y la hormona del crecimiento también estimulan, aunque en grado menor, la lipolisis. La oxidación de los AGL tiene lugar en el interior de las mitocondrias después del transporte a través de la membrana mitocondrial, por acción de la carnitina palmitoil transferasa I (CPT-I). Un incremento en la oxidación de AGL induce disminución en el transporte y metabolismo de la glucosa; se ha demostrado reducción en la sensibilidad periférica a la insulina en relación con elevación de los AGL; la resistencia a la insulina en el músculo esquelético puede ser resultado de alteración en el sistema de señalamiento de insulina. Hoy se acepta la resistencia a la insulina como una anormalidad metabólica importante en la obesidad de tipo central. ¿Por qué la relación negativa entre la masa de grasa subcutánea abdominal y la sensibilidad a la insulina? Se ha postulado que el mayor tamaño del adipocito de la grasa abdominal se correlaciona con el grado de resistencia a la insulina en pruebas de tolerancia a la glucosa; una correlación similar existe entre el tamaño del adipocito y la producción de factor de necrosis tumoral alfa (FNT-a), lo cual puede tener efecto sobre el fenómeno de resistencia a la insulina. También se cree que el exceso de AGL inhibe la extracción hepática de la insulina que secreta el páncreas a la circulación portal, dando como resultado la hiperinsulinemia, lo cual se une a un aumento en la secreción pancreática que es característica de la obesidad de tipo central. Experimentalmente se ha demostrado que el incremento en los AGL aumenta la secreción basal de insulina y reduce su secreción estimulada por glucosa, y la biosíntesis de la hormona. “Los estudios in vitro demostraron que el incremento en las concentraciones de AGL induce anormalidades en las células beta observada en la diabetes, y el bloqueo de la oxidación de los AGL puede impedir estos cambios.” Existe creciente evidencia sobre cómo el incremento en los AGL contribuye a la hipertensión y la enfermedad vascular por vasoconstricción, tal vez inducida por mayor sensibilidad a estímulos alfa-adrenérgicos. El mayor flujo de AGL contribuye a la dislipemia del síndrome metabólico: hipertrigli-ceridemia, bajos niveles de lipoproteínas de alta densidad (HDL) y altos niveles de lipoproteínas de baja densidad (LDL). En resumen, existe una relación entre el fenotipo de obesidad central y las anormalidades metabólicas, mediadas, en gran parte, por los AGL (Sheejan & Jensen 2000).
Como lo expresan Calzada León y asociados (1997), hoy se reconoce que el tejido adiposo no es un simple depósito estático, sino que está constituido por células altamente especializadas, capaces de producir una amplia variedad de mediadores neuroendocrinos y de responder cualitativa y cuantitativamente a estímulos hormonales. Estos autores mexicanos también se refieren a cómo la localización del tejido adiposo guarda relación directa con su capacidad funcional, y así, por ejemplo, el situado a nivel visceral, o sea la obesidad central, se considera en la actualidad como un órgano endocrino, a diferencia del subcutáneo, cuya función es primordialmente la de almacenamiento de energía. La secreción de sustancias bioactivas es directamente proporcional a la masa de tejido adiposo central.
Por ello, hoy se contempla el panorama de la obesidad central desde la perspectiva endocrina, con especial énfasis en las adipocitoquininas y la secreción y acción de la insulina pancreática (Heber et al 2003).
Entre las adipocitoquininas y los principios bioactivos, la leptina concentra el interés de los investigadores. La adiposidad corporal es un factor determinante de los niveles circulantes de leptina, una hormona derivada de los adipocitos, que tiene influencia sobre la regulación del peso corporal. También se ha documentado influencia sobre los procesos de hematopoyesis, angiogenesis, función inmunitaria, osteogenesis y cicatrización. Se piensa que la sensibilidad a la insulina también es un factor determinante de los niveles circulantes de leptina, posiblemente por el efecto secretor de leptina de la insulina sobre el adipocito (Heber et al 2003).
En conclusión, la obesidad central u obesidad abdominal, es considerada hoy como un órgano endocrino.
Un interesante planteamiento es el de U.N. Das (2001), que considera la obesidad como una entidad inflamatoria de bajo grado. Las personas obesas, niños y adultos, exhiben niveles elevados de proteína C-reactiva, interleuquina 6, FNT-a y leptina, reconocidos marcadores de enfermedad inflamatoria y que se encuentran íntimamente asociados con riesgo de muerte por enfermedad cardiovascular y no cardiovascular. Esto puede explicar el incremento en el riesgo de diabetes, enfermedad cardiaca y demás enfermedades crónicas asociadas con la obesidad.
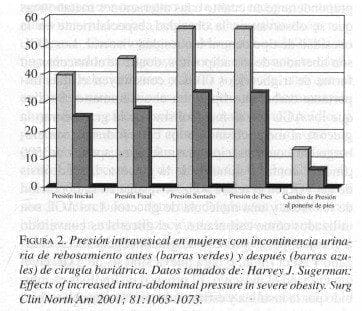
La obesidad central extrema también produce una especie de síndrome de compartimiento abdominal crónico por aumento de la presión intraabdominal (Sugerman 2001). En efecto, la medición de la presión intravesical en mujeres obesas revela niveles muy elevados, lo cual se normaliza con la reducción de peso corporal gracias a cirugía bariátrica. Los fenómenos de comorbilidad asociados con la alta presión intraabdominal en la obesidad masiva incluyen hipoventilación, muy altas presiones de llenamiento cardíaco (presión en la arteria pulmonar y presión en cuña), elevación de la presión en las venas renales y femorales, hipertensión, estasis venosa en las extremidades inferiores, enfermedad por reflujo gastroesofágico, hernias incisionales e incontinencia urinaria de esfuerzo. Algunos autores piensan que la alta presión intraabdominal también contribuye a la aparición de hipertensión arterial, por activación del mecanismo de la renina-angiotensina-aldosterona (Sugerman 2000, 2001).
La obesidad hoy es considerada como una entidad letal; se asocia con enfermedades graves: diabetes mellitus tipo 2, hipertensión arterial, enfermedad cardiovascular, dislipidemia, apoplejía, osteoartritis y degeneraciones articulares, apnea del sueño y varios tipos de cáncer (útero, seno, próstata, colon) (DeMaria & Sugerman 2002; Kral 2001; Sugerman 1992,2000). También se presenta muerte súbita por paro cardíaco, cuya causa no puede ser demostrada en la autopsia (Drenick & Fisler 1988).
En los Estados Unidos la obesidad aparece como la segunda causa de muerte prevenible, después del tabaquismo (Bessler 1999; McGinnis & Foege 1993).
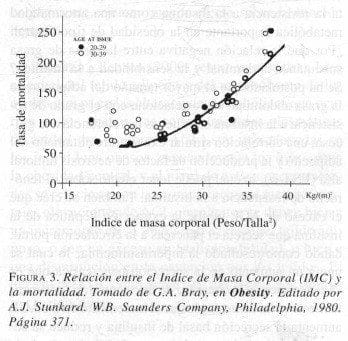
Desde hace años se ha demostrado una relación directa entre el IMC y la mortalidad, como aparece en la Figura 3, adaptada por Bray del Build and Blood Pressure Study de 1959.
Los cirujanos y el personal de salud que trabaja en obesidad encuentran una variedad de alteraciones psicosociales en los pacientes que acuden a solicitar cirugía bariátrica. Aunque la mayoría de ellos demuestra un estado emocional normal, una minoría significativa, entre 19,3% (Black et al 1992) y 28,2% (Powers et al 1997), desarrolla depresión y otras alteraciones que exigen tratamiento con anterioridad a emprender la cirugía bariátrica (Wadden et al 2001a).
S. Klein (2001) resume así las complicaciones asociadas con la obesidad:
• Endocrinas/metabólicas: Síndrome metabólico, resistencia a la insulina, intolerancia a la glucosa, diabetes mellitus tipo 2, dislipidemia, síndrome de ovarios poliquísticos.
• Cardiovasculares: Hipertensión, enfermedad coronaria, falla cardiaca congestiva, disritmias, hipertensión pulmonar, apoplejía isquémica, estasis venosa, trombosis venosa profunda, embolismo pulmonar.
• Respiratorias: Función pulmonar anormal, apnea obstructiva de sueño, síndrome de hipoventilación de la obesidad.
• Gastrointestinales: Enfermedad por reflujo gastroesofágico, coleliitiasis, pancreatitis, hernias abdominales, esteatosis, esteatohepatitis, cirrosis
• Musculoesqueléticas: Osteoartritis, gota, dolor lumbar.
• Ginecológicas: Menstruaciones anormales, infertilidad.
• Genitourinarias: Incontinencia de esfuerzo.
• Neurológicas: Hipertensión intracraneana idiopática (pseudotumor cerebri).
• Cáncer: Esófago, colon, vesícula biliar, próstata, seno, útero, cervix.
Tratamiento Médico de la Obesidad
El tratamiento médico de la obesidad se fundamenta en la restricción de la ingesta calórica mediante dietas debidamente planeadas, en tal forma que el paciente consuma sus depósitos grasos como fuente endógena de calorías.
S. Klein (2000, 2001) resume así los principios que deben ser observados para un manejo exitoso del paciente con exceso de peso:
La obesidad es una enfermedad crónica que requiere un manejo a largo plazo para obtener resultados exitosos.
Una pérdida lenta de peso (<2% del peso corporal por semana) mediante una dieta hipocalórica de 1.000-1.200 kcal/día, que resulta en una pérdida de 8% del peso corporal en 4-6 meses, es más segura que una dieta extremadamente baja en calorías, <800 kcal/día, que resulta en una pérdida de peso del orden de 15-20% en 4 meses. Además de que es difícil mantener la dieta extremadamente hipocalórica y de que esta se acompaña de un incremento en el riesgo de complicaciones, es notoriamente mayor la tendencia a recobrar el peso original que con la dieta moderadamente baja en calorías.
Se requiere una modificación del comportamiento orientada a un cambio a largo plazo en el estilo de vida. La modificación del comportamiento de por sí logra reducir peso, en una magnitud del orden de casi 0,5 kg, ó 0,5% del peso corporal, por semana.
El ejercicio es un componente importante en un régimen de reducción de peso, por cuanto se asocia con resultados satisfactorios a largo plazo y puede tener efectos cardiovasculares y psicológicos benéficos. El ejercicio debe ser de suficiente intensidad para lograr un gasto calórico de unas 2.500 kcal/semana, lo cual quiere decir caminar rápido por 60-75 min/día o aeróbicos, ciclismo o trotar por 30 min/día.
Una pérdida modesta del orden de 5%-10% del peso corporal inicial aporta considerables beneficios y puede ser considerado como el objetivo final en muchos pacientes.
Los fármacos aprobados por la FDA (Food and Drug Administration) de los Estados Unidos aparecen en la tabla siguiente, según S. Klein (2000, 2001). El propósito principal del uso de fármacos es mantener la reducción del peso corporal a largo plazo. En opinión de Klein (2000) no es apropiada la farmacoterapia a corto plazo o como iniciación del régimen, por cuanto la reducción de peso que se logra se revierte en cuanto el paciente deja de tomar el medicamento. O sea, que la farmacoterapia es efectiva sólo cuando hace parte de un régimen total de dieta y ejercicio.
La sibutramina, un agente que induce anorexia, y el orlistato, derivado sintético de un producto del Streptomyces toxycini, que bloquea la absorción de la grasa dietaria, son los dos fármacos de mayor utilización en la actualidad. Deben hacer parte de un programa comprensivo de manejo, el cual debe incluir modificación del comportamiento personal (Klein 2001; Wadden et al 2001b).
Kattah, de la Fundación Santa Fe de Bogotá, en la monografía de J. Duperly (2000) afirma que el tratamiento farmacológico de la obesidad es considerado actualmente como una alternativa que nunca reemplazará al manejo alimentario y la actividad física adecuados, ni se constituirá en su primera instancia. Se emplea fundamentalmente como apoyo durante el periodo de pérdida de peso lenta con el tratamiento nutricional adecuado y en pacientes con apetito descontrolado y altos niveles de ansiedad; rara vez está indicado en casos de obesidad leve. Su indicación reside en el manejo de la obesidad moderada a severa y de la obesidad mórbida (Kattah 2000).

El tratamiento de la persona obesa debe ser individualizado y multidisciplinario. En la Fundación Santa Fe de Bogotá se utiliza un régimen alimentario de disminución calórica progresiva, orientado a lograr una reducción del peso corporal que no exceda 1 kg por semana (Carvajal 2000).
Según Klein (2001), los National Institutes of Health (NIH 1998) recomiendan que las personas con sobrepeso (IMC 25,0-29,9 kg/m2) con dos o más riesgos asociados y las personas con obesidad clase I (IMC 30,0-34,9 kg/m2) disminuyan su ingesta calórica en 500 kcal/semana, restricción que produce una pérdida de 0,45 kg/semana y de 10% del peso corporal en 6 meses. Las personas con obesidad Clase II (IMC 35,0-39,9 kg/m2) y Clase III (IMC ž40 kg/m2) deben disminuir la ingesta en 500-1.000 kcal/día, lo cual resulta en una pérdida de aproximadamente 0,45-0,90 kg/semana. Estas recomendaciones deben ser implementadas bajo la guía y el control de una nutricionista, quien adaptará la dieta mediante selección de alimentos, en tal forma que el paciente pueda seguirla en forma adecuada.
Según Rolls y Bell (2000), la dieta hipocalórica, de 1.000-1.200 kcal/día, que puede reducir el peso en un promedio de 8% en 3 a 12 meses, también debe ser baja en grasa (20-30% de calorías). Pero cuando el consumo energético es inferior a las necesidades, las diferencias metabólicas entre los macronutrientes son mínimas. Se ha podido demostrar que la composición de macronutrientes, independientes de la densidad energética y del buen sabor, tiene poca influencia sobre el consumo de calorías. Una dieta de baja densidad calórica suele ser baja en grasas y alta en carbohidratos complejos y fibra. Los alimentos secos, como las galletas, son de alta densidad calórica y fáciles de consumir en exceso. Por el contrario, las frutas, los vegetales y los granos, y sus productos, son componentes esenciales de la dieta de baja densidad calórica.
Klein (2000) plantea que la dieta hipocalórica de reducción de peso debe proveer una cantidad suficiente de proteína, no menos de 0,8 g/kg del peso ideal, además de vitaminas y minerales. La dieta debe ser de bajo contenido de grasa, no más del 25% del aporte calórico diario. Las dietas extremadamente bajas en el contenido de grasa favorecen la formación de cálculos biliares; por lo tanto, se recomienda proveer 5-10 g de grasa para el estímulo de la contractilidad de la vesícula biliar.
Generalmente no se recomiendan las dietas hiperproteicas como régimen exclusivo de reducción de peso, porque no proveen los alimentos saludables que contienen nutrientes esenciales ni la necesaria variedad de alimentos que aseguran cumplir con todos los requerimientos nutricionales; las personas sometidas a este tipo de régimen pueden ver reducida su ingesta de vitaminas y minerales, con riesgo de desarrollar alteraciones cardiacas, renales, óseas o hepáticas (Jeor et al 2001).
La baja ingesta energética es el componente más importante en un régimen de pérdida de peso. De manera global, el régimen debe ser de no menos de 6 meses, e incluir terapia conductual e incremento de la actividad física.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO