Paragangliomas del Cuerpo Carotídeo
Jaime De la Hoz, MD*, Jorge Brieva, MD**,
Luis Gabriel González, MD***, Juan Carlos Daza****
Resumen
Los paragangliomas son neoplasias derivadas de la cresta neural, benignas en un alto porcentaje y poco comunes. En la cabeza y cuello, los del cuerpo carotídeo, son los de mayor incidencia. Por lo general, se presentan como una masa asintomática y ocurren en personas entre la cuarta y quinta década de la vida. Su aparición se ha relacionado con la vida en las grandes alturas o con enfermedad pulmonar obstructiva crónica (hipoxia crónica), y existe un grupo con tendencia familiar.
Las técnicas de imágenes diagnósticas no invasivas (resonancia magnética, tomografía computarizada, gammagrafía) son los instrumentos ideales para confirmar el diagnóstico. La cirugía se considera la única manera de tratamiento para lograr su curación. En grandes tumores, todavía existe morbilidad de tipo neurovascular durante la extirpación quirúrgica. Para reducir la misma, se ha preconizado la embolización arterial preoperatoria.
Introducción
Los paragangliomas son tumores poco comunes que se presentan en la cabeza y el cuello, con mayor frecuencia. El más común de todos es el que ocurre en el cuerpo carotídeo; este es un pequeño corpúsculo situado en la adventicia de la bifurcación de la carótida común y forma parte del tejido endocrino extraadrenal. Uno de los dos grupos celulares que lo constituyen es rico en gránulos neurosecretorios (catecolaminas), pero los paragangliomas que se originan en ellos no alcanzan a producir manifestaciones clínicas significativas. Solo 3% se consideran funcionales.
Los paraganglios del seno y cuerpo carotídeo poseen funciones quemo y barorreceptoras, es decir, detectan los cambios de presión parcial de oxígeno, del pH y del flujo sanguíneo arterial, de tal modo que una disminución en la PaO2 causa un incremento en la frecuencia y profundidad de la ventilación. Algunos autores señalan un incremento de la incidencia de paragangliomas del cuerpo carotídeo en estados de hipoxia crónica, como se observa en personas que viven en grandes alturas o con enfermedad pulmonar obstructiva crónica (EPOC) (Saldana, 1973).
Estos tumores de crecimiento lento, asintomáticos y casi siempre benignos muy rara vez se malignizan (Monro, 1960). Los adelantos técnicos en imágenes diagnósticas ponen de manifiesto la exactitud de los métodos no invasivos (resonancia magnética (RM), tomografía computarizada (TC) y medicina nuclear (gammagrafía), para identificar estas lesiones; en épocas anteriores a estos avances técnicos, la arteriografía carotídea era el método invasivo más utilizado. El tratamiento ideal de estas neoplasias es la cirugía.
Esta presentación revisa 32 pacientes con paragangliomas del cuerpo carotídeo operados en los hospitales de San Juan de Dios y Santa Clara de Bogotá.
Materiales y Métodos
En el Hospital San Juan de Dios de Bogotá (HSJD), en un período de seis años (1992-1998), se revisaron retrospectivamente las historias de 17 pacientes sometidos a resecciones de tumores del cuerpo carotídeo (paragangliomas), y en el Hospital de Santa Clara (HSC) otras 15 historias con la misma entidad patológica, en un período de 19 años (1983-2002), para un total de 32 intervenciones. Esta serie complementa una prueba realizada en el HSJD (Bozon, Casas, De la Hoz, 1976).
Se describen las características clínicas de los pacientes con paragangliomas del cuerpo carotídeo, sus aspectos semiológicos, técnicas diagnósticas, estrategias terapéuticas y quirúrgicas, y morbilidad inherente al procedimiento. Se enfatiza la anatomía y fisiología de estos paraganglios localizados en la región cervical.
Resultados
Veintiocho mujeres y cuatro hombres, con un promedio de edad de 52 años (rango de 33-68), presentaron una masa, en su mayoría asintomática, de crecimiento lento (promedio de 36 meses), localizada en la región lateral del cuello, por detrás del ángulo inferior del maxilar inferior, con predomino en el lado derecho (24 casos).
Otros síntomas anotados fueron: dolor en la zona afectada con irradiación al oído (siete pacientes), cefalea pulsátil (cuatro), disfagia y disfonía (cuatro). No se registró ningún tumor funcionante, bilateral, ni de tipo familiar. Los métodos diagnósticos más utilizados fueron, inicialmente la arteriografía carotídea, y en los últimos pacientes las técnicas no invasivas (RM, TC, ecografía, gammagrafía y duplex – scan).
En un paciente se realizó aspiración con aguja fina para establecer el diagnóstico, con resultado negativo. La mayor parte de las lesiones se agruparon en las de tipo II de la clasificación de Shamblin. Solo cuatro se clasificaron en el tipo III, grupo en el cual se registró morbilidad neurovascular.
Un accidente cerebrovascular necesitó rehabilitación durante tres meses; en este caso existía un extenso compromiso tumoral circunferencial de los vasos carotídeos. Otro paciente se quejó de parálisis del nervio hipogloso. Los estudios histológicos no reconocieron malignidad. No hubo mortalidad.
Discusión
La primera extirpación de un tumor del cuerpo carotídeo se atribuye a Riegner en 1880, pero el paciente no sobrevivió. Más tarde, Maydl en 1886 removió un paraganglioma del cuerpo carotídeo en un paciente, sin mortalidad, pero con afasia y hemiplejía (McPherson, 1989). Una operación más afortunada la efectuó Albert en 1889, sin ligadura de los vasos carotídeos. En los Estados Unidos, es a Scudder a quien en 1903 se le reconoce la primera resección exitosa de esta lesión. Desde entonces, a pesar de la rareza de esta entidad, la literatura ha registrado gran interés por muchos de sus aspectos anatómicos, fisiológicos, comportamiento clínico y métodos diagnósticos.
Nomenclatura. Muchos son los términos utilizados para denominar a estos tumores: glomus, quemodectomas, tumores no cromafínicos, etc. El origen de muchos de estos términos fue publicado en una excelente revisión (Gulya, 1993), cuyo autor cita a Mulligan como el creador de la palabra quemodectoma en un estudio en animales, porque el tumor del cuerpo carotídeo fue considerado como un quemorreceptor.
Los cuerpos carotídeos y aórticos son los únicos paraganglios conocidos de la cabeza y cuello que se comportan como quemorreceptores. Por consiguiente, quemodectoma es un término inapropiado para describir todos los paragangliomas de la cabeza y el cuello. Otros términos empleados han sido glomocitomas, tumor del cuerpo timpánico y receptomas.
Glenner y Glimley en 1974 publicaron un sistema de nomenclatura (tabla 1) en donde establecen claramente la separación de los tumores desarrollados a partir de tejidos paragangliónicos. Los ubicados en las adrenales son denominados feocromocitomas y los situados por fuera de ellas, es decir, extraadrenales, como paragangliomas; estos últimos fueron divididos en: braquiméricos, intravagales, aórtico-simpáticos y visceroautónomos.
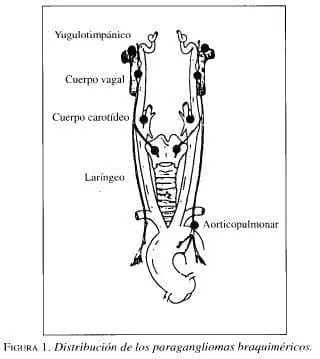
Los braquiméricos fueron clasificados según el sitio anatómico de su ubicación (Ej.:
Aorticopulmonar, coronario, intercarotídeo, yugulatimpánico, laríngeo, orbitario, etc.) (figura 1). A los tumores adrenales se les considera funcionales, porque secretan catecolaminas.
Por el contrario, los paragangliomas generalmente no tienen actividad hormonal. Según esta nomenclatura, los tumores originados en estos últimos tejidos deben denominarse paragangliomas, acompañados del nombre anatómico del lugar de donde surgen. Así, paraganglioma carotídeo, paraganglioma vagal, paraganglioma timpánico, paraganglioma yugular, etc. Los tejidos paragangliónicos contienen dos tipos de células: las células principales y las sustentaculares (Glenner, 1974; Back, 1977) que recuerdan en su fenotipo y función a las células de Schwann.
Las células principales poseen gránulos secretorios que contienen catecolaminas y proteínas ricas en triptófano, característica que las sitúa en el sistema aminoprecursor y captador de descarboxilasa (APUC), comúnmente llamado sistema neuroendocrino difuso. Las células principales o tipo I son inmunorreactivas para la enolasa neurona específica, a la cromogranina A y al sinaptofisín, mientras que las sustentaculares o tipo II son positivas para S-100 y a la proteína fibrilar ácida glial. Como otros órganos endocrinos, los paragangliomas disfrutan de una rica vasculatura, lo cual facilita la secreción de productos granulares al torrente circulatorio.
En los últimos decenios Pearse ha descrito el sistema neuroendocrino difuso como una versión actualizada del APUD (Myssiorek, 2001). Patiño publicó una comprensiva descripción de este sistema, señalando que estas células secretan neurotransmisores y neurohormonas, y que además tienen receptores de membrana similares (Patiño, 1979). De este sistema son las células: C del tiroides, de Merkel, endocrinas de la hipófisis, gastroenteropancreáticas, adrenomedulares, carcinoides, de Schwann y las células principales (Caplin, 1998; Galland, 1993; De la Hoz, 1996).
Los gránulos secretorios de las células principales de los paragangliomas colorean con la hematoxilina de plata (argentación), pero no con el cromato de potasio (no cromafínicas).
El sistema cromafínico, que colorea con las sales cromadas, como sucede con las células de origen adrenal, fue propuesto para diferenciar las células no cromafínicas de las células paraganglionares extraadrenales y, aunque describe las características histológicas de coloración de esos paragangliomas, no reconoce el sitio de origen de donde ellos han surgido.
El término no cromafínico no fue incluido en las clasificaciones posteriores, debido a la carencia de especificidad. El descubrimiento de paragangliomas bioactivos negó este concepto del todo. Las glándulas adrenales, por lo tanto, son depositarias de la más grande colección de células cromafínicas del organismo y el 90% de los tumores de este tipo se originan en ellas (De la Hoz, 1994). El 10% de los tumores restantes son extraadrenales y predominan los paragangliomas solitarios. Los paragangliomas múltiples y feocromocitomas se observan en síndromes familiares, especialmente en los de neoplasias endocrinas múltiples tipo 2A y 2B. El tipo 2A, se conoce también como síndrome de Sipple y se caracteriza por mutaciones en protooncogen RET, sobre el cromosoma 10 (Eng, 1996).
La tríada compuesta por carcinoma medular del tiroides, feocromocitoma o paraganglioma e hiperplasia o adenoma de las paratiroides, es el cuadro clínico patológico de este síndrome. El tipo 2B, posee carcinoma medular del tiroides, feocromocitoma y neuromas mucosos. Carece de componente paratiroideo. Carney señaló en 1979 la asociación de tres constituyentes: paragangliomas, condromas pulmonares y leiomiosarcoma gástrico (síndrome de Carney) (Carney, 1979.)
Anatomía y fisiología.
Desde 1743, cuando Haller descubrió el cuerpo carotídeo, ha existido un gran debate acerca de la función de esta estructura, así como la del seno carotídeo. Por ese tiempo, la diferenciación de estas dos estructuras no fue bien establecida. Los estudios anatómicos e histológicos hicieron creer que el cuerpo carotídeo era un complejo de glándula – nervio de características muy similares a las de la médula adrenal.
Cuando De Castro F. seccionó en 1928 el nervio glosofaríngeo y observó la degeneración neural, comprobó que este nervio era el mayor responsable del componente nervioso del cuerpo carotídeo (Netterville, 1995), lo cual originó un nuevo concepto, apoyado por muchos, de que este corpúsculo era una glándula secretora, controlada por inervación parasimpática.
El concepto glandular fue desaprobado después de nuevos experimentos de De Castro, al seccionar el nervio por encima del ganglio petroso, lo cual permitía la persistencia de fibras nerviosas, estableciéndose en esta forma la naturaleza aferente de la estructura nerviosa. Estos datos demostraron que el cuerpo carotídeo es un órgano receptor.
La inervación del cuerpo y seno carotídeos proviene del nervio de Hering, una rama del tronco del noveno par craneano (glosofaríngeo). Las pequeñas ramas se originan distalmente a 1,5 cm del foramen yugular. Un impulso menor lo recibe del vago y del simpático cervical. El nervio cursa profundamente en relación con el plexo neural intercarotídeo y se divide para enviar ramas tanto al cuerpo como al seno carotídeo (Netterville, 1995).
El seno carotídeo.
Es una estructura casi imperceptible, compuesta de receptores alargados, la cual reposa en la adventicia del bulbo carotídeo, extendiéndose por encima de la horquilla de la bifurcación carotídea. Heath describió en 1983, la histología de la región, ampliando los conocimientos sobre la transmisión de los cambios de presión a través de la pared de la arteria carotídea, en cuya capa media, en su zona más externa adyacente a la adventicia, se encuentran paquetes apretados de fibrillas elásticas, interpuestas entre las fibras no musculares.
La arteria glómica del cuerpo carotídeo está compuesta por estas mismas estructuras altamente elásticas, lo que implica alguna propiedad barorreceptora de esta arteria y de sus ramas iniciales interlobares. La inervación del seno se une con el nervio aferente del cuerpo carotídeo a 1 o 2 cm de la bifurcación carotídea para formar el nervio del seno carotídeo (Netterville, 1995).
La función barorreceptora mediada por el seno carotídeo la describió Hering en 1927, quien notó un mecanismo de retroalimentación negativo sobre la presión sanguínea, asociado con la estimulación de la región del seno. Desde entonces, se han adquirido conocimientos más completos; el seno está formado por dos tipos de barorreceptores que son funcionalmente diferentes.
Los tipos I:
se caracterizan por una tendencia a amortiguar los cambios de presión arterial agudos; estos receptores tienen bajo rendimiento en reposo, que se incrementa dramáticamente cuando un umbral específico de la presión arterial es alcanzado. Los tipos II continuamente descargan a niveles bajos. Cuando se incrementa la presión arterial en el seno, este responde multiplicando sus descargas en una relación presión sensitiva (Netterville, 1995). Estas señales son transmitidas a lo largo del nervio de Hering al glosofaríngeo y, a través de este, al área medular del tallo cerebral.
Señales secundarias excitan el centro vagal de la médula, inhibiendo el centro vasoconstrictor (Neterville, 1995). La respuesta parasimpática resultante es mediada por dos rutas: 1. Vasodilatación venosa y arteriolar a lo largo del sistema circulatorio periférico, y 2. Disminución de la frecuencia cardiaca y fuerza contráctil del corazón. Por consiguiente, el efecto neto de la estimulación de los barorreceptores es una disminución en la presión sanguínea sistémica (Heath, 1991). Las células o receptores tipo I actúan como un regulador en los cambios agudos de la presión arterial.
Los barorreceptores también regulan la presión sanguínea durante los cambios de posición del cuerpo. Cuando se pasa de la posición supina o sentada a la de pie, la presión de la sangre en la cabeza, cuello y extremidades superiores desciende. Los barorreceptores responden inmediatamente a estos cambios, con una disminución en las descargas neurales en el nervio del seno, lo cual reduce los efectos parasimpáticos sobre la frecuencia cardiaca y la vasodilatación periférica. Se produce entonces una fuerte descarga simpática con vasoconstricción periférica y de esta manera se mantiene una adecuada presión sanguínea.
El cuerpo carotídeo.
El segundo receptor, el cuerpo carotídeo, es uno de los paraganglios no cromafínico, situado junto a las ramas de los pares craneanos parasimpáticos.
Está formado por un grupo de células de tipo epitelial, dentro de un estroma de tejido conectivo, ricamente vascularizado, que forma pequeños lóbulos, en número de veinte, en el cuerpo carotídeo humano y están divididos en pequeñas unidades, formando nidos de células o Zolballen (Heath, 1983; Lechter, 1992). Existen dos tipos de células receptoras, que son poligonales y que ultra estructuralmente muestran gránulos neurosecretores que contienen catecolaminas.
Las células sustentaculares son las tipo II (células de soporte), pequeñas e irregulares, situadas entre los sinusoides; las tipo I, están vacías de gránulos neurosecretores. La localización bilateral del cuerpo carotídeo es constante a lo largo del aspecto medial de la bifurcación carotídea. Está conectado a esta estructura por el ligamento de Mayer, un haz fibrovascular que va del polo interior del cuerpo carotídeo a la superficie posterior de la carótida común.
El tamaño promedio de este órgano es de aproximadamente 5 x 3 x 15 mm el suministro sanguíneo proviene de la arteria faríngea ascendente. La hiperplasia bilateral incrementa lentamente con la edad y en habitantes de grandes altitudes se ha observado mayor incidencia (Arias, Bustos, 1976). El peso de la glándula adulta normal es de 12 mg, con un amplio margen entre 1.0 a 47 mg.
En un excelente trabajo sobre el sistema quemorreceptor paragangliónico, Zack y Lauson reunieron una masiva cantidad de datos sobre la fisiología del cuerpo carotídeo (Netterville, 1995). El complejo cuerpo – seno carotídeo ha demostrado ser latente a los cambios en la PaO2, PaCO2, pH y flujo sanguíneo. La sensibilidad a estos factores es favorecida por la alta perfusión de estos tejidos.
Mediante medidas del flujo venoso:
Así como también del consumo de oxígeno, Daly demostró que el flujo sanguíneo era cuatro veces superior al de la glándula tiroides y tres veces el del cerebro (Netterville, 1995). Parece que con este funcionamiento neural continuo, el cuerpo carotídeo participa en la regulación de la ventilación. Cuando la PaO2 disminuye, hay un incremento en la tasa de descargas dentro del nervio del seno carotídeo; de esta manera se produce un aumento en la ventilación. Lo mismo sucede cuando la PaCO2 sube en la sangre arterial.
Los efectos, tanto de la hipoxia como de la hipercapnia, son suficientemente aditivos para marcar un notorio incremento en las descargas del nervio del seno (Netterville, 1995). Es tal la sensibilidad de este sistema que permite cambios regulatorios que ocurren dentro de un simple ciclo respiratorio. A pesar de la exactitud de este control, aún existe incertidumbre en cuanto al papel fisiológico completo de los quemorreceptores en la regulación de la ventilación.
Los efectos de los cambios del pH y la temperatura son más indirectos y es posible que ejerzan influencia a través de sus acciones sobre la presión parcial de los gases. La hipoxia crónica es controlada por mecanismos centrales, con pequeña participación del cuerpo carotídeo. Al lado de este último se observa la función quemorreceptora en los paraganglios cardioaórticos. Aunque estos receptores trabajan en paralelo, no compensan totalmente la pérdida de la función del cuerpo carotídeo.

CLIC AQUÍ Y DÉJANOS TU COMENTARIO