Sepsis Abdominal
NIETO J.A., MD, SCC.
Palabras clave: Sepsis intraabdominal, Perforación de víscera hueca, Control del foco de infección, Terapia antibiótica.
A pesar de una amplia gama de opciones terapéuticas para el tratamiento de la infección intraabdominal, la morbilidad y la mortalidad continúan permaneciendo altas en los estados clínicos ocasionados por la perforación de una víscera hueca. La terapia establecida incluye el control de la perforación, drenaje y desbridamiento del foco de la infección, adecuado manejo antibiótico y medidas de soporte sistémico tales como una adecuada oxigenación, soporte del volumen intravascular y reposición nutricional. La terapia antibiótica debe orientarse al control de gérmenes Gram negativos aeróbicos, tales como la Escherichia coli y gérmenes del grupo aeróbico como Bacteroides fragilis con el fin de reducir la morbilidad derivada de esta situación.
Introducción
La infección intraabdominal continúa siendo una de las principales causas de morbilidad y mortalidad. La mortalidad puede oscilar desde 1% en pacientes con perforación apendicular, hasta 20% en los que sufren una perforación del colon o han presentado una infección derivada de un trauma abdominal penetrante (1). Las complicaciones derivadas de una intervención quirúrgica para una infección intraabdominal incluyen entre otras, infección de la herida quirúrgica, infecciones necrotizantes de las fascias de la pared abdominal y abscesos intraabdominales, sin olvidar las consecuencias sistémicas derivadas.
A principios de siglo la mortalidad general para sepsis abdominal oscilaba alrededor de 90%; en la década de los años 20 los principios definidos por el doctor Kischner, a saber: 1) Eliminar la fuente de infección. 2) Remover el pus y los detritus intraabdominales permitió que la mortalidad bajara a 50%.
Entre 1930 y 1960 luego del advenimiento de la era antibiótica con el descubrimiento de la penicilina, la mortalidad derivada de la sepsis abdominal presenta muy poca variación; lo anterior se atribuye a la confianza del grupo de cirujanos en las bondades terapéuticas del antibiótico, descuidando los principios quirúrgicos definidos por Kirschner. Sólo hasta la aparición de las penicilinas de amplio espectro y de las cefalosporinas, junto con la llegada de la terapia antia-naeróbica se observa una nueva disminución en la mortalidad por sepsis intraabdominal.
La creación de las unidades de cuidado intensivo, el soporte nutricional, la definición y aplicación de nuevos conceptos en el tratamiento quirúrgico de la sepsis de origen intraabdominal, marcan un nuevo descenso en la mortalidad, que aún hoy en las puertas del siglo XXI, sigue cobrando tasas prohibitivas de mortalidad (2).
Fisiología del Peritoneo
La cavidad peritoneal es el mayor espacio extravascular del organismo; tiene una superficie de 1.72 m2, equivalente a la superficie cutánea de un adulto. En condiciones de normalidad sólo contiene aproximadamente 50 mL de un líquido citrino con una densidad aproximada de 1.016; su contenido proteico es inferior a 3 g% dentro de los que predomina la albúmina; no contiene fibrinógeno y su capacidad para coagular en forma espontánea es nula; su actividad antibacteriana es mínima y se encuentra mediada fundamentalmente por el sistema del complemento (3).
La concentración de sus solutos es sensiblemente igual a la del plasma sanguíneo, su celularidad es baja, contiene alrededor de 3.000 células por mL, el 50% representado por macrófagos, el 40% por linfocitos, algunos eosinófilos, mastocitos y células mesoteliales (4).
La serosa peritoneal se comporta como una barrera pasiva, semipermeable al paso del agua y sustancias de bajo peso molecular; esta cualidad es lo que ha permitido el empleo de la diálisis peritoneal en casos de insuficiencia renal. Estudios en pacientes renales han permitido establecer que la superficie de intercambio eficaz es de aproximadamente 1 m2. y que la eficiencia del peritoneo para el intercambio de agua y solutos puede ser incrementada por agentes farmacológicos que aumenten el flujo o la permeabilidad esplácnica.
Durante el proceso de diálisis peritoneal las soluciones hiperosmolares pueden ocasionar un flujo de agua hacia la cavidad peritoneal entre 300 y 500 mL por hora (4). El proceso de la peritonitis tiene un efecto similar, de manera tal que el shock hipovolémico secundario a esta situación puede comprometer rápidamente la hemodinamia del paciente no tratado. Los elementos químicos como la bilis, enzimas pancreáticas y el jugo gástrico potencian esta exudación. Se ha considerado que la pérdida de líquidos durante una peritonitis es equivalente a la que se produce durante una quemadura del 60% de la superficie cutánea (5).
Aunque toda la superficie peritoneal participa en el intercambio de líquidos y solutos de bajo peso molecular, las partículas sólo pueden ser reabsorbidas a través de los linfáticos diafragmáticos debido a las características especiales del mesotelio y los linfáticos de esta zona.
En la mayor parte de la cavidad abdominal, las células mesoteliales forman un tapiz aplanado y compacto, cuyos límites intercelulares no se aprecian. Sin embargo, en la cara inferior del diafragma existen unos estomas linfáticos especiales inmediatamente debajo de la membrana mesotelial; estos estomas que fueron descritos inicialmente por Von Recklinhausen en 1963 (5), sirven para el drenaje linfático de la cavidad peritoneal. La relajación pasiva del diafragma durante la espiración provoca un rápido flujo del líquido peritoneal hacia ellos, su contracción, provoca el vaciamiento de los linfáticos hacia los canales eferentes, situación que se ve favorecida con el aumento de la presión intratorácica durante la inspiración (6). El flujo retrógrado se ve impedido por la existencia en estos vasos linfáticos de válvulas unidireccionales (2, 5).
El tamaño de estos estomas es de 8 a 12 micras y determina el tamaño de las partículas que por ellos se absorben. Las bacterias con un diámetro entre 0.5 y 2 micras son rápidamente eliminadas de la cavidad abdominal. Experimentalmente se ha demostrado que luego de la inoculación intraperitoneal de bacterias, éstas son aisladas a los 6 minutos en el canal torácico, y en la sangre periférica a los 12 minutos (5). La salida del líquido peritoneal determina la creación de una presión negativa relativa dentro del abdomen superior lo que da lugar al flujo del líquido peritoneal en dirección cefálica. Esto fue comprobado por Autio en 1964 colocando medio de contraste en la región ileocecal durante apendicectomías o colecistectomías programadas; observó cómo el medio de contraste se localizaba en la pelvis, en las goteras parietocólicas y en los espacios subfrénicos derecho e izquierdo (7).
Si bien es cierto que en el hombre la vía exacta de drenaje de los linfáticos diafragmáticos no se conoce con exactitud, también lo es que durante la necropsia de pacientes fallecidos de peritonitis se han encontrado repletos de bacterias los linfáticos mediastinales anteriores, en tanto que el resto de la cavidad torácica se encontró completamente estéril (8). Estos estudios que determinaron la diseminación del material contaminado a partir de una perforación visceral, coinciden con la localización de los abscesos que se encuentran en los casos de cirugía de la peritonitis (9).
Factores Determinantes en la Patogénesis de la Infección Intra Abdominal
La infección intraabdominal por lo general se inicia por una perforación biliar o entérica dentro de la cavidad abdominal que permite la liberación de microorganismos en la cavidad peritoneal. La circulación del peritoneo que ya se mencionó facilita la diseminación de los gérmenes contaminantes. Otro grupo patológico que puede derivar en un cuadro de sepsis abdominal, lo conforman aquellas entidades que dentro de su historia natural no cursan con el fenómeno de perforación de víscera hueca y en donde a la luz de los actuales conocimientos la translocación bacteriana desempeña un papel predominante.
Cuando ocurre la perforación de una víscera hueca, sea por una situación que determine fenómenos obstructivos que impidan la propulsión de su contenido, estableciéndose el síndrome de víscera hueca, o por lesiones que en algún momento de su evolución alteran la integridad anatómica y funcional de la pared, se establece una situación altamente agresiva para la homeostasis del paciente y en ella la intervención quirúrgica no tiene discusión. Si bien es cierto que la cavidad abdominal puede neutrlizar un episodio simple de contaminación, y esto se ha observado en perforaciones gástricas e incluso duodenales que evolucionan satisfactoriamente sin la intervención quirúrgica pues los mecanismos de defensa abdominal están en condiciones de controlarlo. Pero si la contaminación es continua origina secuestro de líquidos, hipovolemia hipoperfusión, absorción de toxinas, liberación de mediadores inflamatorios, fenómenos de sépsis, formación de abscesos y puede evolucionar a falla multiorgánica (4, 10).
Otro factor que también puede originar un cuadro de sepsis intrabadominal se relaciona con la patología inflamatoria infecciosa de las vísceras macizas, hígado, páncreas, etc. En ellas es fundamental el diagnóstico etiológico y topográfico; y a él sólo se llega mediante un minucioso análisis de la historia clínica y de los hallazgos obtenidos durante la exploración física y una evaluación juiciosa de las pruebas paraclínicas.
El número de bacterias
Como fuente de patógenos, el tracto gastrointestinal contiene más de 400 especies de bacterias, con una concentración que puede variar según la altura en el tubo digestivo en que se produce la perforación, y oscila entre 1.000 bacterias por mL en el esófago y estómago normales, hasta 3.8 * 1012-14 por mg de materia fecal seca en el colon (2). Su distribución depende del estado funcional del órgano y en muchas ocasiones de la terapéutica de base. La flora gástrica puede cambiar en presencia de CA. gástrico o con el empleo prolongado de antiácidos y la densidad de gérmenes anaerobios se incrementa en los casos de obstrucción intestinal; de esta gran masa bacteriana son pocos los gérmenes patógenos que sobreviven en la cavidad peritoneal luego de una perforación. Dentro de estos, los más afectados son los gérmenes aeróbicos obligados que mueren en la medida en que la concentración de oxígeno disminuye en la cavidad durante el proceso de la peritonitis (11).
Sinergismo bacteriano
En la evolución de un cuadro de contaminación peritoneal hay que tener en cuenta que esta entidad suele ser una infección polimicrobiana y que ciertos datos inducen a creer que algunas bacterias interactúan con el huésped con el fin de sobrevivir en la cavidad peritoneal, más aún cuando se ha demostrado que la combinación de gérmenes aerobios y anaerobios lleva con facilidad a la formación de abscesos intraabdominales (1, 12, 13).
Esta naturaleza polimicrobiana de la infección intraabdominal representa un verdadero sinergismo entre los gérmenes responsables de la infección, manifestado entre otros aspectos por el tipo bifásico que presentan las peritonitis. En una primera etapa que se extiende por lo general del primero al séptimo día de evolución, predominan los fenómenos de sepsis provocados en gran medida por las endotoxinas bacterianas de los gérmenes Gram negativos, específicamente la Escherichia coli, en la medida en que los mecanismos de defensa del peritoneo consumen oxígeno, la concentración de este gas dentro de la cavidad abdominal disminuye, permitiendo la proliferación de gérmenes anaerobios, estableciéndose la fase de formación de abscesos del quinto al séptimo día en adelante (4).
Estudios realizados en el modelo animal de experimentación demostraron que la introducción de Bacteroides fragilis o Fusobacterias como germen único dentro de la cavidad peritoneal (13) o por infusión intravascular directa (14,15) no demostraron ninguna secuela infecciosa, sin que se establecieran fenómenos de sepsis o de formación de abscesos y con un 0% de mortalidad. Si el germen inoculado fue el Enterococo, grampositivo aeróbico, los resultados fueron similares. Si el inóculo bacteriano fue de Escherichia coli como germen único, se obtuvo la reproducción de la fase séptica con una mortalidad de 30% de los especímenes de laboratorio (13).
Los mismos investigadores demostraron claramente un sinergismo y exacerbación de la infección con reproducción de la fase séptica y de formación de abscesos si se combinaban E. coli y B. fragilis dentro de la cavidad peritoneal (13). Varios estudios controlados realizados en animales han demostrado que el empleo de antibióticos sistémicos contra estos dos microorganismos determina un incremento en las ratas de supervivencia y una disminución en las ratas de formación de abscesos (16, 17). Sin embargo, una vez estabilizado el cuadro de contaminación peritoneal, la eliminación de uno de los microorganismos no acaba con la infección, posiblemente porque el absceso es un proceso inflamatorio autosuficiente, o en razón de que el crecimiento bacteriano se encuentra retardado en su interior facilitando la aparición de mutantes, resistentes a la acción de los antimicrobianos (4).
Son numerosos los mecanismos propuestos para el sinergismo bacteriano; se especula con la producción de un factor de crecimiento o medio nutritivo producido por una bacteria que permitiría el crecimiento de otra más virulenta. También se ha mencionado la producción de secreciones bacterianas que protegen a otras bacterias de los mecanismos de defensa del huésped y de la formación de un medio adecuado para el crecimiento de un germen patógeno; ya anteriormente habíamos mencionado que el consumo de oxígeno por parte de las bacterias aerobias, favorecía el crecimiento de gérmenes anaerobios (1, 12).
Aunque la peritonitis se ha analizado generalmente como una entidad única, debe enfatizarse que en realidad las peritonitis en realidad agrupan una gran cantidad de patologías según el número de órganos comprometidos en la falla multiorgánica. La primera variable que separa los casos moderados de los severos es el número de bacterias residentes en el área del tracto digestivo en donde la perforación ocurre.
Consecuentemente con lo anterior, en una perforación gástrica secundaria a una úlcera péptica en condiciones normales de acidez, el recuento bacteriano es muy bajo y con predominio de gérmenes grampositivos. Por el contrario, en una perforación del apéndice se encuentran concentraciones de gérmenes que oscilan entre 10 (6) y 10 (7) por g de contenido apen-dicular. Perforaciones a nivel del rectosigmoide se encuentran asociadas con concentraciones bacterianas entre 10 (10) y 10 (11) por g de materia fecal, equivalente a 60% del peso de la materia fecal seca; además, la relación de aerobios y anaerobios es de 1:10.000 (1, 4).
Obstrucción
Otros hechos que incrementan el número de bacterias contaminantes son los cuadros de obstrucción asociados con estrangulación y perforación. En esta situación el fluido intestinal proximal al sitio de obstrucción presenta una mayor concentración de microorganismos. Igualmente, situaciones de obstrucción pilórica se encuentran asociadas a un incremento notable del recuento bacteriano, hecho no observado en el estómago cuando no existe obstrucción a su evacuación.
El aspecto importante por considerar es que como regla general, la densidad de microorganismos se incrementa de manera logarítmica en presencia de una obstrucción distal del intestino. Esto significa, que perforaciones gástricas o del colon secundarias a procesos obstructivos o tumorales obstructivos, si bien determinan la aparición de cuadros de peritonitis, éstos son mucho más virulentos que cuando la contaminación se deriva de situaciones con las cuales no cursa simultáneamente un proceso obstructivo.
Hemoglobina
Aunque la cantidad de bacterias puede ser determinante en la severidad de la peritonitis, hay una serie de factores coadyuvantes que pueden aumentar la rata de proliferación bacteriana y de la virulencia de la peritonitis. La presencia de hemoglobina promueve esta proliferación (18). La degradación de la hemoglobina en la cavidad peritoneal facilita un substrato proteico para la actividad metabólica bacteriana, y más importante aún, es una fuente importante de hierro. El hierro es un elemento traza crítico para el crecimiento y la proliferación bacteriana, su presencia acelera la replicación de las bacterias. También se ha demostrado que el metabolismo bacteriano de la hemoglobina produce como subproducto una leucotoxina que aumenta el poder de invasión de la infección (19).
Pigmentos biliares
La acción coadyuvante de los pigmentos biliares en el desarrollo de la peritonitis, probablemente se encuentra relacionada con sus propiedades detergentes, que disminuyen la tensión superficial e interfieren con los mecanismos de defensa del peritoneo mediados por la fibrina en su intento de sellar la perforación y aislar el foco de contaminación (4).
Cuerpos extraños
Los detritos y el material no digerido proveniente de perforaciones intestinales son una fuente importante de elementos que determinan reacción a cuerpo extraño. Los materiales de sutura o cuerpos extraños introducidos dentro del abdomen durante traumas penetrantes también pueden determinar incrementos del recuento bacteriano. El tejido desvitalizado asociado a lesiones traumáticas puede albergar un gran número de bacterias que difícilmente pueden ser atacados por el sistema fagocítico del huésped.
Factores sistémicos
Los factores sistémicos que alteran la respuesta del huésped a la infección pueden incrementar la virulencia de la peritonitis (20). Enfermedades preexistentes como la diabetes, la desnutrición proteico-calórica, incrementan la susceptibilidad del huésped a la infección. La obesidad, aumenta el contenido de grasa en el epiplón y el mesenterio, así como la grasa profunda de la pared abdominal ocasiona problemas en la respuesta del huésped a la contaminación de los tejidos. El alcoholismo crónico causa debilitamiento de las funciones sistémicas. La terapia con medicamentos que afectan el sistema inmunólogico como los corticoides y antineoplásicos, incrementan la virulencia de la peritonitis. Igualmente ocurre en pacientes afectados por el virus de inmunodeficiencia humana (VIH).
Interacción de la Contaminación y el Peritoneo
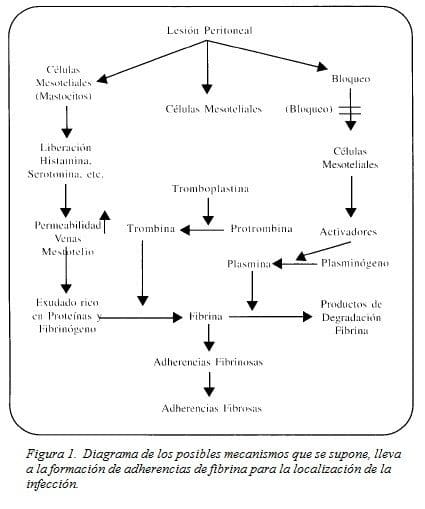
La lesión de las células mesoteliales del peritoneo por el efecto de la infección, determina una degranulación de los mastocitos peritoneales, ocasionando la liberación de cantidades importantes de histamina, serotonina y péptidos vasoactivos que determinan un aumento importante en la permeabilidad vascular esplácnica. Esto facilita el paso a la cavidad abdominal de líquidos ricos en contenido proteico y con una alta cantidad de fibrinógeno. De otra parte estas células mesoteliales al ser agredidas liberan tromboplastina que convierte la protrombina en trombina y esta última transforma el fibrinógeno en fibrina que adhiere a las superficies adyacentes (4).
Un activador del plasminógeno que se encuentra en las células mesoteliales y que en condiciones de normalidad activa las enzimas fibrinolíticas que impiden la formación de adherencias de fibrina, disminuye su actividad en presencia de lesión peritoneal, y la peritonitis bacteriana paraliza por completo su actividad. Al no actuar este activador del plasminógeno las adherencias de fibrina permanecen hasta que la producción de colágeno las convierte en adherencias fibrosas (Figura 1).
Modificado de: Hau T, Payne WD, Simmons, R. L., Howard, R. J.En Simmons RL, Howard RJ. Infecciones Quirurgicas 1984, 1ª Ed. Barcelona Salvat Editores S.A. 817 – 863.
Simultáneamente con las acciones anteriores orientadas a la localización de la infección, la lesión de las células mesoteliales activa el complemento, iniciando de esta manera el fenómeno de la quimiotaxis y liberación de opsoninas; esto determina gracias al aumento de la permeabilidad del endotelio vascular, la llegada de granulocitos y el inicio de la fagocitosis bacteriana (10).
La interacción de los fagocitos y las defensas del huésped actuando contra la proliferación bacteriana puede tomar tres vías:
Primero, el inóculo bacteriano y su rata de proliferación puede superar a las defensas locales (abdominales) del huésped, determinando una diseminación sistémica de los microorganismos y una respuesta séptica del huésped.
Segundo, el número y virulencia de los gérmenes pueden ser mínimos y las defensas del huésped pueden erradicar completamente del abdomen los patógenos potenciales y resolverse la peritonitis. Esto puede ocurrir en pacientes con úlcera péptica perforada con acidez normal.
En tercer lugar, la alta concentración de microor-ganismos puede ser localizada pero no erradicada por las defensas del huésped, esto lleva a la formación de abscesos por la formación de adherencias, previamente analizada.
Desde el punto de vista mecánico la movilidad diafragmática inicia a través de los linfáticos la depuración de bacterias para enfrentarlas a las defensas sistémicas. Si los mecanismos de defensa del peritoneo tienen éxito, se produce la muerte bacteriana y la localización de la infección; de lo contrario, se establecen los fenómenos de sepsis, falla multiorgánica y muerte del paciente.
Mientras esta cadena de hechos ocurre dentro de la cavidad peritoneal, sistémicamente y en forma simultánea entran en acción otra serie de mecanismos, encaminados también a controlar el proceso infeccioso.
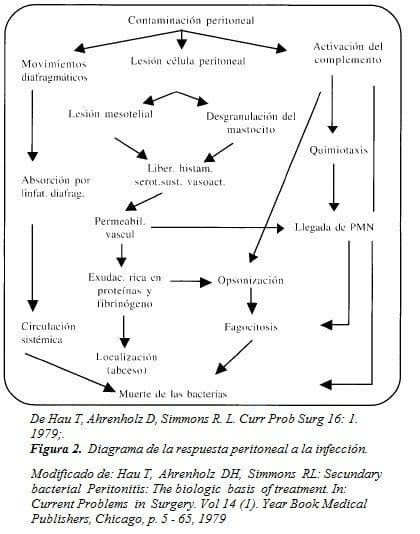
Al presentarse la contaminación peritoneal, el primer mecanismo como ya se ha mencionado, que entra en función es la depuración de bacterias a través de los linfáticos diafragmáticos facilitando la absorción de bacterias a partir de la cavidad abdominal, llevándolos a la circulación sistémica. De otra parte, la lesión de células mesoteliales en respuesta a la agresión inflamatoria provoca la desgranulación de los mastocitos peritoneales, que liberan sustancias vasoactivas que aumentan la permeabilidad vascular facilitando la llegada de plasma rico en complemento y opsoninas séricas que a su vez se unen a las bacterias, facilitando su destrucción por los fagocitos. Los depósitos de fibrina, localizan la infección aislando y en ocasiones sellando la perforación, retardando la absorción bacteriana, que podría dar lugar a un shock endotóxico (21). (Figura 2).
La rápida llegada de los neutrófilos, unas 4 horas aproximadamente, seguida de los macrófagos, constituye probablemente la principal defensa de la cavidad abdominal frente a la contaminación masiva (6)
Desafortunadamente toda esta serie de mecanismos de defensa que pone en juego la cavidad peritoneal, además de los efectos benéficos que tiene, también causa situaciones desfavorables en forma sistémica para el huésped.
La depuración bacteriana a través de los linfáticos diafrag-máticos, determina bacteremia, la acción de la endotoxina bacteriana y la liberación de citokinas por los neutrófilos y macrófagos alteran la captación de oxígeno por la célula, alterándose el gasto cardíaco y la oxigenación. Hay hipovolemia por pérdida de líquidos al espacio extravascular; aparece shock hipovolémico con alteración de la perfusión renal y de la microcirculación, así como alteraciones metabólicas que finalmente pueden llevar a disfunción orgánica múltiple (22). Se establecen fenómenos de sepsis sistémica con un cuadro de respuesta inflamatoria, caracterizado por fiebre, leucocitosis, hipermetabolismo, hipoperfusión, hipotensión e hipoxia celular.
De otra parte este gran flujo de líquidos ocasiona otra serie de problemas; la gran distancia existente dentro de la cavidad abdominal distendida por líquido, la pobre solubilidad del oxígeno en este medio y el consumo que de él hacen las bacterias aeróbicas, llevan a una disminución del potencial de oxígeno, lo cual facilita la proliferación de gérmenes anaerobios (23). Además, estas grandes cantidades de líquido exceden la capacidad de depuración de los linfáticos del diafragma y el alto consumo de opsoninas que se produce en los líquidos inflamatorios, permite que los gérmenes supervivientes y no depurados proliferen y no sean fagocitados (5).
La formación de adherencias de fibrina que hace unos momentos nos parecía un excelente mecanismo de defensa, también ocluye los estomas diafragmáticos y al aislar los gérmenes impiden la acción de los agentes antimicrobianos.
Clasificación de la Peritonitis
1. Peritonitis primaria
El término peritonitis primaria, se refiere a una contaminación del peritoneo de fuente extraabdominal; en la gran mayoría de los casos por vía hematógena. Ella aparece tanto en niños como adultos y es más frecuente en las mujeres que en los hombres por la comunicación existente entre la cavidad peritoneal y la vagina a través de las trompas de Falopio. Los patógenos más comunmente encontrados son de tipo grampositivo: meningococo, gonococo, estafilococo y estreptococo hemolítico.
Ejemplo de este estado patológico es la peritonitis espontánea de la infancia, generalmente ocasionada por el estreptococo hemolítico y el neumococo, cuyo foco primario puede ser una otitis, pero también se ha descrito en infantes con síndrome nefrótico y lupus eritematoso. Otro ejemplo de este tipo de peritonitis es la peritonitis espontánea del adulto, observada con frecuencia en pacientes con ascitis secundaria a cirrosis hepática; el espectro bacteriano ha cambiado con relación a la década de los ochenta; en el momento se encuentra representado por gérmenes coliformes.
Otros ejemplos de este tipo de peritonitis son, la peritonitis secundaria a la diálisis peritoneal ambulatoria continua (CAPD) ocasionada generalmente por gérmenes Gram positivos y ocasionalmente por pseudomona aeruginosa; la peritonitis tuberculosa, cuya incidencia se ha incrementado últimamente con relación al aumento del síndrome de inmunodeficiencia adquirida (SIDA), por infección con el VIH. En nuestro Servicio de Cirugía del Hospital Militar Central, hemos observado tres casos de peritonitis tuberculosa en pacientes con SIDA en los últimos 3 años; igualmente, en el Servicio de Cirugía de la Clínica Nueva hemos encontrado una peritonitis tuberculosa y una por cándida en 2 pacientes con este tipo de patología.
2. Peritonitis secundaria
Es la forma de peritonitis que con mayor frecuencia encontramos en pacientes con sepsis intraabdominal (21). Aproximadamente el 80% de los casos se originan en una gran variedad de procesos necróticos del tracto gastrointestinal y de otros órganos intraabdominales; un 10 a 20% se derivan de cirugías abdominales ( peritonitis postoperatorias ).
3. Peritonitis terciaria
Por lo general aparece en pacientes inmunosuprimidos por diferentes causas, en donde los mecanismos de defensa son inhábiles para controlar una infección sobreagregada, desarrollando una peritonitis difusa que de acuerdo con Rotstein y Meakins (19, 24), debe ser denominada peri-tonitis terciaria.
Su cuadro clínico es el de una sepsis oculta, manifestada por estado cardiovascular hiperdinámico, fiebre de bajo grado y estado hipermetabólico. Son objeto de numerosas exploraciones abdominales con el fin de drenar colecciones líquidas infectadas. Estas colecciones se diferencian de los abscesos por el hecho de no ser localizadas sino difusas, las bacterias aisladas son de bajo grado de patogenicidad y seleccionadas por múltiples tratamiento antibióticos, se aíslan estafilococos coagulasa negativa, pseudomonas y hongos. Estos pacientes desarrollan casi siempre un cuadro de falla múltiple de órganos y por lo general fallecen.
Cuadro Clínico
En los libros de texto la descripción de la peritonitis se equipara con la del abdomen agudo, pero no es posible generalizar este término; de hecho las manifestaciones varían según la enfermedad específica que la originó, su localización, relación con otras vísceras, con las superficies serosas y con factores específicos del huésped como la inmunosupresión o las intervenciones quirúrgicas recientes.
El dolor es de aparición rápida y puede ser súbito como en la úlcera perforada o instaurarse a lo largo de varias horas como en la apendicitis. Aunque en el momento del inicio es localizado, se generaliza con rapidez, los movimientos e incluso la respiración lo agravan y en la medida que progresa en el tiempo aparece la rigidez abdominal.
Desde un principio se hacen presentes la anorexia y, predominantemente, las náuseas y el vómito, aparece deshidratación manifestada por sed y oliguria, hay distensión y silencio abdominal como expresiones del íleo paralítico y casi siempre, a excepción de pacientes inmunosuprimidos, hay estado febril y taquicardia. Inicialmente el paciente permanece alerta e irritable, pero si no se establece rápidamente el tratamiento, se torna obnubilado en forma paulatina.
Si no se controla adecuadamente puede detectarse la aparición de shock hiperdinámico, incremento progresivo de los niveles de glucosa como manifestación de gluconeogénesis, disminución en la captación arteriovenosa de oxígeno y acidosis metabólica mucho antes de que aparezca cualquier otro signo.
Doctor: Julio Alberto Nieto Silva, Prof. Tit. de Cir. de la Universidad Militar, Director Científico de la “Clínica Nueva” de Bogotá, Miembro del Comité de Infecciones de la SCC. Santa Fe de Bogotá, Colombia.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO